Донецкий Национальный Технический Университет
Факультет "Компьютерные информационные технологии и автоматика"
Кафедра АСУ
Автор
: Порываев Александр МихайловичНазвание
:"Разработка специализированной компьютерной системы определения стадий апоптоза посредством оболочки Clips"
Специальность :
Компьютерные системы медицинской и технической диагностики
Код специальности
: 7.091505Категория
: Автореферат магистерской выпускной работыРуководитель
: Адамов В.Г.Донецк, 2002 г.
E-mail: proz@mail8.donntu.ru
1 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
1.1 Актуальность темы
Апоптоз у человека стал неотъемлемым инструментом для осуществления наследственного и приобретенного, гуморального и клеточного ответа иммунной системы. Исследования в области апоптоза открывают новые перспективы в клеточной биологии и иммунологии.
Проблема исследования молекулярных механизмов запрограммированной гибели клетки стала в последние годы одной из самых трудных и актуальных проблем биологических наук. Трудность этой проблемы, очевидна: несмотря на большое количество экспериментальных данных, до сих пор остаются не исследованными механизмы этого явления, не до конца выяснена регуляция апоптоза отдельных клеток в целостном многоклеточном организме. Актуальность этой проблемы определяется взаимосвязью нарушения регуляции процесса запрограммированной гибели клетки с большинством заболеваний. Выявление конкретных механизмов нарушения регуляции апоптоза, сопровождаемых конкретными заболеваниями, позволит определить этиологию и патогенез данных заболеваний.
Проблема которую я намерен решить в данной работе связана с тем что апоптоз протекает крайне быстро и проанализировать врачам большое количество клеток крови одного человека в короткий промежуток времени очень сложно. Специализированная компьютерная система которую я проектирую должна решить эту проблему.
1.2 Цель работы
Целью выполнения магистерской работы является определение стадий апоптоза посредством оболочки Clips. Общую задачу - создание специализированной компьютерной системы. В свою очередь главную задачу можно разделить на составные части:
- Исследование состояний вопроса и постановка задачи.
- Накопление базы снимков.
- Формализация вопроса диагностики заболевания посредством апоптоза клеток.
- Фильтрация снимков.
- Методы фильтрации изображения.
- Программная реализация фильтрации.
- Создание базы данных обследуемых пациентов.
- Анализ методов оконтуривания и оценки параметров снимков клеток.
- Метод оконтуривания изображения.
- Обоснование выбора математического метода для оценки параметров изображения.
- Программная реализация оконтуривания клетки на снимке.
- Создание экспертной системы посредством оболочки CLIPS.
- Экспериментальная проверка работы системы, определение точности.
1.3 Научная новизна
Апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза - подразумевается возможность терапевтического вмешательства, если вследствие некроза - нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток. Так, сведения о рецептор- опосредованной регуляции апоптоза клеток позволяют использовать их для терапии гормон- зависимых новообразований. С использованием андроген- блокирующей терапии лечат рак простаты. Рак молочной железы часто подвергается регрессии при применении антагонистов эстрогеновых рецепторов. Информация о биохимических сигнал- передающих путях регуляции апоптоза позволяет эффективно применять антиоксидантную терапию, а также использовать препараты, регулирующие концентрацию кальция, либо активирующие (ингибирующие) различные протеинкиназы, с целью коррекции апоптоза в различных типах клеток. Осознание роли апоптоза в гибели клеток интенсифицировало поиск фармакологических средств, защищающих их от апоптоза. Активно изучаются ингибиторы специфических протеаз в качестве фармакологических агентов.
Новизна заключается в разбиении апоптоза на стадии по морфологическим признакам, информативность признака расстоянием между гистограммами значений этого признака для различных клинических ситуаций . В соответствии с этой идеей признаки упорядочиваются по их весу для решения дифференциально-диагностических и прогностических задач, исключаются из рассмотрения малоинформативные признаки и последовательно суммируются отношения вероятностей оставшихся. Решение принимается, когда эта сумма достигает пороговых значений.
Модернизация идей неоднородной последовательной процедуры и привлечение вычислительных возможностей ЭВМ позволит создать эффективную автоматизированную систему анализа данных и эмпирического медико-биологического познания.
1.4 Методы исследования
Создание экспертной системы следующей структуры:
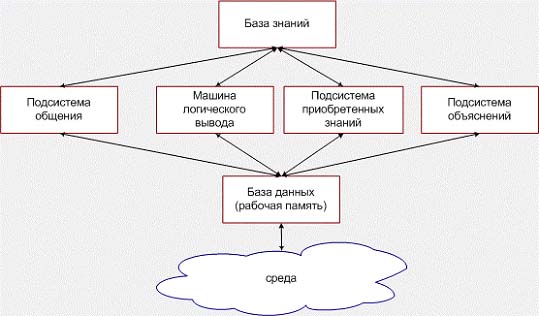
ЭС состоит из следующих компонент:
o База знаний предназначена для хранения экспертных знаний о предметной области, используемых при решении задач экспертной системой. База знаний состоит из набора фреймов и правил-продукций.
o Фреймы используются в базе знаний для описания объектов, событий, ситуаций, прочих понятий и взаимосвязей между ними.
o Правила используются в базе знаний для описания отношений между объектами, событиями, ситуациями и прочими понятиями. На основе отношений, задаваемых в правилах, выполняется логический вывод. В условиях и заключениях правил присутствуют ссылки на фреймы и их слоты.
· База данных предназначена для временного хранения фактов или гипотез, являющихся промежуточными решениями или результатом общения системы с внешней средой, в качестве которой обычно выступает человек, ведущий диалог с экспертной системой.
· Машина логического вывода - механизм рассуждений, оперирующий знаниями и данными с целью получения новых данных из знаний и других данных, имеющихся в рабочей памяти. Для этого обычно используется программно реализованный механизм дедуктивного логического вывода (какая- либо его разновидность) или механизм поиска решения в сети фреймов или семантической сети. Машина логического вывода может реализовывать рассуждения в виде:
o дедуктивного вывода (прямого, обратного, смешанного);
o нечеткого вывода;
o вероятностного вывода;
o унификации (подобно тому, как это реализовано в Прологе);
o поиска решения с разбиением на последовательность подзадач;
o поиска решения с использованием стратегии разбиения пространства поиска с учетом уровней абстрагирования решения или понятий, с ними связанных;
o монотонного или немонотонного рассуждения,
o рассуждений с использованием механизма аргументации;
o ассоциативного поиска с использованием нейронных сетей;
o вывода с использованием механизма лингвистической переменной.
· Подсистема общения служит для ведения диалога с пользователем, в ходе которого ЭС запрашивает у пользователя необходимые факты для процесса рассуждения, а также, дающая возможность пользователю в какой-то степени контролировать и корректировать ход рассуждений экспертной системы.
· Подсистема объяснений необходима для того, чтобы дать возможность пользователю контролировать ход рассуждений и, может быть, учиться у экспертной системы. Если нет этой подсистемы, экспертная система выглядит для пользователя как "вещь в себе", решениям которой можно либо верить, либо нет. Нормальный пользователь выбирает последнее, и такая ЭС не имеет перспектив для использования.
· Подсистема приобретения знаний служит для корректировки и пополнения базы знаний. В простейшем случае это - интеллектуальный редактор базы знаний, в более сложных экспертных системах - средства для извлечения знаний из баз данных, неструктурированного текста, графической информации и т.д.
2 СОДЕРЖАНИЕ РАБОТЫ
2.1 Начальные сведения
Апоптоз как явление впервые был описан морфологами. Основываясь на микроскопической картине гибнущей клетки, они установили, что клетки погибают, по крайней мере, двумя путями: некроз и апоптоз. При некрозе клетки набухают, их митохондрии и другие органеллы расширяются (вследствие нарушения работы ионных каналов) и разрываются внутриклеточные и плазматическая мембраны клетки:
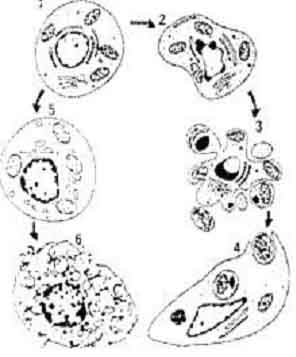
В результате этого активируются лизосомальные ферменты, а внутриклеточное содержимое, попадая во внеклеточную среду, вызывает воспалительные процессы. Классические причины, приводящие к некрозу клетки -гипертермия, ингибирование окислительного фосфорилирования, гликолиза или цикла Кребса, гипоксия, действие комплемента или различных токсинов.
Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин, который в норме представлен открытыми и конденсированными областями (гетеро- и эухроматин), становится суперконденсированным в форме полумесяца по периферии ядра. В этот момент начинается фрагментация ДНК. На ранних стадиях апоптоза, в отличии от некроза, клетка наоборот, сморщивается, теряя до 1/3 своего объема за несколько минут. Механизм этого явления до сих пор не изучен, но, несомненно, в этот процесс должны вовлекаться транспорт ионов и воды. Важной особенностью этого процесса является то, что не происходит повреждения мембран клетки. Усыхание хорошо выражено как в культуре клеток, так и в тканевых срезах, где апоптотическая клетка отделяется от соседних клеток. Далее апоптотическая клетка превращается в совокупность окруженных мембраной апоптозных телец различных по своему составу, которые фагоцитируются макрофагами или соседними клетками.
2.2. Методы исследования
При наличии указанных симптомов всегда можно поставить точный диагноз.
Но чтобы использовать информацию, представленную в таком виде, необходимо, чтобы обследовать пациента, решить, какие у него симптомы, а потом по этим симптомам определить, чем он болен. Энциклопедия же, похоже, не позволяет сделать это так, как надо. Нам нужна не болезнь со множеством симптомов, а система, представляющая группу симптомов с последующим названием болезни. Именно это мы сейчас и попробуем сделать.
Идеальной будет такая ситуация, при которой мы сможем в той или иной области предоставить машине в приемлемом для нее виде множество определений, которые она сможет использовать примерно так же, как человек-эксперт. Именно это и пытаются делать такие программы, как PUFF, DENDRAL, PROSPECTOR.
С учетом байесовской системы логического вывода примем, что большая часть информации не является абсолютно точной, а носит вероятностный характер. Итак, начнем программирование:
| № | Симптомы |
| 1 | Симптом_1 |
| 2 | Симптом_2 |
| N | Симптом_N |
Полученный формат данных мы будем использовать для хранения симптомов. При слове "симптомы" создается впечатление, что мы связаны исключительно с медициной, хотя речь может идти о чем угодно. Суть в том, что компьютер задает множество вопросов, содержащихся в виде символьных строк <Симптом_1>, <Симптом_2> и т.д.
Теперь оформим болезни:
| № | Болезнь | p | [j, py, pn] |
| 1 | Болезнь_1 | p1 | [j, py, pn]1 |
| 2 | Болезнь_2 | p2 | [j, py, pn]2 |
| N | Болезнь_N | pn | [j, py, pn]n |
В таком виде мы будем хранить информацию о болезнях. Это не обязательно должны быть болезни — могут быть любые результаты, и каждый оператор содержит один возможный исход и всю информацию, относящуюся к нему.
Поле "болезнь" характеризует название возможного исхода, например "Грипп". Следующее поле — p — это априорная вероятность такого исхода P(H), т.е. вероятность исхода в случае отсутствия дополнительной информации. После этого идет ряд повторяющихся полей из трех элементов. Первый элемент — j — это номер соответствующего симптома (свидетельства, переменной, вопроса, если вы хотите назвать его по-другому). Следующие два элемента — P(E : H) и P(E : не H) — соответственно вероятности получения ответа "Да" на этот вопрос, если возможные исход верен и неверен. Например:
| 2010 | Грипп | 0.01 | (1, 0.9, 0.01); (2, 1, 0.01); (3, 0, 0.01) |
Здесь сказано существует априорная вероятность P(H)=0.01, что любой наугад взятый человек болеет гриппом.
Допустим, программа задает вопрос 1 (симптом 1). Тогда мы имеем P(E : H)=0.9 и P(E : не H)=0.01, а это означает, что если у пациента грипп, то он в девяти случаях из десяти ответит "да" на этот вопрос, а если у него нет гриппа, он ответит "да" лишь в одном случае из ста. Очевидно, ответ "да" подтверждает гипотезы о том, что у него грипп. Ответ "нет" позволяет предположить, что человек гриппом не болеет.
Так же и во второй группе симптомов (2, 1, 0.01). В этом случае P(E : H)=0.9, т.е. если у человека грипп, то этот симптом должен присутствовать. Соответствующий симптом может иметь место и при отсутствии гриппа (P(E : не H)=0.01), но это маловероятно.
Вопрос 3 исключает грипп при ответе "да", потому что P(E : H)=0. Это может быть вопрос вроде такого: "наблюдаете ли вы такой симптом на протяжении большей части жизни?" — или что-нибудь вроде этого.
Нужно подумать, а если вы хотите получить хорошие результаты, то и провести исследование, чтобы установить обоснованные значения для этих вероятностей. И если быть честным, то получение такой информации — вероятно, труднейшая задача, в решении которой компьютер также сможет существенно помочь Вам. Если вы напишите программу общего назначения, ее основой будет теорема Байеса, утверждающая:
P(H : E) = P(E : H) * P(H) / (P(E : H) * P(H) +P(E : не H) * P(не H).
Вероятность осуществления некой гипотезы H при наличии определенных подтверждающих свидетельств Е вычисляется на основе априорной вероятности этой гипотезы без подтверждающих свидетельств и вероятности осуществления свидетельств при условиях, что гипотеза верна или неверна.
Поэтому, возвращаясь к нашим болезням, оказывается:
P(H : E) = py * p / (py * p + pn * (1 - p)) .
В данном случае мы начинаем с того, что Р(Н) = р для всех болезней. Программа задает соответствующий вопрос и в зависимости от ответа вычисляет P(H : E). Ответ "да" подтверждает вышеуказанные расчеты, ответ "нет" тоже, но с (1 – py) вместо py и (1 – pn) вместо pn. Сделав так, мы забываем об этом, за исключением того, что априорная вероятность P(H) заменяется на P(H : E). Затем продолжается выполнение программы, но с учетом постоянной коррекции значения P(H) по мере поступления новой информации.
Описывая алгоритм, мы можем разделить программу на несколько частей.
Часть 1.
Ввод данных.
Часть 2.
Просмотр данных на предмет нахождения априорной вероятности P(H). Программа вырабатывает некоторые значения массива правил и размещает их в массиве RULEVALUE. Это делается для того, чтобы определить, какие вопросы (симптомы) являются самыми важными, и выяснить, о чем спрашивать в первую очередь. Если вы вычислите для каждого вопроса RULEVALUE[I] = RULEVALUE[I] + ABS (P(H : E) – P(H : не E)), то получите значения возможных изменений вероятностей всех болезней, к которым они относятся.
Часть 3.
Программа находит самый важный вопрос и задает его. Существует ряд вариантов, что делать с ответом: вы можете просто сказать: "да" или "нет". Можете попробовать сказать "не знаю", — изменений при этом не произойдет. Гораздо сложнее использовать шкалу от –5 до +5, чтобы выразить степень уверенности в ответе.
Часть 4.
Априорные вероятности заменяются новыми значениями при получении новых подтверждающих свидетельств.
Часть 5.
Подсчитываются новые значения правил. Определяются также минимальное и максимальное значения для каждой болезни, основанные на существующих в данный момент априорных вероятностях и предположениях, что оставшиеся свидетельства будут говорить в пользу гипотезы или противоречить ей. Важно выяснить: стоит ли данную гипотезу продолжать рассматривать или нет? Гипотезы, которые не имеют смысла, просто отбрасываются. Те же из них, чьи минимальные значения выше определенного уровня, могут считаться возможными исходами. После этого возвращаемся к части 3.
Заключение
Идентификация морфологических и биохимических маркеров апоптоза должна в перспективе способствовать более глубокому пониманию механизмов патогенеза заболеваний, улучшению дифференциальной диагностики и созданию принципиально новых направлений терапии.
Литература
- Агамова К.А., Франк Г.А. Ошибки в морфологической диагностике онкологических заболеваний // Ошибки в клинической онкологии / Под ред. В.И.Чиссова и А.Х.Трахтенберга – М.:Медицина,1993.– C.113 – 123.
- Айвазян С.А., Енюков И.С., Мешалкин Л.Д. Основы моделирования и первичная обработка данных. – М.: Финансы и статистика, 1983.
- Айвазян С.А., Енюков И.С., Мешалкин Л.Д. Исследование зависимостей. – М.: Финансы и статистика, 1985.
- Программированная клеточная гибель, под ред. Новикова B.C., Санкт-Петербург "Наука", 1996.
- Ярилин А.А. Апоптоз и его место в иммунных процессах // Иммунология 1996, т. 6, с. 10-23.
- Уманский С.Р. Апоптоз: молекулярные и клеточные механизмы // Молекулярная биология, 1996, том. 30. вып. 3, с. 487-502.
- Лушников Е.Ф., Загребин В.М. Апоптоз клеток: морфология, биологическая роль, механизмы развития // Архив патологии, 1987, т.49, с. 84-89.
- Белушкина Н.Н., Хасан Хамад Али, Северин С.Е. Молекулярные основы апоптоза // Вопросы биол. мед. и фарм. химии 1998, №4, с. 15-23.
- Нестерова М.В,, Чо-Чанг Ю.С., Северин Е.С. Роль антисмысловых олигонуклеотидов в регуляции клеточных процессов // Вопросы биол. мед. и фарм. химии 1998, №4, с.3-14.
- Аббасаова С.Г., Липкин В.М., Трапезников Н.Н. Кушлинский Н.Е. Система Fas-FasL в норме и при патологии // Вопросы биол. мед. и фарм. химии 1999, №3, с.3-16.
- Вопросы биол. мед. и фарм. химии 1999, №4 посвящен проблеме генной терапии.
- Arends M.J., Wyllie A.H. Apoptosis. Mechanism and role in patology // Intern.Rev.Exp.Pathol., 1991, v.32, p.223-254.
- Magno G., Joris I. Apoptosis, oncosis, necrosis // Amer. J.Pathol. 1995, v.146, N,1, p.3-15. 1. Abastado J.-P. Apoptosis: function and regulation of cell death // Res.Immunol. 1996, v.l47,p.443-456.
- Pan H., Yin C., Dyke T.V. Apoptosis and cancer mechanisms // Cancer Surveys 1997, v.29, p.305-327
Порываев А.М., 2002 г.