Методами дифференциально-термического анализа (ДТА), термогравимет-рии (ТГ), с использованием ИК-спектроскопии, рентгенофазового анализа и ка-лориметрии изучено взаимодействие Cd(ClO4)2 c NaO2 и Na2O2. Установлено, что взаимодействие между ними протекает через ряд последовательных стадий с образованием Na2O2, NaClO4 и NaClO3 в качестве промежуточных веществ и CdO, NaCl, O2 в качестве конечных продуктов. Предложено математическое описание процесса. Рассчитаны теоретические кривые ДТА и ТГ, соответст-вующие различным условиям эксперимента.
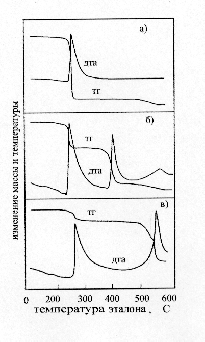
В работе использовался перекристаллизованный перхлорат кадмия, который сушили под вакуумом по методике. Пероксид натрия с содержанием активного кислорода 20% и надпероксид натрия с содержанием активного кислорода 41% использовали без дополнительной подготовки. Композиции Cd(ClO4)2 c Na2O2 или NaO2 готовили в шаровой мельнице, снабженной предохранительной мем-браной. Тепловые эффекты определялись на адиабатическом калориметре "Q-202" путем сжигания таблеток из исследуемых композиций в бомбе калоримет-ра. ИК-спектры записывались на спектрофотометре SPECORD 75IR. Съёмку рентгенограмм проводили на дифрактометре ДРОН-УМ1. Кривые ДТА и ТГ за-писывались при скорости нагрева 15 град/мин с использованием стеклянных и никелевых тиглей и AI2O3 в качестве эталона. Во избежание влияния влаги воз-духа образцы для исследований готовились в изолированном боксе с безводным перхлоратом кадмия в качестве осушителя. Взаимодействие безводного Cd(ClO4)2 с NaO2 в условиях ДТА начинается при температуре 270 °С и сопровождается мощным экзотермическим эффектом с разогревом смеси до нескольких сотен градусов и значительной потерей массы (рисунок 1а).

Площадь, ограниченная кривой ДТА, и, как известно, пропорциональная тепловому эффекту процесса, имеет наибольшее значение при мольном соот-ношении Cd(ClO4)2: NaO2 равном 1:2. Потеря массы при данном соотношении составляет 50%, что хорошо согласуется с уравнением (2):
Cd(ClO4)2 + 2 NaO2 = CdO + 2 NaСl + 5,5О2 (2)Расчетный тепловой эффект данной реакции, равный 339.4 кДж/моль, бли-зок к экспериментально найденному 320±10 кДж/моль. Несколько меньшее значение экспериментального теплового эффекта, по всей видимости, связано с не-полнотой протекания процесса в калориметрических экспериментах. Образова-ние в качестве основных конечных продуктов CdO и NaСl подтверждается рентгенофазовым анализом. Вместе с тем, в поверхностных слоях прореагиро-вавших таблеток ИК-спектроскопически обнаружены полосы, относящиеся к перхлорат-иону. Композиции при мольном содержании NaO2 : Cd(ClO4)2 < 2 разлагаются с выделением в газовую фазу большого количества хлора, что вполне соответствует реакции разложения избыточного Cd(CIO4)2 по уравне-нию (3):
Cd(ClO4)2 = CdO + Cl2 + 4.5 О2 (3)При увеличении содержания в системе NaO2 (рисунок 1б), на кривых ДТА проявляется три экзотермических эффекта при температурах 270, 400 °С и плохо разрешенный в интервале температур 500–550°С. Всем эффектам соот-ветствует потеря массы образца. ИК-спектры продуктов, образующихся после первого экзотермического эффекта, содержат отчетливо выраженные характер-ные полосы перхлорат-иона в области волновых чисел 1100 см–1, что свидетель-ствует об отсутствии термической деструкции перхлорат-иона. Рентгенограммы содержат рефлексы соответствующие NaClO4 и CdO. После второго экзотерми-ческого эффекта в конечных продуктах преобладает NaCl и CdO[7].
Природа третьего экзотермического эффекта не совсем ясна. Однако, по-скольку он наблюдается в системах, содержащих избыточное количество перок-сидных соединений натрия, то, вероятно, обусловлен их взаимодействием с ма-териалом тигля. Первому экзотермическому эффекту предшествует незначительный эндо-термический эффект при температурах 200–270 °С. Так как он сопровождается потерей массы и отсутствует на термограммах смесей Na2O2 с Cd(ClO4)2, то мо-жет быть отнесен к разложению надпероксида натрия в пероксид :
2 NaO2 = Na2O2 + О2На кривых ДТА смесей NaO2 с Cd(CIO4)2 взятых при мольном соотноше-нии 2 : 1, но разбавленных, с целью уменьшения саморазогрева смеси одним из конечных продуктов взаимодействия – CdO, наблюдается два экзотермических эффекта в интервалах температур 260–270°С и 500–600°С и эндотермический – при температуре 200–270°С (рисунок 1в). Как и при избыточном содержании NaO2, после первого экзотермического эффекта основными продуктами взаи-модействия являются перхлорат натрия и оксид кадмия. После второго – NaCl и CdO. Смещение температуры разложения перхлората натрия с 350 °С при из-бытке пероксидных соединений натрия до 600–600 °С при их отсутствии в про-дуктах реакции, объясняется известным фактом [1] каталитического действия кислородных соединений натрия на разложение хлоратов и перхлоратов натрия.
Таким образом, исходя из вышеизложенного, а также учитывая, что пер-хлорат натрия разлагается через стадию образования хлората натрия ,схему взаимодействия Cd(ClO4)2 с NaO2 можно представить уравнениями (4)-(7):
2 NaO2 = Na2O2 + O2 – 9.21 кДж; (4)Систему уравнений (4)–(7) представим следующим образом:
где n1 – n10 - массовые стехиометрические коэффициенты, равные соответственно: 0.709; 0.291; 3.992; 3.141; 1.646; 0.205; 0.869; 0.131; 0.549; 0.451.
Тогда уравнения сохранения вещества для системы (4)–(7) будут иметь вид:
Для NaO2: dm1/dt=–m10*k10*EXP(-E1/RT)*f(a1) (12)
Для Cd(ClO4)2: dm2/dt= –m20*k20*EXP(-E2/RT)*f(a2)*n (13)
Для Na2O2: dm3/dt= –n1*(dm1/dt) + (dm2/dt)/ n3 (14)
Для NaClO4: dm4/dt= –n4/n3*(dm2/dt) – (dm6/dt)/n8 (15)
Для NaCIO3: dm5/dt = n7/n8*(dm6/dt) – (dm7/dt)/ n9 (16)
Для O2, получаемого по реакции (12): dm6/dt = n8*k30*EXP(-E3/RT)*m4 (17)
Для NaCl: dm7/dt = n9*k40*EXP7(-E4/RT)*m5 (18)
Степень превращения и температура в образце могут быть легко определены из данных ДТА и ТГ, а значения производной массы по времени – путем численного дифференцирования ТГ-кривой.
Разложение NaClO4 и NaClO3 в присутствии избытка пероксидных соеди-нений натрия подчиняется кинетическому уравнению первого порядка с пара-метрами: для NaClO4 – Ln k30 = 31.37; E3 = 45 ± 1.3 ккал/моль; для NaClO3 – Ln k40= 29.753; E4 = 44.7 ± 2.1 ккал/моль [ 3 ]. В случае стехиометрических соотношений перхлората магния и пероксидных соединений натрия, разложение образующегося по реакции (5) NaClO4 и, в дальнейшем, NaCIO3 происходит в присутствии оксида кадмия. Так как второй экзотермический эффект (рисунок 1в) наблюдается при температурах меньших, чем для индивидуального NaClO4 то это свидетельствует о влиянии оксида кадмия на процесс разложения перхлората натрия. Одними из наилучших кинетических параметров, позволяющих вполне удовлетворительно описать как процесс разложения NaClO4, так и NaClO3 в присутствии CdO, являются значения k0 и E, равные для NaClO4 – Ln k30 = 28.6+0.4; E3 = 49.8 ± 2.4 ккал/моль; для NaCIO3 – Lnk40= 30.9+0.4; E4 = 53.2 ± 2.7 ккал/моль. Приведенные величины близки соответствующим значениям для разложения NaClO4 и NaClO3 в присутствии NaOH [5]: Результат решения системы уравнений для разложения NaClO4 и для Na-ClO3 при данных значениях показал (рисунок 2) , что расчетные термографические кривые практически совпадают с экспериментальными.
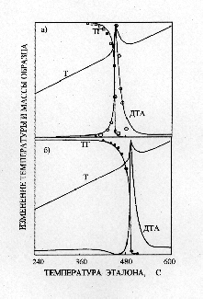
а) мольное соотношение NaClO3 : CdO равно 1:1;
б) мольное соотношение NaClO4 : CdO равно 1:1;
Сплошные линии – расчетные кривые. Точки взяты из эксперименталь-ных кривых ТГ и ДТА.
Решение системы уравнений (12)–(18) для условий, соответствующих различным условиям эксперимента, приведено на рисунке 3.
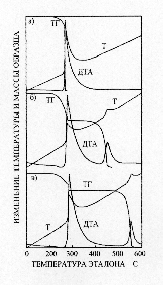
a) мольное соотношение NaO2 : Cd(ClO4)2 = 2 : 1;
б) мольное соотношение NaO2 : Cd(ClO4)2 = 5.5 : 1;
в) мольное соотношение NaO2 : Cd(ClO4)2 = 2 : 1 в присутствии 50% CdO.
При расчете систем с мольным соотношением исходных компонентов равным 2 : 1 (рисунок 3 а, в) использовались значения E и k0 для процесса разложения NaClO4 и NaClO3 в присутствии оксида кадмия. Для кривых на рисунке 3б использовались значения E и k0 процесса разложения хлората и перхлората натрия при избытке пероксидных соединений натрия. Учитывая, что расчет мог быть выполнен только при ряде допущений, можно говорить о вполне удовлетворительном соответствии расчетных термографических кривых с экспериментальными, приведенными на рисунке 1.