Методами гравиметрии и оптической микроскопии проведено изучение окисления образцов медных проволочек на воздухе. Рассмотрены особенности кинетики и строение реакционной зоны в процессе окисления при различных температурах в интервале 600–900°С.
Несмотря на то, что исследования высокотемпературного окисления меди имеет внушительную историю, а свойства меди и ее оксидов изучены достаточно подробно [1], остается еще много невыясненных вопросов относительно кинетики, механизма окисления и взаимодействия между фазами, образующимися в процессе окисления.
Изучали образцы электротехнической меди в виде проволочек диаметром 1, 2 мм.
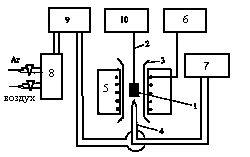
Процесс окисления в среде воздуха изучали на установке, показанной на рис. 1. Образцы (1) в виде отрезков проволоки длиной 2 – 3 см и массой 0,5 – 1,0 г подвешивали на платиновой нити (2) внутри вертикального кварцевого реактора (3) со шлифами на концах. Шлиф в нижней части предназначен для Pt–PtRh термопары (4) и подвода газовых смесей. Шлиф в верхней части предназначен для уменьшения выходного сечения реактора. Обогрев реактора осуществляли печью с нихромовыми нагревателями (5). Температуру поддерживали с помощью тиристорного регулятора ВРТ–3 (6) и регистрировали цифровым вольтметром В7–34А (7). Непрерывное измерение массы образца производили с помощью лабораторных электронных весов ВЛЭ–200 (10) и регистрировали на потенциометре КСП–4.
Погрешность приборов, используемых в гравиметрической установке:
Для визуального наблюдения реакционной зоны образцы проволоки после обжига заливались эпоксидной смолой, после чего шлифовкой и полировкой алмазной пастой изготавливались шлифы. Полученные шлифы изучали с помощью оптического «Биолам С-11» и металлографического МИМ-7 микроскопов.
Визуальные наблюдения шлифов образцов медной проволоки показали, что первоначально на поверхности меди образуется слой оксида меди (II), по внешнему виду напоминающий сажу. Это указывает на либо аморфное, либо мелкокристаллическое строение оксида. Через некоторое время, например, 1 ч при 700°С, на поверхности оксида формируется более светлый и, видимо, более плотный серый слой с повышенной светоотражающей способностью. Последние свойства характерны для фаз с более выраженной кристалличностью. С появлением этого слоя на поверхности меди образуется поликристаллический слой фазы красного цвета, которую можно отнести к оксиду меди (І). Толщина этого слоя определяется размером примерно одного кристаллита и при дальнейшем нагревании практически не увеличивается. Но зато в поверхностном слое кристаллической СuО появляются сначала небольшие группы кристаллитов красной фазы, количество которых по мере нагревания увеличивается.
Серая фаза с увеличением времени окисления движется вглубь образца к поверхности меди. Вместе с ней распространятся и красная фаза. После полного окисления меди образец имеет следующее строение: снаружи тонкий слой только СuО, а далее по всему объему СuО рассредоточены группы кристалликов красной фазы, которую мы относим к Сu2О. Такое строение окисленного образца сохранилось до конца эксперимента, включая нагрев при 900°С. Это свидетельствует о крайне низкой скорости диффузии кислорода через поверхностный слой оксида меди(II).
Кинетические результаты гравиметрических измерений представлены на рис.2 в виде зависимостей количества вещества присоединенного кислорода (ммоль) от времени нагрева (рис.2а), от корня квадратного из времени (рис.2б) и от натурального логарифма времени (рис.2в). Приведенные данные показывают, что только при 600°С скорость окисления описывается параболической зависимостью и лимитируется вероятнее всего скоростью диффузии кислорода к поверхности металла.
С повышением температуры эта зависимость становится более сложной. Прежде всего, необходимо отметить влияние на скорость окисления растрескивания оксидной пленки, что связано, вероятно, с появлением в плотном поверхностном слое оксида меди (II) кристаллитов оксида меди(I), которые имеют значительно больший молярный объем (23,42 см3/моль), чем молярный объем СuО (12,43 см3/моль).
Кроме того, с повышением температуры и ограничением доступа кислорода во внутренние слои оксидной пленки можно ожидать изменения вклада различных реакций в суммарный процесс окисления. Как показывают расчеты, приведенные в таблице, с повышением температуры изменения энергии Гиббса всех реакций с участием кислорода увеличивается, а для реакции восстановления СuО атомами меди — уменьшается.
| № п/п | Реакция | Температура, К | ||||
|---|---|---|---|---|---|---|
| 298 | 873 | 973 | 1073 | 1173 | ||
| 1 | 2Cu+1/2O2→Cu20 | -144,95 | -105,33 | -99,37 | -93,75 | -88,47 |
| 2 | Cu+1/2O2→CuO | -137,53 | -88,03 | -80,54 | -73,45 | -66,80 |
| 3 | Cu+CuO→Cu2O | -7,42 | -17,30 | -18,83 | -20,29 | -21,67 |
| 4 | 1/2Cu2O+1/4O2→CuO | -65,06 | -36,37 | -30,37 | -26,58 | -22,56 |
Поэтому даже при длительном нагреве при температурах 900°С и выше в образце сохраняется значительное количество оксида Сu2О, тем более что его окисление кислородом характеризуется довольно высокой величиной ΔG.
Расчеты изменения энергии Гиббса проводились по формуле
ΔGT=ΔHT-T•ΔSTИзменения энтальпии и энтропии рассчитывались с учетом изменения теплоемкости:
ΔHT=ΔH298+ΔCp•(T-298); ΔST=ΔS298+ΔCp•(T/298);Изменение теплоемкости находили как разность теплоемкостей продуктов и исходных веществ при заданной температуре. Для расчета теплоемкостей веществ использовали формулу [2]:
Cp=a+b•103-c′•105/T2.Несмотря на приближенный характер, эти расчеты позволяют объяснить некоторые закономерности процесса окисления меди.
Устойчивость фазы Сu2О в изученном интервале температур подтверждается фазовой диаграммой [3] системы Сu — О (рис.3).
Несмотря на приближенный характер, эти расчеты позволяют объяснить некоторые закономерности процесса окисления меди. Устойчивость фазы Сu2О в изученном интервале температур подтверждается фазовой диаграммой [3] системы Сu — О (рис.3).
1. Физико-химические свойства окислов: Справочник: / Под ред. Самсонова Г.В. — М.: Металлургия, 1969. —С. 455.
2. Краткий справочник физико-химических величин / Под ред. К.П. Мищенко, А.А. Равделя. — М. — П.: Химия, 1965.—С. 159.
3. Диаграммы состояния двойных металлических систем: Справочник: Т. 2 / Под общ. ред. Лякишева Н.П. — М.: Машиностроение, 1997.—С. 1024.