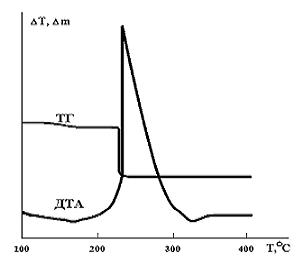
Рис.1 – Термограмма смеси Cu2Cl2 : 2NaO2
Ю.В.Мнускина, В.В.Шаповалов, М.М.Шибико
Источник: Сборник статей ДонНТУ, 2005 г., ст.37-42
Самораспостраняющееся взаимодействие в пероксидно-солевых системах изучалось в работах [1 – 4]. Интересной особенностью некоторых из них является возможность получения соединений со степенями окисления, отличными от степеней окисления исходных соединений, что особенно интересно с точки зрения получения соединений с необычными степенями окисления меди [2 – 4]. С этой же целью предпринято изучение СРВ в системе супероксид натрия – хлорид меди(І).
В работе использовался супероксид натрия с количеством активного кислорода 41.5% при содержании NaO2 – 93.6%, Na2O2 – 4.7% и сумме NaOH c Na2CO3 1.7% . Хлорид меди(І) Cu2Cl2 получен в соответствии с методикой [5]. Скорость СРВ определялась, исходя из размеров образца и времени распространения фронта реакции после инициирования процесса СРВ высокотемпературным источником.
На кривых ДТА смеси NaO2 с Сu2Cl2 в интервале температур 120 – 200°С фиксируется незначительный эндотермический эффект и соответствующая ему потеря массы, что соответствует происходящим в системе превращениям супероксида натрия в соответствии со схемой [6]:
| 2NaO2 = Na2O3.6 + 0.2O2 | (120 – 190°С) | (1) |
| Na2O3.6 = Na2O2 + 0.8O2 | (220 – 270°С) | (2) |
Непосредственное взаимодействие между хлоридом меди(І) и супероксидом натрия начинается при температуре 228°С, что соответствует стадии (2) [рис.1].

Рис.1 – Термограмма смеси Cu2Cl2 : 2NaO2
Реакция сопровождается значительным тепловым эффектом и небольшой потерей массы. Визуально взаимодействие идет в две стадии: вначале происходит обменной взаимодействие с образованием Cu2O (красное окрашивание образца), последнее быстро окисляется кислородом до CuO (черное окрашивание).
Приведенная на рис.2 зависимость потери массы от соотношения NaO2:Сu2Cl2 имеет нехарактерный для ранее изученных систем характер. Помимо экспериментальной, на рисунке приведены три расчетные зависимости.
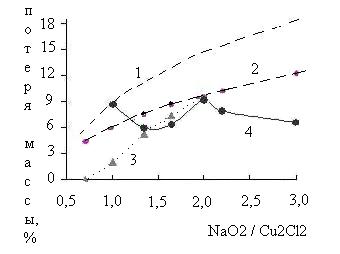
Рис.2 – Зависимость потери массы от соотношения NaO2 : Cu2Cl2
1 – расчет в соответствии с (3),
2 – расчет в соответствии с (4),
3 – расчет в соответствии с (4) и (8),
4 – эксперимент.
Зависимости 1 и 2 предполагает, что количество выделяющегося кислорода прямо пропорционально содержанию NaO2 в исходной смеси. Зависимость 1 рассчитана, исходя из предположения, что конечными продуктами взаимодействия являются Cu2O и NaCl. Это соответствует суммарному уравнению (3):
| 2NaO2 + Cu2Cl2 = 2NaCl + Cu2O + 1.5O2 | (220°С) | (3) |
| 2NaO2 + Cu2Cl2 = 2NaCl + 2CuO + O2 | (220°С) | (4) |
Как следует из рис.2, при стехиометрическом соотношении компонентов в исходной смеси экспериментально найденная потеря массы меньше, чем рассчитанная по уравнению (3) и соответствует рассчитанной в соответствии с уравнением (4). Таким образом, схему взаимодействия Cu2Cl2 с NaO2 можно представить в виде:
| 2NaO2 = Na2O3.6 + 0.2O2 | (5) |
| Cu2Cl2 + Na2O3.6 = Cu2O + 2NaCl + 1.3O2 | (6) |
| Cu2O + 0.5O2 = 2CuO | (7) |
| 2NaO2 + 3Cu2Cl2 = 4CuO + 2CuCl2 + 2NaCl | (8) |
| 2Cu2Cl2 + O2 = 2CuO + 2CuCl2 | (9) |
| 2CuCl2 + O2 = 2CuO + 2Cl2 | (10) |
| NaO2 = v1 Na2O1 + v2 O2 | (11) |
| v3 Cu2Cl2 + Na2O2 = v4 CuO + v5 NaCl | (12) |
где v1 – v5 – массовые стехиометрические коэффициенты,
систему дифференциальных уравнений, описывающую скорость передвижения фронта, можно представить в виде:
| Для NaО2: | dm1/dt = -m01 * k1 * exp(-E1/RT) * f1(a), |
| Для Cu2Cl2: | dm2/dt = -m02 * k2 * exp(-E2/RT) * f2(а), |
| Для Na2O2: | dm3/dt = -v1 * (dm1/dt) + (dm2/dt) / v3, |
| Для O2: | dm4/dt = -v2 * (dm1/dt), |
| Для NaCl: | dm5/dt = -v4 / v3 * (dm2/dt), |
| Для CuО: | dm6/dt = -v5 / v3 * (dm2/dt), |
где m1 – m5 – текущие массовые доли NaO2; Cu2Cl2; Na2O2; O2; NaCl; CuO; ki, Ei – предэкспоненциальный множитель и энергия активации реакции; t – время; f(a) – кинетическая функция; a – степень превращения компонента; m0i – исходная массовая доля компонента.
Результаты расчета системы, выполненного в соответствии с методикой [8], приведены в таблице 1.
Таблица 1 – Зависимость расчетной скорости распространения фронта горения в системе NaО2 – Cu2Cl2 от кинетических параметров
| Энергия активации, E2/R, кДж/моль | Предэкспоненциальный множитель, К2, 1/с | Температура взаимодействия, Т, оС | Скорость СРВ, U, мм/мин |
| 7000 | 119000 | 228.09 | 184 |
| 7400 | 265000 | 228.04 | 238 |
| 7500 | 324000 | 228.02 | 254 |
| 8000 | 890000 | 228.01 | 354 |
| 9000 | 6800000 | 228.03 | 696 |
| 10000 | 51500000 | 228.07 | 1364 |
| Эксперимент | 228 | 252 | |
Таким образом, исследовано взаимодействие в системе хлорид меди(І) – супероксид натрия, исследована зависимость потери массы и величины теплового эффекта от исходных веществ. Определена скорость перемещения фронта горения в исследуемой системе на порошкообразных композициях.
Список литературы
1. Шаповалов В.В., Гороховский А.Н. Закономерности самораспространяющегося взаимодействия сульфатов металлов с пероксидными соединениями натрия // Укр. хим. журнал. – 2001. – Т. 67.– №2. – С. 85-88.
2. Гороховский А.Н. Экзотермические превращения в системах MnSO4 –Na2O2 (NaO2)// Укр. хим. журнал. – 2003. – Т. 69, №2. – С.80-84.
3. Шаповалов В.В., Гороховский А.Н., Бажутина Ю.В. Кинетика и механизм самораспространяющегося взаимодействия CuSO4 c NaO2 и Na2O2 // Сб. трудов ДонГТУ, серия Химия и химическая технология.– 2000.– вып.12.– С.63-70.
4. Гороховский А.Н., Шаповалов В.В. Взаимодействие пероксида и надпероксида натрия с сульфатом меди // Укр. хим. журнал.– 2000.– Т.66, №3.– С.12-16.
5. Карякин Ю.В., Ангелов И.И. Чистые химические вещества. – 4-е изд., перераб. и доп.– М.:Химия,1974.– 408 с.
6. Шаповалов В.В., Ванин В.И., Мнускина Ю.В. Кинетика термического разложения супероксида натрия // Вопросы химии и хим. технологии. – 2002. – № 2. – С. 23-26.
7. Справочник по плавкости систем из безводных неорганичексих солей. 3 т. / Изд-во АН СССР. – М.-Л.:,1961. – т.1:Двойные системы. – 467 с.
8. Шаповалов В.В. Определение кинетических параметров интенсивных экзотермических твердофазных реакций // Укр. хим. журнал. – 2000. – Т. 66, № 7. – С.31-36.