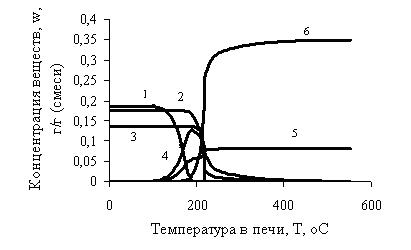
Рис.3 – Распределение концентраций во фронте горения:
1 – концентрация NaO2; 2 – концентрация CdSO4;
3 – концентрация CuSO4; 4 – концентрация Na2O2;
5 – концентрация O2; 6 – концентрация Na2SO4.
М.М.Шибико, В.В.Шаповалов, Ю.В.Мнускина
Источник: Охорона навколишнього середовища та раціональне використання природних ресурсів / Збірка доповідей V Міжнародної наукової конференції аспірантів та студентів. Т.2 - Донецьк: ДонНТУ, ДонНУ, 2006, с.110 - 111
В настоящее время обнаружено, что соли различных металлов способны взаимодействовать с пероксидными соединениями натрия в режиме самораспространяющегося взаимодействия (СРВ). Установлено, что СРВ в системах соль – пероксидное соединение натрия имеет большое практическое значение, связанное с развитием новых нетрадиционных методов синтеза неорганических соединений и простых веществ, а также с возможностью переработки токсичных отходов производства. С этой целью до сих пор изучались только двойные системы. Однако, актуальной задачей на сегодняшний день является изучение СРВ и в тройных системах, состоящих из двух солей и пероксида (супероксида) натрия. Такие системы целесообразно было бы использовать в следующих целях: во-первых, для получения пьезокерамических материалов (если в процессе СРВ образуются оксиды, проявляющие пьезоэлектрические свойства) и ферритов (если один из образующихся оксидов Fe2O3, а второй отвечает формуле МеО). В этом случае получение оксидов самораспространяющимся взаимодействием позволило бы добиться наиболее полного и равномерного их смешения на молекулярном уровне, что является важным для производства пьезокерамики и чего практически невозможно достичь при традиционных способах ее получения. Кроме того, получение пьезокерамических материалов с помощью СРВ является экологически чистым, быстрым и дешевым способом. Во-вторых, СРВ в тройных системах также можно использовать для переработки токсичных отходов путем перевода растворимых солей в нерастворимые оксиды, которые не оказывают вредного воздействия на окружающую среду.
Данная работа посвящена изучению системы CdSO4 – CuSO4 – NaO2. Поскольку СРВ в тройных системах ранее никогда не изучалось, то эта система была выбрана как наиболее простая модель для его изучения, так как в этой системе не предполагается взаимодействие продуктов реакций с исходными реагентами и между собой. Целью работы явилось установление механизма процесса, протекающего в системе при нагревании, а также определение теплофизических и кинетических его параметров.
При нагревании исследуемой системы в ней протекают следующие реакции:
| Для NaО2: | dm1/dt = -m01 * k1 * exp(-E1/RT) * f1(a), |
| Для СuSO4: | dm2/dt = -m02 * k2 * exp(-E2/RT) * m4 * f2(a), |
| Для CdSO4: | dm3/dt = -m03 * k3 * exp(-E3/RT) * m4 * f3(a), |
| Для Na2O2: | dm4/dt = -v1 * (dm1/dt) + (dm2/dt) / v3 + (dm3/dt) / v7, |
| Для O2: | dm5/dt = -v2 * (dm1/dt) - v6/v3 * (dm2/dt) - v10/v7 * (dm3/dt), |
| Для Na2SO4: | dm6/dt = -v4/v3 * (dm2/dt) - v8/v7 * (dm3/dt), |
| Для CuО: | dm7/dt = -v5/v3 *(dm2/dt), |
| Для CdО: | dm8/dt = -v9/v7 * (dm3/dt), |
где m1 – m8 – текущие массовые доли NaО2, CuSO4, CdSO4, Na2O2, O2, Na2SO4, CuО, CdО;
m01, m01 и m03 - исходные массовые доли NaО2, CuSO4 и CdSO4 соответственно;
k1, k2 и k3 – предэкспоненциальные множители соответствующих реакций;
Е1, Е2 и Е3 – енергии активации соответствующих реакций;
f(a) – кинетическая фунция.
В процессе исследования системы был проведен ее теоретический расчет с помощью ЭВМ. В результате расчета определены теплофизические характеристики процесса (температура взаимодействия, составляющая 230°С, и величина пика экзотермического эффекта – 127.01°С). Результаты расчета позволяют также получить картину распределения концентраций реагирующих веществ и продуктов во фронте горения (рис.1).

Рис.3 – Распределение концентраций во фронте горения:
1 – концентрация NaO2;
2 – концентрация CdSO4;
3 – концентрация CuSO4;
4 – концентрация Na2O2;
5 – концентрация O2;
6 – концентрация Na2SO4.
Кроме теоретических расчетов, проведено экспериментальное определение скорости горения в системе. Исходными реагентами для приготовления реакционной смеси служили безводные CuSO4 и CdSO4 и супероксид натрия. NaO2 использовали без предварительной подготовки. Сульфаты предварительно были высушены под вакуумом. При приготовлении реакционной смеси исходные компоненты были взяты в стехиометрическом соотношении. Из смеси была спрессована таблетка и сожжена. Средняя экспериментальная скорость ее горения составила 83.54 мм/мин.
В процессе исследования системы также было проведено определение йодометрическим методом количества непрореагировавшего сульфата меди при недостатке супероксида натрия. Среднее количество CuSO4 в продуктах составило 6.8 % от массы всей смеси продуктов.
Из выше сказанного можно сделать следующие выводы:
1. По расчетным данным величина пика экзотермического эффекта составляет 127.01°С. Значит, процесс, протекающий в системе при нагревании сопровождается довольно большим выделением тепла, что подтверждает возможность СРВ в ней. Температура наиболее интенсивного взаимодействия 230°С.
2. По экспериментальным данным, скорость распространения фронта горения в системе относительно небольшая (83.54 мм/мин), что характерно для большинства систем с солями.
3. Экспериментально обнаружено, что CuSO4 не полностью расходуется в процессе СРВ при недостатке супероксида натрия. Около 7 % его обнаружено в продуктах взаимодействия.
Так как работа по изучению системы CdSO4 – CuSO4 – NaO2 только начата, определенные выводы о механизме процесса в этой системе сделать пока невозможно.