Влияние различных факторов на кислородный баланс
организма пациента во время операции.
К.Ю.
ЗюСоЧун
Дорожная
клиническая больница на ст. Хабаровск-I, глав. врач Б.А.Меркешкин
В
отличие от дефицита питательных веществ или воды без кислорода организм человека
погибает очень быстро, в течение нескольких минут. Справедливости ради следует
отметить тот факт, что согласно расчетам Gothen и Siggaard-Andersen [4] без
буферных систем организм человека не смог бы существовать более 3 секунд и
погибал бы в дальнейшем от избытка водородных ионов. Но весьма трудно
представить даже теоретически, что организм может мгновенно лишиться всех 4-х
своих буферных систем.
Поэтому
представляется интересным рассмотреть влияние различных факторов на кислородный
баланс организма во время операции.
Хотелось бы
напомнить, что кислородный баланс организма в чистом виде представляет
соотношение между доставкой О2 (DO2) и потребностью
организма в О2 (VO2).
Содержание О2
в крови выражается формулой
СаО2=(1,34*Нв*SaO2)+(0,0031*раО2)
(1)
- СаО2-содержание О2 в крови,
- Нв - гемоглобин крови,
- SaO2-сатурация оксигемоглобина в
артериальной крови,
- раО2 - парциальное напряжение О2
в артериальной крови,
- 1,34 – постоянная Гюфнера,
- 0,0031 – коэффициент Бунзена.
В норме СаО2=(1,3*14*98)+(0,003*100)=18,1
мл/100 мл (или объемных процентов – об%)
Доставка О2
(DO2) выражается формулой:
DO2=СВ*(1,3*Нв*SaO2)*10
(2)
где СВ-сердечный
выброс.
нормальное значение
DO2=3*(1,3*14*0,98)*10=540 мл/(мин*м2)
Потребление О2(VO2)
описывается уравнением Фика:
VO2=СВ*(СаО2-СvО2)=СВ*(13*Нв)*(SaO2-SvO2)
(3)
Здесь СvO2-содержание
O2 в венозной крови,
SvO2-
содержание оксигемоглобина в венозной крови.
Нормальное значение
V O2=3*(13*14)*(0,97-0,73)=130 мл/(мин*м2)
Утилизация O2 (КУ – коэффициент утилизации O2) выражается следующей формулой:
КУО2=VO2/DO2*100
В норме КУO2=130/540*100=24%
Здесь видно, что в норме доставка O2 (540 мл/(мин*м2)) значительно превышает потребление O2 (130 мл/(мин*м2)).
Распределение газов в легких
Основным путем поступления О2 в организм являются легкие. Роль кожи и слизистых оболочек незначительна. В альвеолярном газе концентрация газов следующая: О2 - 14%, СО2 – 5,6%, азот - 80,4%. С учетом напряжения водяных паров (при температуре 370С – 47 мм рт.ст.) согласно закону Генри парциальное напряжение
- для О2 = (760мм рт.ст. - 47мм рт.ст.)*0,14= 100 мм рт.ст.,
- для СО2 = (760мм рт.ст. - 47мм рт.ст.)*0,056= 40 мм рт.ст,
- для N2 = (760мм рт.ст. - 47мм рт.ст.)*0,8= 573 мм рт.ст.
Переход газов из альвеолярного газа в плазму крови, протекающей через легочные капилляры, происходит согласно физическому закону диффузии газов.
Тканевое дыхание.
По достижении капиллярного уровня в крови начинается процесс деоксигенации (десатурации НвО2). Переход О2 из крови в ткани, также как и в альвеолах, обусловлен различным парциальном давлением этого газа по обе стороны сосудистой стенки и подчиняется, таким образом, законам диффузии. Величина диффузии О2 из кровеносного русла зависит от напряжения О2 в артериальной крови и потребления О2. Отношение между ними создает градиент концентрации рО2 между кровью и тканью. Истинное прямое определение кислородных параметров в тканях в настоящее время невозможно [2]. Поэтому процессы тканевого газообмена изучают с помощью методов математического моделирования. За конечную анатомо-функциональную единицу газообмена большинством авторов принимается тканевой цилиндр Крога (A.Krogh). Модель такого цилиндра, рекомендованного первоначально для мышечной ткани, впоследствии была принята и для других тканей.
Рис.1. Тканевой цилиндр Крога. (Из кн. В.И.Бураковский, Л.А.Бокерия "Гипербарическая оксигенация в сердечно-сосудистой хирургии", М., "Медицина" 1974 г.)
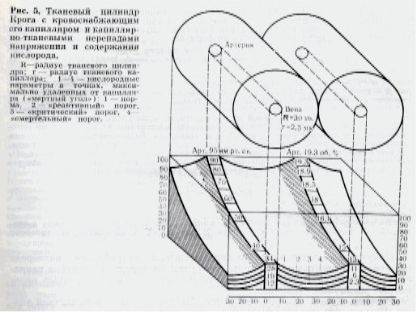
В схеме Крога гипотетическая ткань рассматривается как совокупность цилиндров, находящихся на одном и том же уровне. Произвольным также является допущение о параллельном расположении капилляров, концы которых лежат в одинаковых плоскостях этой ткани. Согласно модели Крога из крови, протекающей по капилляру, О2 непрерывно диффундирует в поперечном направлении в цилиндр, в ткань. Это приводит к снижению рО2 в продольном направлении в сторону венозного участка этого сосуда. Если допустить, что дыхание во всем объеме цилиндра совершается равномерно, а диффузия газа идет только в одном направлении, перпендикулярном оси цилиндра, то напряжение О2 в какой-то точке определяется капиллярно-тканевым градиентом (рО2), вычисляемым по формуле:
Р=Рк -Ртк=А/Д*((1/2*R2*logx/r – (x-r)/4)
- Рк - рО2 в капилляре
- Ртк - рО2 в ткани
- А – потребление О2
- Д - коэффициент диффузии
- R- радиус цилиндра
- r - радиус капилляра
- x - расстояние до искомой точки в ткани.
Показателем адекватности оксигенации тканей является напряжение О2 на линии, максимально удаленной от капилляра, т.е. на границе двух цилиндров. В пределах этой границы напряжение О2 постепенно уменьшается от артериального к венозному участку капилляра. Наименее благоприятным в отношении оксигенации участком гипотетического цилиндра является точка, разделяющая эти цилиндры в том месте, где кровь имеет венозные показатели рО2 ("мертвый угол" по Opitz и Schneider, 1950). Если точка "x" находится в "мертвом углу", то градиент рО2 может быть определен по упрощенной формуле Крога:
D Р » А*R2*К1/Д (4)
где К1 – некоторая постоянная.
Диффундируя из крови, О2 освобождается от Нв, продвигаясь и проникая через внутриклеточную жидкость и оболочку эритроцита, плазму, эндотелий, околососудистое пространство, поступает в клетки в молекулярном состоянии. Отличительными особенностями кислорода как химического элемента является постоянно возбужденное состояние этой молекулы и ее парамагнетизм. Такое состояние, направленное на присоединение электрона, обусловливает его значение как универсального окислителя. Магнитные поля молекулы О2 (100 А0) , превышающие радиус самой молекулы (4 А0) в 25 раз, перекрывают друг друга и обеспечивают высокую скорость окислительных реакций. Молекулярный кислород, принимающий участие в биохимических процессах, по современным представлениям локализован в гребнях митохондрий. Там же располагаются и цитохромы, обеспечивающие 90% всего объема клеточного дыхания. Важной особенностью реакции между цитохромами и кислородом является то, что скорость их мало зависит от рО2. Незначительное снижение потребления О2 митохондриями начинается при О2, равном 8 мм рт.ст. Однако даже при р О2 1 мм рт.ст. митохондрии сохраняют 50% от исходного уровня дыхания. Другой группой ферментов, реагирующих с О2, являются флавопротеиды. В отличие от цитохромов аутоокисляемость этой группы ферментов в значительной степени зависит от напряжения О2. В естественных условиях флавопротеиды обеспечивают 5-7% дыхания. Но при некоторых патологических состояниях оно достигает 25-50%.
Изменение условий
тканевой оксигенации при изменении различных показателей в формуле Крога.
Изменением различных показателей в формуле Крога можно получить условия, соответствующие определенным клиническим состояниям.
Если в упрощенной формуле Крога
D Р = А*R2*К1/Д (4)
использовать данные Thews [8] и коэффициент диффузии (Д) заменить на коэффициентом проницаемости (К), то К1 окажется равной 0,97. Для удобства расчетов К1 может быть приравнен к 1. Тогда формула будет иметь следующий вид:
D Р = А*R2/К (5)
или
- Ртк = Рк - А* R2/К (6)
- где Ртк – напряжение О2 в ткани
- Рк - напряжение О2 в венозной крови
- D Р – капиллярно-тканевой градиент
- А – потребление О2 в мл на 100 г ткани
- R2 – коэффициент проницаемости, равный 2,3*10-5 мм О2/мл*мин*атм
Из формулы (5) следует, что при постоянном А* R2/К рО2 в тканях прямо пропорционально р О2 в капиллярной крови.
Если в формуле одновременно изменяется потребление О2, выраженное в формуле Крога через «А», то происходит дальнейшее повышение или понижение тканевого рО2. Изменяя значение капиллярно-тканевого градиента (D Р), можно рассчитать рО2 в различных органах. И, наконец, при изменении величины радиуса тканевого цилиндра (R) можно определить протяженность пути диффузии О2 в этой ткани до точки оптимальной, реактивной и критической оксигенации.
Снижение рO2 в «мертвом углу», обусловленное постоянным уменьшением перфузионного объема кислорода, которое возможно не только при падении артериального рO2 , но и при уменьшении содержания гемоглобина или возрастании VO2 , характерно для состояния гипоксии тканей.
Thews [8] выделил четыре уровня тканевой оксигенации мозга в зависимости от рO2 в «мертвом углу» гипотетического цилиндра. Эти уровни вынесены в нижнюю часть модели Крога и обозначены цифрами I, II, III, IV (см. рис. 1). Они соответствуют следующим величинам венозного рO2:
- 34 мм рт.ст. - норма,
- 28 мм рт.ст. - реактивный порог
- 19 мм рт.ст. - критический порог
- 12 мм рт.ст. - смертельный порог.
Кривая изменения тканевого рO2 на расстоянии R имеет сложный вид и является графическим решением уравнения диффузии
O2 в биологических тканях [3]. Как видно из рис.1, на середине расстояния между капиллярами в конечной части тканевого цилиндра происходит максимальное снижение рO2. Это и есть "мертвый угол" по Opitz и Schneider - место с наименее благоприятными условиями оксигенации. В соответствии с расчетами Thews при реактивном пороге рO2 в точке, максимально удаленной от капилляра (в «мертвом углу»), составит 12 мм рт.ст., при критическом уровне - 4 мм рт.ст., и, наконец, при смертельном - около 0 мм рт.ст.
Расчетным порогам кислородной недостаточности соответствуют определенные клинические состояния. Так при реактивном пороге развиваются первые признаки кислородного голодания, проявляющиеся ослаблением умственной деятельности и появлении медленных волн на энцефалограмме, а при критическом пороге человек теряет сознание.
Роль
анестезиолога в обеспечении нормального кислородного баланса организма во время
операции
Адекватная оксигенация организма больного является одной из главнейших задач анестезиолога при проведении анестезии. Анестезиолог должен в первую очередь стараться обеспечивать максимальную доставку O2.
Из формулы (2) видно, что анестезиолог может влиять на доставку O2 следующими путями:
- обеспечение оптимального уровня Sa O2 (98-100%)
- обеспечение оптимальной концентрации Нв (120-145 г/л)
- обеспечение оптимального СВ (2,5-3 л/мин/м2)
Оптимальный уровень Sa O2 (98-100%) формируется подачей в легкие газовой смеси, богатой O2. Оптимальная концентрация Нв достигается трансфузией эритроцитарной массы до и во время операции. Обеспечение оптимального СВ достигается согласно алгоритму, предложенному Дж. Кирклиным, а именно: воздействием на преднагрузку, постнагрузку, число сердечных сокращений и контрактильную способность миокарда.
Из формулы Крога (6) становится ясным, что анестезиолог кроме обеспечения максимальной DO2 может улучшать кислородный баланс организма пациента во время анестезии путем влияния на величину потребления кислорода тканями (VO2), а также на величину R гипотетического цилиндра Крога.
Известен факт, что изменение температуры тела относительно нормальной и величина основного обмена, а соответственно потребление O2 находятся в прямо пропорциональной зависимости. Сепсис, многие инфекционные, эндокринные заболевания серьезно влияют на уровень основного обмена, а значит, на уровень потребления O2. Проводя нормализацию повышенной температуры тела фармакологическими агентами или физическими факторами анестезиолог может реально снизить уровень VO2 и тем самым повысить тканевое рO2.
При неправильной инфузионной терапии во время операции или наличии исходной гипергидратации вследствие различных причин возможно развитие отечности тканей. В этом случае увеличенный радиус R в цилиндре Крога будет снижать уровень тканевого рO2. Нормализуя радиус R путем применения мочегонных средств, увеличения коллоидно-онкотического давления плазмы крови, ультрафильтрации крови, гемодиализа и т.д. врач реально уменьшает степень тканевой гипоксии.
Влияние исходного
состояния пациента на кислородный баланс во время анестезии
Исходное состояние пациента может быть оценено по шкале риска анестезии ASA. Если функциональные резервы сердечно-сосудистой и дыхательной систем достаточные, то риск не превышает 1-2 степень. Другое дело, если функции этих систем не имеют резервов, или исходно скомпроментированы, то есть имеется явная декомпенсация их функций. Это означает, что:
- при исходной дыхательной недостаточности SpO2 ниже нормы или достигается чрезмерно высокой ценой дыхания
- при исходной сердечной или сосудистой недостаточности величина СВ ниже нормы
В обоих случаях будет иметь место увеличение КУO2 выше нормальных 22-24%. То есть организм будет получать необходимый дополнительный O2 из кислородной емкости организма. В этом случае pvO2, SvO2 будут ниже нормальных. Крайнее допустимое значение венозной крови капилляра исходя из математической модели Крога - 19 мм рт.ст. («критический порог»). Критический порог pO2 смешанной венозной крови, доступной для прямого исследования, отражающий истинную гипоксию тканей, всегда выше за счет шунтирования по артерио-венозным анастомозам, и составляет 28-30 мм рт.ст. Дыхательные нарушения влияют в первую очередь на оксигенацию крови в легких, то есть на SaO2 и paO2 в формуле (1). Сердечная недостаточность есть прямой аргумент функции СВ в формуле (1). Особую форму недостаточности кровобращения представляет шок. Шок характеризуется гипоперфузией периферических тканей вследствие спазма или паралича артериол [7]. При шоке вследствие шунтирования крови SaO2 и paO2 в смешанной венозной крови может быть нормальной или выше нормы, однако потребность тканей в О2 не удовлетворяется, нарастает тканевая гипоксия, метаболический ацидоз.
Некоторые авторы вводят понятие «стресс-нормы» во время проведения анестезии. Под этим понимают изменение некоторых функций организма, в частности реакции сердечно-сосудистой системы, на величину 20-25% от нормы во время анестезии и операции, считая это приемлемым [6]. Исходя из формулы (2) видно, что изменения СВ на величину 20-25% могут значительно ухудшить DO2 у пациентов 4-5 степени риска ASA.
Кислородный
баланс пациента и действия хирурга во время операции.
Кровотечение, всегда имеющее место при операциях, при соответствующих величинах уменьшает как СВ за счет гиповолемии, так и О2 емкость крови за счет потери эритроцитов.
Сдавление тканей инструментами, окклюзия, сдавление, перевязка сосудов могут вызвать ишемию ограниченного участка организма.
Механическое препятствие кровотоку влечет ишемию нижележащих отделов организма (пережатие аорты, сонной артерии, почечной артерии, крупных вен).
После включения в кровоток длительно ишемизированной области организма могут наблюдаться нежелательные изменения со стороны системы кровообращения (гипотония), ухудшающие общую оксигенацию организма.
При вмешательствах на ЦНС возможна прямая или опосредованная альтерация жизненно важных регулирующих центров (дыхательный, сосудодвигательный). Это может повлечь снижение СВ, нарушения функции дыхания.
При операциях на сердце возможно снижение СВ вследствие неадекватной коррекции порока сердца или интраоперационной защиты миокарда при операциях с искусственным кровообращением.
При операциях на легких возможно развитие гипоксической гипоксии вследствие значительной редукции площади легочной ткани.
Пневмоторакс, гемоторакс, нарушения ритма сердца, тампонада сердца значительно влияют на СВ, функцию внешнего дыхания, а следовательно оксигенацию организма.
Операции на эндокринных железах (щитовидные и паращитовидные железы, надпочечники) могут приводить к массовому поступлению гормонов и других биологически активных веществ в кровь. Это может повлечь значительные изменения СВ, а также означать непосильную нагрузку для сердечно-сосудистой системы и, в частности, сердца как насоса.
Длительные по времени операции вызывают наведенную гипотермию, которая ухудшает доставку О2.
Развитие инфекции в послеоперационном периоде нарушает О2 баланс организма, повышая потребность в О2.
Влияние
длительности операции и наведенной гипотермии
Продолжительность локальной ишемии тканей, обусловленных действиями хирурга прямо пропорциональна длительности операции. Выраженность наведенной гипотермии также прямо связана с продолжительностью операции. По данным одного из североамериканских исследований температура тела 60-80% пациентов, поступающих в палату пробуждения после операции, была ниже 360С. В настоящее время умеренную гипотермию все чаще квалифицируют как интра- и послеоперационное осложнение [5].
Недостатки гипотермии: 1.повышение возбудимости сердца, опасность фибрилляции жедудочков сердца. 2.выраженный спазм сосудов, ухудшение органного и тканевого кровотока. 3.нарушения свертываемости крови, метаболический ацидоз [1].
Например, операция протезирования тазобедренного сустава, протекающая с гипотермией, сопровождается большей кровопотерей и, соотвественно, большим объемом гемотрансфузии [9]. После операции переохлажденный больной жалуется на чувство холода и дрожь. Дисбаланс между доставкой и потреблением кислорода может вызвать осложнения со стороны сердечно-сосудистой системы. Сама гипотермия вызывает увеличение симпатической активности, и скорее всего сама является главной причиной сердечно-сосудистых осложнений. В условиях отсутствия гипотермии в раннем послеоперационном периоде у пациентов коронарной группы риска «серьезные сердечные ослоднения» развиваются на 55% реже [10].
Заключение.
Кислородный баланс организма пациента во время операции зависит от многих факторов. Запас кислорода в организме очень мал. Анестезиолог обеспечивает максимальную доставку кислорода, пытается оптимизировать потребление О2 тканями. Сама операция является в большинстве случаев исцеляющим способом лечения. Однако хирургические приемы часто ухудшают местное кровоснабжение тканей в ходе самой операции. При операциях на жизненно важных органах угроза нарушения доставки О2 тканям принимает характер еще более серьезный, угрожающий для жизнедеятельности всего организма.
Список литературы:
- Бунатян А.А., Рябов Г.А., Маневич А.З. «Анестезиология и реаниматология». М., «Медицина», 1977 г. стр. 239
- В.И.Бураковский, Л.А.Бокерия "Гипербарическая оксигенация в сердечно-сосудистой хирургии" изд. "Медицина", Москва 1974 г.
- Иванов К.П. Биоэнергетика и температурный гомеостазис. Л., 1972.
- Материалы 9 Европейского конгресса анестезиологов, Иерусалим, Израиль, 2-7 октября 1994 г. Из книги «Актуальные проблемы анестезиологии и реаниматологии» под ред Э.В.Недашковского. Архангельс - Тромсе, 1995 г., стр. 113-115.
- Материалы 10 Европейского конгресса анестезологов. Из книги «Актуальные проблемы анестезиологии и реаниматологии» под ред Э.В.Недашковского. Архангельс - Тромсе, 2000 г., стр.5-15.
- под ред. А.А.Бунатяна «Руководство по анестезиологии» М., «Медицина», 1997, стр.76-83.
- Шустер, Шенборн, Лауер. «Шок». М., Медицина, 1977 г.
- Thews
G. Die Sauerstoff diffusion in Gehirn. Arch. ges/ Physiol., 1960, Bd 271,
s.197-226
- Schmied H, Kurz A, Sessler Dl et al (1996) Mild hypothermia increases blood loss and transfusion requirements during total hip arthroplasty. Lancet 347; 289-292
Frank SM, Fleisher LA, Breslow MJ et al. (1997)
Perioperative maintanance of normotermia reduses the incidents of morbic
cardiac events. JAMA 227; 1127-1137.