Материал взят из книги:
Зенин О.К., Гусак В.К., Кирьякулов Г.С.,Вакуленко И.П., Ельский В.Н., Клыса М.Н. Артериальная система человека в цифрах и формулах. Донецк 2002 -176c.
ГЛАВА 1
МЕТОДЫ ИССЛЕДОВАНИЯ КОЛИЧЕСТВЕННОЙ АНАТОМИИ СОСУДИСТОГО РУСЛА ТЕЛА ЧЕЛОВЕКА
Для изучения количественной макроанатомии крупных внеорганных артерий человеческого тела анатомической препаровке были подвергнуты около 4000 сегментов артерий 5 трупов. Такое количество объектов наблюдения считали достаточным поскольку главной задачей работы было не выявление статистических зависимостей геометрических характеристик артерий от пола, возраста и конституциональных особенностей обследуемых, а построение полного графа артериальной системы человека с количественной характеристикой всех его элементов, установление закономерностей ветвления сосудов, расчет их пропускной способности и уровня кровоснабжения различных органов с использованием математической модели, оценка адекватности модели и допустимости анатомических приближений путем сравнение результатов, полученных при помощи анатомического подхода с данными физиологических исследований.
Среди пострадавших лиц мужского пола было 4 человека, женского - 1. Возраст умерших находился в интервале 38-62 лет. Причиной смерти были общее переохлаждение организма (1 случай), воспаление легких (2 случая), острая сердечная недостаточность (2 случая). Трупы поступали на исследование в течение суток с
момента смерти и подвергались фиксации при помощи формалина Для этого выделялась правая или левая бедренная артерия у места выхода ее из-под пупартовой связки и канюлировалась при помощи иглы для переливания крови с крупным просветом. 5% раствор формалина на физиологическом растворе поступал в кровеносц, русло самотеком из сосуда, находящегося на высоте 1.5 м над уровнем секционного стола, на котором располагался труп, что обеспечило давление в кровеносной системе в пределах 110-115 мм Hg. Это давление оказывалось достаточным не только для эффективной перфузии фиксирующим раствором внутренних органов, но и позволяло зафиксировать сосуды в определенно степени растяжения, имеющего место у живого человек Длительность перфузии составляла 24-36 часов, после чего тру погружался в емкость с таким же раствором формалином, где хранился 1-1.5 месяца до момента использования. Препаровка сосудистой системы осуществлялась классическим анатомическим способом при помощи хирургических инструментов для разъединения и фиксации тканей. В течении всего период препаровки уход за трупом проводился путем орошения его свежим раствором формалина с периодичностью 1-2 раза в неделю
Отпрепарированные сосуды подвергались измерениям при помощи
штангенциркуля с точностью 0.05 мм. Препаровке и измерения
подвергались сосуды большого круга кровообращения диаметром не
менее 1 мм. Поэтому относительная ошибка измерения не
превышала 5%.
регистрировали наружный диаметр сосудов в его центральной
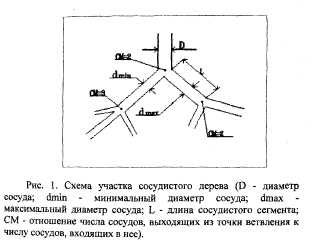
(на средине расстояния между ближайшими ветвлениями), сосудистых сегментов между двумя ближайшими гвлениями, топологические особенности сосудов (количество гвей, анастомозы), как показано на рис. 1.

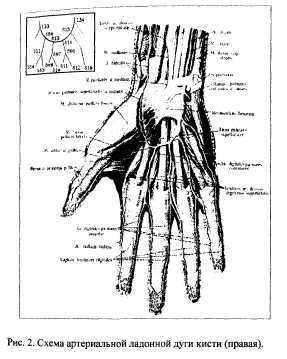
Для формализации описания сосудистого дерева его вставляли в виде связанного графа, вершины которого соответствовали точкам ветвления сосудов, а ребра - сосудистым ментам (рис.2).
Для статистических расчетов данные предварительно
обрабатывались специально нами созданной программой graf.exe, которая из графа сосудистого дерева формировала входной файл данных для статистического пакета Statgraphics (программный продукт фирмы Statistical Graphics Corporation). Этот файл данных содержал информацию о 1) внутреннем диаметре сосудов (D) рассчитанным на основании исходных данных о внешнем диаметром известном соотношении его с толщиной стенок [30, 60, 101], 2) длине (L) сосудистого сегмента (расстояние между двумя ближайшими ветвлениями), 3) факторе формы (FF=D/L - отношение диаметра сосуда к его длине), 4) площади поперечного сечения (S=3.14*D*D/4), 5) площади поверхности (s=3.14*D*L), 6) объем (V=S*L), 7) i - номере поколения (уровень деления), 8) коэффициенте размножения (СМ), который равен числу дочерних сосудов образовавшихся в результате деления данного, 9) коэффициентах деления D/dmin и D/dmax (отношение диаметра материнского сосуда к диаметру минимального и максимального дочерних сосудов Кроме того, указанная программа формировала специальный файл с обозначением характеристик вершин и ребер графа
Идентифицировались вершины графа не имеющие входных ребер
ребра с коэффициентом размножения равным 1, ребра с
отсутствующим значением диаметра и длины, ребра, участвующие образовании анастомозов, дублированные ребра, а также нарушения порядка описания графа (описание дочерних сосудов предшествовало описанию материнского). Указанная информация
исользовалась для нахождения ошибок в описании графа. Все ошнбки корректировались в ручную, кроме нарушений порядка.
Последние устранялись при помощи оригинальной программы sort.ехе.
Статистическая обработка включала вычисление основных
моментов распределения случайных величин: средней величины,
среднего квадратичного отклонения, ошибки средней, асимметрии, эксцесса. Характер распределения случайных величин оценивало по стандартному значению асимметрии и эксцесса. Если эта величина не превышала модуля числа 2, то распределение считалось нормальным и использовались параметрические статистические методы (линейный корреляционный анализ, дисперсионный анализ критерий Стьюдента достоверности различий). В противном случае обработка материала осуществлялась непараметрическими методами (корреляционный анализ Спирмена, двухсторонний критерии различий Mann-Whitney's test). Для выбора тех или иных методом статистической обработки руководствовались рекомендациями [118]
Оценка пропускной способности сосудистого русла проводилась с помощью математической модели, описание которой будет представлено ниже. При этом использовались также данные с внутриорганном артериальном русле наиболее крупных органов человеческого тела: сердца, почек, головного мозга, печени селезенки, кишечника и скелетных мышц.
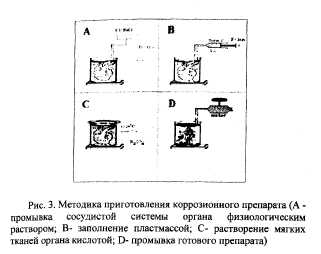
Для изучения количественной макроанатомии внутриорганного сосудистого русла были использованы 35 коррозионных препаратов артериальной системы перечисленных выше органов (по пять препаратов на каждый орган). Коррозионные препараты готовили по следующей методике (рис.3).
После извлечения из организма сосудистая система органа подвергалась промывке физиологическим раствором через
оответствующую артерию в течение 40 - 45 минут под давлением 80
90 мм Hg. При этом сам орган во время промывки и последующих
этапов приготовления препаратов находился в специальном
резервуаре, заполненном физиологическим раствором, что
предотвращало деформацию его сосудов под действием
собственного веса на стороне соприкосновения с плоскостью стола.
После промывки в артериальное русло органа при помощи шприца
нагнеталась стоматологическая пластмасса (предварительно
подготовленная: порошок + отвердитель в весовом соотношении 1:1)
"Этакрил" (АКР-15) в объеме 4% от массы органа, после чего
артерия наглухо перевязывалась. Преимуществом данной
пластмассы перед другими является то, что она медленно
полимеризуется при комнатной температуре и вследствие этого лучше заполняет сосудистое русло. Через 24 часа орган погружулся в раствор концентрированной соляной или серной кислоты на 3-4 суток. Последующая промывка осуществлялась водопроводной водой в течении нескольких часов.
Изготовленный слепок подвергали измерениям, а полученные данные математической обработке аналогично внеорганным артериям, т.е. измеряли параметры всех ветвей, получая характеристику полного графа (до определенного уровня деления артериальной системы органа. Всего было измерено порядка 11000 слепков сегментов артерий. Минимальный диаметр слепков артерий который был измерен при такой методике составлял 0.3-0.4 мм Восстановление полного графа артериальной системы органа вплоть до уровня капилляров производили при помощи мат. модели деления сосудов.
Исследовались два ее варианта. Первый вариант основывался на предположении о том, что материнский сосуд делится на равновеликие дочерние сосуды. Второй вариант предусматривая неравновеликое деление сосудов.
В соответствии с первым вариантом количество сосудов на каждом уровне деления (N;) вычислялось по формуле:
где СМ - коэффициент размножения (считается константой для Данного типа сосудистого дерева), i-номер поколения, который принимает значения от 1 до величины
где Df - конечный диаметр, до которого идет деление ссудистого дерева, Do - начальный диаметр, К - отношение диаметра дочернего сосуда к диаметру материнского (считается константой для данного типа сосудистого дерева).
Диаметр сосудов на каждом уровне определяется
соотношением
Длина сосудов находилась Li= Di*FF, где FF - фактор формы сосудов, равный отношению их диаметра к длине. Диаметры и длины сосудов использовались для расчета на каждом уровне деления суммарного просвета сосудов (Hi ), площади поверхности (Si), объема (Vi) по формулам цилиндра:

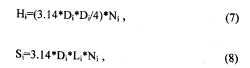

Второй вариант модели отличался от первого тем, что после деления материнского сосуда на равновеликие дочерние сосуды с диаметрам dmin (K=dmin/D), диаметр одного из них умножался на коэффициент dmax/dmin, что позволяло отразить неравновеликое деление сосудов Приведенные выше вычисления N,, L,, H;, Sj, Vj в этом случае производились дважды для "маленьких" и "больших" ветвей Алгоритм, реализующий модель равновеликого и неравновеликого деления сосудов представлен на рис.4. Он был положен в основу программы distrlev.exe.
Количественные данные о внутриорганном и внеорганном артериальном русле использовались для расчета его сопротивления пропускной способности и некоторых гемодинамических параметром (расход крови, давление) в норме и при стенозирующих заболеваниях магистральных артерий в соответствии со специально разработанной математической моделью.
Модель основывалась на следующих допущениях: кровеносные сосуды представляют собой жесткие трубки (имеется в виде относительно значении артериального давления
пределахЮО - 300 мм Hg), движение крови носит ламинарного
стационарный характер, кровь обладает свойствами ньютоновской
жидкости. Эти допущения в некоторой степени могут быть
оправданы тем, что во-первых, при атеросклерозе артерий стенка их
значительно уплотняется и приобретает свойства жесткой трубки [8],
во-вторых движение крови в мелких артериях, которые составляют
большую часть артериального русла, носит ламинарный характер и
пульсация крови значительно сглажена [88], в третьих мы не рассматриваем движение крови в капиллярах, что позволяет считать ее однородной жидкостью. Указанные допущения делают возможным применение закона Пуазейля для оценки сопротивления отдельных кровеносных сосудов (см. формулу 1).
Для расчета объемной скорости тока и давления в них необходимо учитывать характер соединения сосудов (последовательный или параллельный) . При последовательном соединении сосудов сопротивления их складываются:
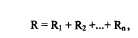
а при параллельном соединении складываются обратные величины сопративлений:
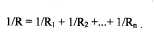
Сопротивление внутриорганных сосудов вплоть до уровня капилляров находилось с использованием данных модели деления сосудов, описанной выше. При этом сопротивление уровня вычислялось из условия параллельного соединения сосудов находящихся на данном уровне, а сопротивление всех уровней из условиях их последовательного соединения. Сопротивление капиллярного русла органов находилось из известного эпирического соотношения , определяющего сопротивление капилляров как 1/3 от общего сопротивления внутриорганных сосудов данного органа. Используя эти уравнения можно найти регионарное соротивление артериальной системы в любом заданном участке. Расчет объемной скорости тока в артериальной системе производился по формуле:

где Qi - расход крови в ветви, отходящей непосредственно от основного ствола, Qo - расход крови в основном стволе, Ro -суммарное сопротивление всех артерий из системы основного ствола, Ri - суммарное сопротивление всех артерий из системы данной ветви. Поскольку расход крови в начальной части аорты считался заданным, то можно найти искомые величины для всех ветвей аорты, а затем рекуррентно по этой же формуле для ветвей этих ветвей и т.д.
Среднее за цикл падение артериального давления на заданном сосуде находилось из соотношения:
где dP0-общее падение давления в системе, Ri- сопротивление данного сосуда, Ro - общее сопротивление сосудов, включенных с данным последовательно.
Поскольку среднее за цикл давление крови в начальной части аорты и центральное венозное давление считалось заданным, то можно найти давление в любой точке артериальной системы путем вычитания из давления в проксимальной части сосуда величиныпадения давления в данном сосуде. Модель была реализована в виде комплекса исследовательских программ. Первая из них addvien.exe осуществляла преобразование исходного артериального графа, путём добавления симметричной части, в замкнутую цепь, на вход которой подключался источник ("сердце") с заданными характеристиками Для этого входной файл с артериальным графом анализировался с целью нахождения конечных сосудов, которые маркировались определенным образом. Далее, к этим конечным внеорганным сосудам достраивались симметрично другие сосуды, образующие "венозную часть" сосудистой системы. В начало файла дописывалась информация в виде отдельных строчек об анатомических типах внутриорганных русел, характеризующихся параметрами (dmin/D, CM, FF, dmax/dmin), полученными при обработке коррозионных препаратов, и необходимыми для расчета сопротивления внутриорганных сосудов различных органов (скелетных мышц, сердца, печени, почек, селезенки, мозга, желудочно-кишечного
тракта). Выходной файл имел расширение vtr и использовавлся в
дальнейшем для расчета сопротивлений. Для этого в нем
предварительно при помощи текстового редактора для каждого конечного внеорганного сосуда указывался идентификатор типа внутриорганного русла.
Сопротивление графа рассчитывалось при помощи программы prepare exe, которая формировала выходной файл, используемый для нахождения давления (программа calcpres.exe) и объемной скороести тока (программа flowcalc.exe). Кроме табличного представления данных содержащихся в выходных файлах программ расчёта тения и объемной скорости тока, имелась возможность графического отображения при помощи программы drawgraf.exe Она формировала изображение всего графа или отдельных его частей в регулируемом масштабе с результатами моделирования (рис. 5, 6). Адекватность поведения модели оценивалась в два этапа. На первом этапе оценка проводилась путем сравнения вычисленных по анатомическим данным показателей расхода крови и давления в кровеносном русле человека в норме с непосредственно измеренными в процессе физиологических исследований по данным литературы. На втором этапе апробация модели проводилась у пациентов со стенозирующими заболеваниями магистральных сосудов. Для этого были исследованы ангиограммы сосудов отдельных участков человеческого тела 5 пациентов с различной степенью стенозирующих поражений до и после операций баллонной ангиопластики, а также данные гемодинамики, полученные у этих же пациентов интраоперацирнно. Все пациенты лечились в
 рентгенохирургическом отделении Донецкого областного лечебного
клинического объединения (ДОЛКО) (ныне институт неотложной и
восстановительной хирургии АМН Украины, директор В.К. Гусак) в
период 1992 по 1994 гг. Геометрические параметры пораженных
сосудов измерялись на ангиограммах и вводились в модель.
Диаметры остальных сосудов считались без существенных
изменений поскольку отсутствовали объективные и субъективные
признаки нарушения их проходимости. Результаты моделирования
сравнивались с реальной клинической картиной течения заболевания
в дооперационном и раннем постоперационном периоде.
рентгенохирургическом отделении Донецкого областного лечебного
клинического объединения (ДОЛКО) (ныне институт неотложной и
восстановительной хирургии АМН Украины, директор В.К. Гусак) в
период 1992 по 1994 гг. Геометрические параметры пораженных
сосудов измерялись на ангиограммах и вводились в модель.
Диаметры остальных сосудов считались без существенных
изменений поскольку отсутствовали объективные и субъективные
признаки нарушения их проходимости. Результаты моделирования
сравнивались с реальной клинической картиной течения заболевания
в дооперационном и раннем постоперационном периоде.