|
Источник: Адамов В.Г., Привалов М.В. Преобразование ультрозвуковых эхограмм органов человека в автоматизированной системе поддержки принятия решений// Вестник Херсонского государственного технического университета. – Херсон: ХГТУ. – 2004. УДК 681.3Преобразование ультрозвуковых эхограмм органов человека в автоматизированной системе поддержки принятия решенийАдамов В.Г., Привалов М.В.У статті розглянуто вирішення задачі перетворення ультразвукових ехограм органів людини у автоматизованій системі. Висвітлений сучасний стан питання та його актуальність, існуючі основні шляхи його вирішення. Наведено постановку задачі виявлення патології органів людини за допомогою перетворення вихідних ультразвукових зображень за допомогою методів обробки текстур. Запропонований та математично формалізований метод перетворення інформації у автоматизованій системі підтримки прийняття рішень, який відрізняється від існуючих перетворенням вихідного зображення у простір ознак зі згладжуванням їх значень, і дозволяє підвищити точність класифікації текстур і поліпшити якість діагностування дифузійних уражень. Введение. В настоящее время широко распространены диагностические системы, использующие для выявления заболеваний внутренних органов различные медицинские изображения: рентгеновские снимки, магниторезонансные снимки, а также ультразвуковые эхограммы. Различная патология органов может приводить к их очаговым или диффузным поражениям. Очаговое поражение, представляющее собой какое-либо образование или область с эхогенностью, значительно отличающейся от окружающих тканей, может быть выявлено с применением методов контурного анализа. Диффузное поражение приводит к изменению структуры тканей всего органа или большей его части. При этом зачастую диагностирование таких поражений врачом может быть затруднено, в особенности на ранних стадиях. В компьютерной диагностической системе подобные патологии могут выявляться с использованием методов обработки текстуры. С помощью этих методов выполняется преобразование исходной информации, представленной в виде ультразвуковых эхограмм для дальнейшего принятия решений. Таким образом, разработка эффективных методов преобразования информации в медицинской автоматизированной системе поддержки принятия решений является актуальной научно-практической задачей. Анализ существующих методов и постановка задачи. При обработке текстуры изображения с целью принятия решения можно выделить два основных этапа:
В настоящий момент рядом авторов разработан целый ряд методов расчета признаков изображения:
На этапе классификации, как правило, используются:
Рассмотренные методы апробировались авторами при анализе различных изображений. Следует отметить, что точность работы метода обработки текстуры во многом зависит от характеристик текстуры объекта исследования. Кроме того, в результате обработки изображения выбранным методом, должны быть сформированы исходные данные для подсистемы экспертной оценки, входящей в состав автоматизированной системы поддержки принятия решений. Однако все рассмотренные методы были разработаны для сегментации изображений по признакам текстуры. И результат функционирования такого метода сложно использовать для автоматического распознавания патологических областей. Поэтому ни один из рассмотренных методов без существенной адаптации применить для анализа текстур в автоматизированной системе нельзя. В связи с этим необходимо исследовать выбранные методы и на их основе выполнить обоснование и выбор метода преобразования информации для принятия решений в автоматизированной системе, позволяющего учесть особенности обработки ультразвуковых эхограмм. Решение задачи преобразования ультразвуковых эхограмм. В работе [10] экспериментально показано, что для текстурного анализа ультразвуковых эхограмм печени человека целесообразно использовать признаки разностной гистограммы второго порядка GLDS на основании того, что они имеют лучшую разрешающую способность при описании свойств текстуры ультразвуковых изображений. Точность описания текстуры для этих признаков зависит от выбора векторов смещения, для которых будет производиться их расчет. Предлагается длину вектора выбрать постоянной, в соответствии с размером зерна текстуры, а фазы векторов выбрать с шагом, равным 45о. Шага фазы вектора 45о достаточно для выявления изменений текстуры в различных направлениях, при этом погрешность будет увеличиваться для промежуточных углов поворота, но несущественно. Следует учесть такую особенность: при расчете разностного изображения Hd(i,j) вычисляется абсолютное значение разницы яркостей пикселей, разделенных вектором смещения
Для классификации текстур ультразвуковых эхограмм предлагается использовать искусственную нейронную сеть. Несмотря на то, что точность работы нейросетевых методов асимптотически приближается к точности оптимальных байесовских классификаторов, они имеют при решении задачи классификации текстур ряд преимуществ: обладают высоким быстродействием и могут устойчиво функционировать в случае наличия на входе зашумленных, перекрывающихся или нечетких данных, распределения которых неизвестны либо различны. Анализируя гистограммы распределений значений признаков GLDS для различных текстур, построение которых на примере печени было выполнено в [10], было выяснено, что эти распределения накладываются друг на друга. Таким образом, входные данные классификатора являются нечеткими. В связи с этим для классификации текстур ультразвуковых эхограмм печени предлагается использовать в рассматриваемых нейронных сетях нечеткий выходной слой. С каждым классом текстуры, который должен распознаваться нейронной сетью, при таком построении сети сопоставляется отдельный нейрон выходного слоя. Данный нейрон в случае идеального соответствия распознаваемой текстуры классу, на который он настроен, выдаст на выходе 1. В противном случае – значение в диапазоне от 0 до 1. При этом данное значение будет тем ближе к 1, чем ближе распознаваемая текстура к той, на которую настроен нейрон. Такой способ классификации текстур более надежен, чем при использовании стандартного для классифицирующих нейронных сетей двоичного кодирования результата, когда определенному классу назначается двоичная комбинация, закодированная выходным слоем. Это обусловлено тем, что при двоичном кодировании классов нейронная сеть функционирует в более жестких условиях, чем при назначении каждому классу по отдельному нейрону. Преимуществом сети, в которой выходной слой является нечетким, является то, что такая сеть позволяет более эффективно проводить классификацию входных образов, объединенных в размытые или пересекающиеся множества. С вышесказанного преобразование информации, полученной с помощью ультразвуковой аппаратуры необходимо выполнять следующим образом. Ультразвуковые эхограммы получают с использованием имеющихся аппаратных средств, а затем осуществляется оцифровка и ввод изображения в базу данных автоматизированной системы. При этом выполняется преобразование изображения в матрицу яркостей. После этого с целью уменьшения влияния помех выполняется фильтрация с помощью медианного фильтра с крестообразным окном размером 3х3 пикселя. Входное изображение содержит некоторые N текстур из множества C{c1, c2, ..., cN} и представлено в виде функции яркости I от координат пикселя i и j: I(i,j). Требуется получить изображение I*(i,j), где значения яркости принадлежат множеству R*{r1, r2, ..., rN}, при этом каждое значение соответствует определенному классу текстур из множества C. Для решения поставленной задачи предлагается следующий метод. Каждое значение яркости пикселя изображения должно быть заменено набором признаков, рассчитанных по его окрестности размером WxW. По оцифрованному изображению выполняется расчет признаков разностной гистограммы второго порядка GLDS. C учетом выбранных признаков исходное изображение в окрестности каждого пикселя подвергается следующим преобразованиям. На начальном этапе выполняется расчет матрицы
где Hd(i,j) - разностное изображение для вектора смещения
где K – количество уровней яркости, представимых на исходном изображении (для ультразвуковых эхограмм печени, полученных от современной ультразвуковой аппаратуры K=256), а величины pd(k) определяются следующим образом:
Для выполнения преобразований, приведенных в (1) - (3), необходимо создать программный модуль, выполняющий требуемые расчеты. По полученным значениям pd(k) производится непосредственный расчет набора признаков GLDS. Для каждого используемого вектора смещения
Расчеты (1) - (7) целесообразно производить для каждого из четырех векторов смещения Для расчета признаков целесообразно создать программный модуль. Для этого необходимо определить длину вектора смещения d0, соизмеримую с размером текстурообразующего элемента на ультразвуковых снимках печени. В результате преобразований для каждой точки изображения будет сформировано множество из 12 значений признаков:
Здесь si:
Так как текстура является пространственным свойством изображения, то при текстурном анализе должна рассматриваться определенная окрестность каждого пикселя, охватывающая несколько текстурообразующих элементов – элементарных фрагментов, из которых формируется текстура. С этой целью для получения входных данных, необходимых для классификации, можно использовать обработку изображения с помощью скользящего окна. Как правило, окно имеет прямоугольную форму. В данном методе обработка изображения производится последовательно для его локальных участков, которые захватываются окном, перемещающимся («скользящим») по всему изображению. Однако использование метода скользящего окна при анализе текстур ультразвуковых эхограмм сопряжено с некоторыми трудностями, которые необходимо учесть в методе. Одной из сложностей является неизбежное увеличение погрешности при обработке участков изображения, находящихся на границе двух и более текстур. Это связано с тем, что на границе окном будут захвачены текстурообразующие элементы различных текстур, что приведет к получению входных данных классификатора, не соответствующих ни одному из распознаваемых классов, либо ошибочно соответствующих какому-либо из них. При этом с ростом размеров окна будет возрастать и область, подверженная ошибкам. Однако следует учитывать, что значительное уменьшение размеров окна также может негативно повлиять на результат классификации текстур. При обработке пикселей изображения с использованием окна слишком малого размера возможна неверная классификация текстур по всему изображению, так как для нормальной классификации необходим захват окном нескольких текстурообразующих элементов. Для снижения погрешности обработки стыков нескольких текстур в разрабатываемом методе предлагается использовать следующий подход: выполнять расчет признаков текстуры с использованием окна малого размера, но достаточного для расчета признаков, после чего производить устранение статистической неоднородности путем сглаживания значений рассчитанных признаков с применением фильтра, сохраняющего контуры объектов. После этого значения признаков подвергаются сглаживанию с использованием фильтра, сохраняющего контуры. Таким образом, для каждой точки изображения множество признаков преобразуется следующим образом:
Эта операция позволяет уменьшить число ошибок внутри областей с однородной текстурой, а также на стыках нескольких текстур. Для решения задачи сглаживания значений признаков, рассчитанных для ультразвуковых эхограмм печени, необходимо выполнить исследование и выбор сглаживающего фильтра, сохраняющих контуры, а также определить размер его окна. Следующим этапом обработки является нахождение классов текстур органа, представленного на изображении, с целью формирования входных данных для подсистемы экспертной оценки и подсистемы визуализации. Для этих целей сглаженные признаки предъявляются на вход нейросетевого классификатора для распознавания и получения результирующего изображения:
где NN обозначает операцию классификации текстур нейронной сетью с нечетким выходным слоем. Математическая модель нейронной сети, с учетом экспериментально определенной рациональной структуры имеет следующий вид:
В выражении (11) Экспериментальные исследования предложенного метода показали, что точность классификации текстур слабо зависит от этого угла поворота, ее разброс составляет не более 5%. Сравнение точности работы предложенного метода при обработке искусственных текстур с точностью работы других методов показало, что данный метод позволяет несколько увеличить точность классификации текстур и достичь точности классификации 94%. Для сравнения, средняя точность распознавания альбомных текстур по методу, использующему многоканальную фильтрацию Габора [3], составила 88,2%, а для метода, использующего стандартные вейвлет-сигнатуры [2], 68,5%. Применение в данном методе сглаживания значений признаков позволяет получить более однородные входные данные для классификатора, за счет чего снижается погрешность распознавания текстур внутри однородных участков, а также на границах нескольких текстур. Выводы и рекомендации относительно дальнейших исследований. Таким образом, в данной работе предлагается метод преобразования информации в автоматизированной системе поддержки принятия решений, отличающийся от существующих преобразованием исходного изображения в пространство признаков со сглаживанием их значений. Параметры векторов смещения, выбранные для данного метода, позволяют учесть при классификации возможность обработки текстур под различными углами относительно краев окна. На основании предложенного метода можно выделить следующие направления дальнейших исследований: разработку экспертной системы, позволяющей формировать предварительный консультативный диагноз; разработку архитектуры автоматизированной системы поддержки принятия решений для выявления диффузных поражений органов человека; адаптацию метода для решения прикладных задач в промышленности. ЛИТЕРАТУРА:
Источник: Адамов В.Г., Привалов М.В. Преобразование ультрозвуковых эхограмм органов человека в автоматизированной системе поддержки принятия решений// Вестник Херсонского государственного технического университета. – Херсон: ХГТУ. – 2004. |
 , поэтому для диаметрально противоположных векторов смещения будут получены идентичные разностные изображения и, соответственно, одни и те же вектора GLDS. В связи с этим расчет признаков GLDS для двух диаметрально противоположных векторов смещения нецелесообразен. При обработке текстур с длиной вектора смещения, равной 1, анализ изменений изображения во всех направлениях может быть выполнен для фаз Q=0о, 45о, 90о, 135о. Большинство методов обработки текстуры, рассмотренных выше используют детекторы изменений изображения в каких-либо четырех направлениях: либо по горизонтали и вертикали, либо по диагонали. Поэтому следует использовать вектора смещения с фазами, равными Q=0о, 45о, 90о, 135о. Эти фазы соответствуют векторам
, поэтому для диаметрально противоположных векторов смещения будут получены идентичные разностные изображения и, соответственно, одни и те же вектора GLDS. В связи с этим расчет признаков GLDS для двух диаметрально противоположных векторов смещения нецелесообразен. При обработке текстур с длиной вектора смещения, равной 1, анализ изменений изображения во всех направлениях может быть выполнен для фаз Q=0о, 45о, 90о, 135о. Большинство методов обработки текстуры, рассмотренных выше используют детекторы изменений изображения в каких-либо четырех направлениях: либо по горизонтали и вертикали, либо по диагонали. Поэтому следует использовать вектора смещения с фазами, равными Q=0о, 45о, 90о, 135о. Эти фазы соответствуют векторам  и
и  соответственно, как показано на рис. 1.
соответственно, как показано на рис. 1.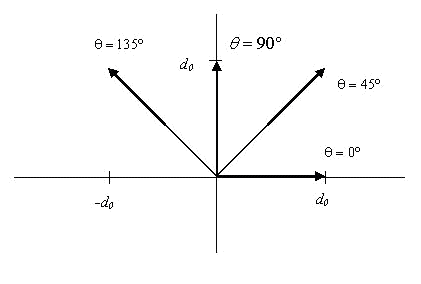
 . Далее по полученной матрице рассчитывается вектор GLDS:
. Далее по полученной матрице рассчитывается вектор GLDS: ,
, ,
, и окрестности размером WxW точки изображения с координатами (i,j) будет рассчитано следующее множество признаков:
и окрестности размером WxW точки изображения с координатами (i,j) будет рассчитано следующее множество признаков: ,
, ,
, ,
, .
. ,
, ;
; ;
; .
. ,
, ,
, ,
, - вектор признаков с уже сглаженными значениями, матрицы [W1]; [W2] и [W3] - матрицы весовых коэффициентов слоев нейронной сети.
- вектор признаков с уже сглаженными значениями, матрицы [W1]; [W2] и [W3] - матрицы весовых коэффициентов слоев нейронной сети.  - это векторы порогов соответствующих слоев нейронной сети; th –тангенциальная активационная функция. Согласно предлагаемому методу преобразования, приведенные в (1) – (11) выполняются для каждого пикселя исходного изображения.
- это векторы порогов соответствующих слоев нейронной сети; th –тангенциальная активационная функция. Согласно предлагаемому методу преобразования, приведенные в (1) – (11) выполняются для каждого пикселя исходного изображения.