

ДонНТУ > Портал магiстрiв ДонНТУ



Факультет екології та хімічної технології
Спеціальність: Екологія хімічних виробницта
Матеріали до теми випускної роботи: Про автора
ПЛАН
Вступ
1 Методи анализу
1.1 Термічні методи аналізу
1.2 ІЧ-спектроскопія
1. 3 Рентгенофазний аналіз
1.4 Йодометрія
2 Результати досліджень
Висновки
Перелік посилань
ВСТУП
Високотемпературний синтез, що самопоширюється, (СВС) відкрили у 1967 році А. Г. Мержанов, І. П. Боровинська і В. М. Шкірко. Тоді було виявлено явище розповсюдження фронту горіння в сумішах порошків тугоплавких хімічних елементів, які призводять до утворення тугоплавких сполук. Це новий напрямок, в якому в основному вивчалися системи простих речовин. Реакції в таких системах являють собою екзотермічну взаємодію хімічних елементів в конденсованій фазі, що протікає в режимі горіння. [1]
Як відомо, у системах безводні солі - пероксидні сполуки натрію можливе протікання обмінних реакцій [2], і виділяється при цьому тепла достатньо для здійснення взаємодії в режимі саморозповсюдження (СРВ). Наприклад, Mg(ClO4)2 – Na2O2, Cu2Cl2 – NaO2 [3,4]. Вивчення реакцій, здатних протікати в режимі СРВ, становить інтерес для розвитку нових методів одержання неорганічних сполук або простих речовин. За літературним даними відомо, що при взаємодії хлоридів деяких важких металів з пероксидними сполуками натрію одним з продуктів є газоподібний хлор [5,6]. Так як в даний час хлор є найбільш поширеним знезаражуючим агентом, то його отримання становить значний інтерес. Однією з переваг отримання газоподібного хлору в ході СРВ є можливість використовувати тепло реакції без підведення енергії ззовні. Іншою перевагою є можливість використання в процесі солей важких металів - відходів ряду виробництв.
Метою даної роботи є вивчення взаємодії хлориду кобальту з супероксидом натрію і з хлоратом натрію, зокрема, кількості та складу газоподібних продуктів в залежності від складу вихідної суміші з метою можливого їх подальшого використання в якості знезаражуючого агенту.
1 МЕТОДИ АНАЛІЗУ
У даній роботі були використані наступні методики аналізу: диференційно-термічний термогравіметричний і ренгенофазний аналіз суміші твердих речовин, інфрачервона спектроскопія, йодометрія.
1.1 Термічні методи аналізу
Термічні методи аналізу є одними з основних при дослідженні процесів у конденсованих системах. Серед найбільш широко застосовуваних неізотермічних методів виділяються диференціальний термічний (ДТА) і термогравіметричний (ТГ) аналіз. Експериментально одержувані криві ДТА й ТГ у більшості випадків використовуються для одержання первинної інформації про температурний інтервал стабільності речовин, про склад речовини, температури початку помітної взаємодії й фазових перетворень.
Модель ДТА можна розглядати як схему, що складається з двох ячійок, призначених для термічного аналізу, зовнішнього джерела тепла (печі) 1 і деякої ділянки навколо ячійки, через яку теплова енергія підводиться або відводиться від ячійки. Одна з ячійок являє собою тигель із досліджуваним зразком 4, інша - тигель із термічно інертною речовиною, прийнятою як еталон 3 (рис. 3.1).

1 – піч; 2 – термопара; 3 – еталон; 4 - речовина
Рисунок 3.1 – Модель ДТА
Метод ДТА заснований на порівнянні термічних властивостей зразка досліджуваної речовини й термічно інертної речовини, прийнятої як еталон. Параметром, що реєструється, служить різниця їхніх температур, вимірювана при нагріванні зразка з постійною швидкістю, яка може бути представлена у вигляді функції температури зразка, еталона або нагрівача. Зміни температури зразка викликаються фізичними переходами або хімічними реакціями, пов'язаними зі зміною ентальпії. Ці перетворення супроводжуються поглинанням або виділенням тепла.
Термогравіметрія (ТГ) - метод термічного аналізу, при якому реєструється зміна маси зразка залежно від температури. У цьому випадку використовувалася динамічна термогравіметрія, при якій температура середовища, що оточує зразок, який нагрівається, змінюється з постійною швидкістю.
Установка ДТА дозволяє в автоматичному режимі записувати криві залежності різниці температури між зразком і еталоном від температури печі (криві ДТА) і криві залежності втрати маси зразка від температури печі.
Схема установки представлена на рис. 3.2.
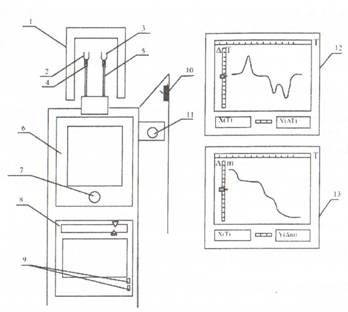
1 - піч; 2 - тигель з еталоном; 3 - тигель з речовиною; 4 - термопара еталона; 5 - термопара речовини; 6 - ваги; 7 - ручка вмикання ваг; 8 - прилад керування вагами; 9 - тумблери вмикання керування ваг; 10 - рукоятка вмикання печей; 11 - задатчик температури; 12 - самопис кривих ДТА; 13 - самопис кривих ТГ
Рисунок 3.2 - Схема установки ДТА
Установка складається з:
1 – двох печей, які закріплені на штативі, який повертається, що дозволяє при роботі однієї печі забезпечувати охолодження іншої;
2 – тиглі з інертною еталонною речовиною ( α-А12О3);
3 – тиглі для досліджуваної речовини;
4 – термопара, що вимірює температуру еталона. Термопара підключена до каналу Х самописів (12, 13), що приводить при її нагріванні до зсуву каретки самописів зліва праворуч. Таким чином, на самописах по осі Х фіксується температура печі в кожний момент часу;
5 – термопара, яка вимірює температуру досліджуваної речовини. Ця термопара підключена назустріч термопарі (4) (рис.3.1). Таким чином, різниця між ЕДС термопари (4) і термопари (5) пропорційна різниці температур між речовиною й еталоном. Ця різниця виводиться на канал У самописа (12, лівий самопис на установці);
6 – аналітичних ваг з електромагнітною корекцією положення рівноваги. На відміну від звичайних аналітичних ваг, у яких за положенням рівноваги спостереження ведеться візуально, у даних вагах відхилення стрілки від положення рівноваги фіксується фотоелементом. При відхиленні ваг від положення рівноваги фотоелемент виробляє сигнал, що підсилюється й направляється на електромагніт, розташований під чашкою ваг. Електромагнітне поле взаємодіє з постійним магнітом, розташованим на чашці ваг і повертає ваги в стан рівноваги. Напруга на електромагніті, що втримує ваги в стані рівноваги й пропорційна масі зразка, фіксується самописом (13) по каналу В як зміна маси речовини.
7 – ручки вмикання ваг;
8 – приладу керування вагами. Прилад приймає сигнал з фотоелемента й виробляє напругу для керування електромагнітом;
9 – тумблерів вмикання приладу керування вагами;
10 – рукоятки вмикання печей. За допомогою даної рукоятки можна вмикати печі № 1 або № 2;
11 – задатчик температури. Він складається з електродвигуна, редуктора змінного опору й забезпечує рівномірне нагрівання печі з певною швидкістю. З допомогу рухливої шестірні редуктора швидкість нагрівання печі можна змінювати. Задатчик температури починає працювати після включення печі;
12 – самопис кривих ДТА. Канал Х самописа настроєний і проградуїрований на температуру печі.
13 – самопис кривих ТГ. Канал Х самописа настроєний і проградуїрований на температуру печі.
По отриманим у результаті термічного аналізу кривим можна визначити наявність ендо- і екзотермічних ефектів і зробити припущення про наявність фізичних або хімічних перетворень; визначити температури перетворень; із кривої ТГ зробити розрахунки втрати маси. як в абсолютному вираженні, так і в процентному.
1.2 ІЧ-спектроскопія
ІЧ-спектроскопія – один з основних методів молекулярної спектроскопії – є одним з найбільш часто застосовуваних методів визначення складу й особливостей будови твердих речовин. Великі можливості методу пояснюються тим, що ІЧ-спектри багатьох сполук є характеристичними, оскільки поглинання ІЧ-випромінювання, що проходить через зразок, відбувається на частотах, що відповідають енергії переходу атомів у молекулі з основного стану в збуджене.
Інфрачервоне випромінювання – унікальне у своєму роді фізична властивість. Не існує двох сполук (за винятком оптичних ізомерів) з різними структурами, але однаковими ІЧ-спектрами. Таким чином, для ідентифікації невідомої речовини досить порівняти його спектр зі спектрами чистих відомих речовин. Маючи спеціальний каталог таких спектрів порівняння, можна досить надійно ідентифікувати будь-яку речовину.
Основними частинами ІЧ-спектрофотометра є: монохроматор, що забезпечує виділення монохроматичного випромінювання з«білого» спектра джерела випромінювання; джерело випромінювання (розігрітий до 1200°С стрижень), який дозволяє одержувати інфрачервоне випромінювання в діапазоні довжин хвиль 2,5-25 мкм; приймач випромінювання, що приймає випромінювання, яке пройшло крізь зразок, й преобразує його в слабкий електричний сигнал; система, що підсилює сигнал приймача й управляє приводом пера самописа; кюветне відділення, яке служить для розміщення аналізованих зразків.
Принципова схема спектрофотометра представлена на рисунку 3.3.
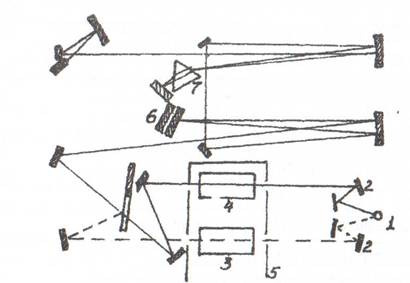
1 - джерело випромінювання; 2 - система дзеркал; 3 - досліджувана проба; 4 - еталонна проба; 5 - кюветне відділення; 6 - дифракційні решітки; 7 - призма
Рисунок 3.3 – Оптична схема інфрачервоного спектрофотометра
Промені, що виходять із джерела 1, за допомогою системи дзеркал 2 направляються на досліджувану 3 і еталонну 4 проби в кюветному відділенні 5 спектрофотометра. Потім обидва пучки сходяться, віднімаються й направляються системою дзеркал на вхід монохроматора. Основною частиною монохроматора є дифракційні решітки 6 і призма 7, які виділяють із суцільного випромінювання компонент з відповідною довжиною хвилі. Далі промені попадають на термоелемент, що у комплексі з підсилювальною системою виробляє сигнал, який керує рухом пера самописа. Залежно від кута повороту дифракційних решіток і призми на приймач попадає монохроматичне випромінювання з різною довжиною хвилі. Обертаючи решітки й призму, наприклад, за допомогою електродвигуна, можна забезпечити безперервне розгорнення випромінювання по довжинах хвиль. За допомогою приймача можна виміряти інтенсивність випромінювання, яке пройшло крізь зразок, як функцію довжини хвилі, що і є ІЧ-спектром.
Для вивчення спектральних характеристик твердих речовин застосовують в основному методику реєстрації ІЧ-спектрів поглинання. Тому успіх спектрофотометричного дослідження у вирішальній ступені залежить від якості й способу готування проби. У більшості випадків використовуються три методики готування проб, а саме: розтирання зразка з вазеліновим маслом; пресування таблеток із бромистим калієм; готування плівок. При використанні всіх методик досліджувані зразки необхідно розтирати доти, доки їхній розмір не стане менше довжини хвилі ІЧ-випромінювання (2,5 - 25 мкм) [7].
1.3 Рентгенофазовий аналіз
Метод рентгенівського дифракційного аналізу заснований на дифракції рентгенівських променів кристалічними речовинами. Він підрозділяється на рентгеноструктурний і рентгеноспектральний аналізи.
При рентгеноструктурному аналізі можуть бути визначені тип кристалічної решітки досліджуваного зразка, розміри елементарної ячійки; обчислені міжплоскісні атомні відстані; зроблений якісний і кількісний аналізи; встановлено фазовий склад речовини; досліджені структура полікрісталів і розподіл структурних дефектів в кристалах; проведені інші спеціальні дослідження складу і структури монокристалів і кристалічних порошкоподібних речовин, твердих розчинів, у тому числі керамічних та вогнетривких матеріалів.
Гігроскопічні і окислювальні речовини нeo6xідно при зйомці рентгенограм ізолювати від навколишнього середовища. Якість рентгенограм залежить від розміру кристалів, і зазвичай досліджувана речовина попередньо ретельно подрібнюється. Приготування зразка ведеться в такій послідовності:
а) досліджувана речовина подрібнюється в порцеляновій (агатовій) ступці і просіюється через сито J 0063;
б) отриманий тонкодисперсний порошок впресовується в спеціальну кварцову кювету (при необхідності використовується звязуючий матеріал - цапонлак, клей трагакант, канадський бальзам, пластилін). Поверхня зразка повинна бути рівною та збігатися з поверхнею кювет.
Рентгенофазовий апарат ДPOH-YMI складається з окремих блоків і вузлів. Функціональна схема установки наведена на рисунку 1.4.

1 - блок електричного живлення; 2 - пристрій живлення; 3 - діфрактометрична стійка; 4 - рентгенівська трубка; 5 - гоніометр; 6 - гоніометрична приставка; 7 - блок детектування; 8 - керуючий комплекс; 9 - блок реєстрації; 10 - рахунковий комплекс; 11 - самописець; 12 - друкувальний пристрій; 13 - перфоратор.
Рисунок 1.4 – Функціональна схема дифрактометра ДРОН-УМІ
Живлення дифрактометра здійснюється через блок електричного підключення 1. Основним вузлом пристрою є дифрактометрична стійка 3, на якій змонтована рентгенівська трубка 4 в захисному кожусі, гоніометр 5, блок детектування 7. Стійка 3 розміщена на столі живильного рентгенівського пристрою 2, який забезпечує живлення трубки 4 стабілізованою високою напругою.
Керуючий комплекс 8 призначений для забезпечення управлінням гоніометром та виконавчими механізмами, а також для збору та обробки інформації з подальшим виведенням на реєструючий пристрій (друкувальний пристрій 12 або перфоратор 13). Керуючий комплекс забезпечує автоматичний режим роботи пристрою ДРОН-УМІ за заданою оператором програмою. Для цього застосовується міні-ЕОМ 10.
Відображене від досліджуваного зразка, розміщеного в гоніометріческой приставці 6 гоніометра, рентгенівське випромінювання потрапляє в блок детектування 7, в якому кванти рентгенівського випромінювання перетворюються в електричні імпульси.
В якості детектора випромінювання в діфманометрі використовуються пропорційні лічильники. Імпульси з лічильника йдуть в блок реєстрації 9 керуючого комплексу, підсилюються і подаються в дискримінатор. Отриманий при цьому вихідний сигнал записується у вигляді рентгенограм на діаграмній стрічці самописцем 11 або автоматично обчислюється за програмою обчислювального комплексу 10, а потім виводиться на друк [7].
1.4 Йодометрія
В основі методу лежить напівреакція
У даній роботі йодометрія використовується для непрямого визначення хлору, що відновився йодидом калію
При цьому кількість J2, що виділяється, еквівалентна кількості хлору. Йод, який виділився, відтитровується стандартним розчином тіосульфату натрію в присутності індикатора - крохмалю
Таким чином, кількість тіосульфату натрію, яка пішла на титрування, еквівалентна кількості хлору.
2 РЕЗУЛЬТАТИ ДОСЛІДІВ
У даній роботі досліджувалася взаємодія компонентів систем CoCl2-NaO2 и CoCl2-NаСlО3.
Для проведення аналізу попередньо хлорид кобальту висушували при температурі 130 °С. Для приготування зразків використовували фракцію СоCl 2 з діаметром часток 0,05 - 0,1 мм. Супероксид натрію і хлорат натрію використовувалися без додаткової обробки. Суміші хлориду кобальту з супероксиду натрію і з хлоратом натрію готувалися в кульовому млині.
В даній роботі був використаний диференціально-термічний (ДТА) та термогравіметріческій аналіз (ТГ) суміші твердих речовин. При цьому суміш нагрівається від кімнатної температури до 500 °С зі швидкістю 14 град / хв. Для визначення швидкості СРВ методом глухого пресування пресували таблетку, що має діаметр 30 мм. Ініціювання процесу СРВ здійснювалося шляхом підведення до таблетки високотемпературного джерела тепла. Також для аналізу твердих продуктів взаємодії вихідних речовин застосовувався метод ІЧ-спектроскопії, методика з вазелиновое маслом. Аналіз газоподібних продуктів, зокрема, визначення наявності газоподібного хлору і його кількості, здійснювався йодометричним методом, для чого газову суміш, що утворилася після взаємодії, збирали, а потім прокачувати через підкисленою розчин йодиду калію.
При проведенні термічного аналізу суміш хлориду кобальту з хлоратом натрію з мольним співвідношенням компонентів відповідно 3:2 нагрівається від кімнатної температури до 500 °С зі швидкістю 14 град / хв. При цьому на кривій ДТА (рис. 1) при температурі 240 °С фіксується екзотермічний ефект. Втрата маси склала 23,01%

Рисунок 1 - Крива ДТА для системи CoCl2 : NаСlО3 при мольному співвідношенні компонентів 3:2
Взаємодія вихідних компонентів при мольному співвідношенні вілповідно 3:2 проходить за наступним рівнянням реакції
Можливо протікання побічних процесів, наприклад, згідно з літературними даними, окислення оксиду кобальту, що утворився в ході реакції (1), СоО при нагріванні на повітрі вище 390 °С до Co3O4[8]
з урахуванням цього процесу сумарне рівняння реакції має наступний вигляд:
Теоретична Втрата маси у відповідності з рівнянням реакції (3) становить 23%. При проведенні термічного аналізу втрата маси склала 23%, а при проведенні СРВ - 22%.
Аналіз вмісту газоподібного хлору в газоподібних продуктах взаємодії здійснювався йодометричним методом. Для цього газову суміш що утворилася після взаємодії хлориду кобальту з хлоратом натрію з мольним співвідношенням відповідно 3:2, відбирали, а потім прокачувати через підкисленою розчин йодиду калію.
В результаті проведеного аналізу газоподібних продуктів СРВ встановлено, що хлор виділяється в кількості 0,53 г на 5 г вихідної суміші, що відповідає 23% від кількості хлору, що міститься в первісної суміші в вигляді хлорид- і хлорат - іонів. Вміст хлору в газоподібних продуктах становить 45% об. [9]
Раніше встановлено, що в умовах ДТА взаємодія хлориду кобальту з супероксиду натрію при мольном співвідношенні 3:2 починається при температурі 258 °С. При даній температурі на кривій ДТА (рис. 2) фіксується сильний екзотерміческій ефект. Йому на кривій ТГ відповідає стрибкоподібно втрата маси, яка склала 14,79%.
;
Рисунок 2 - Криві ДТА и ТГ для системи СоCl2 : NaO2 при мольному співвідношенні компонентів 1:2
Отриманий ефект відповідає взаємодії компонентів системи відповідно до наступних рівнянь реакцій:
Розкладання NaO2 до Na2O2 відбувається при температурі 140 - 250 °С.
Також може протікати побічна реакція (2). З урахуванням її сумарний процес взаємодії хлориду кобальту з супероксидjv натрію має наступний вигляд:
При надлишковому вмісті хлориду кобальту в суміші СоCl2 - NaO2 можливе протікання побічних реакцій, зокрема, взаємодія хлориду кобальту, який не прореагував, з киснем. Процес може бути виражений наступним чином:
При кімнатній температурі цей процес неможливий (ΔGº = 24,473 кДж / моль), але при температурі вище 304 ºС такий процес стає термодинамічно можливим. Тобто з урахуванням побічної реакції сумарне рівняння процесу взаємодії хлориду кобальту з супероксидом натрію має наступний вигляд:
Аналіз газоподібних продуктів взаємодії компонентів системи СоCl2 - NaO2 при мольному співвідношенні 3:2 показав, що кількість газоподібного хлору, що виділяється, складає 7,1 • 10-3г на 5 г суміші, що відповідає 0,3% від кількості хлору, що міститься в первинній суміші у вигляді хлорид-іонів. Вміст хлору в газоподібних продуктах становить 0,4%. При цьому збільшення вмісту хлориду кобальту в системі не призведе до суттєвого збільшення кількості хлору в газоподібних продуктах. Тому отримання газоподібного хлору при взаємодії компонентів системи СоCl2 - NaO2 є малоперспектівним [10].
ВИСНОВКИ
Порівняння результатів, отриманих при дослідженні взаємодії хлориду кобальту з супероксиду натрію і з хлоратом натрію, показує, що в останньому випадку ефективність отримання газоподібного хлору за всіма показниками практично на два порядки вище.
Таким чином, дані факти підтверджують, що існує можливість отримання газоподібного хлору в ході СРВ в системі хлорид кобальту - хлорат натрію, а також цей процес може протікати у відповідності з наведеними рівняннями реакцій. Подальше вивчення процесів, що протікають у системі CoCl2 - NаСlО3, може бути перспективним для отримання газоподібного хлору [9].
ПЕРЕЛІК ПОСИЛАНЬ
1. Процессы горения в химической технологии и металлургии / Под ред. Мержанова А. Г. Ред. - изд.отдел ОИХФ АН СССР, г. Черноголовка, 1975 г. - 289с.
2. Росоловский В. Я., Никитина З. К., Синельников С. М. Взаимодействие перхлората лития и перхлората кальция с супероксидом и пероксидом натрия // Журн. неорг.химии. - 1995 г. - Т.40. - №1. - с. 6-11.
3. Шаповалов В. В. Самораспространяющееся взаимодействие безводного перхлората магния с пероксидными соединениями натрия // Укр. хим. журн. 2000 г. Т. 66, № 6. С. 96-101.
4. Мнускина Ю. В., Шаповалов В. В., Шибико М. М. Взаимодействие хлорида меди (І) с супероксидом натрия/ Сборник статей ДонНТУ, 2005 г., ст.37-42.
5. Обзор методов очистки воды: обеззараживание воды / Очистные сооружения,- http://www.1os.ru/content/subs/doc24
6. Хлорирование воды / Нова Терра,- http://www.superfilter.ru/index.php?Page=hlor_water
7. Методические указания к лабораторным работам по курсу "Физика твердого тела" (для студентов специальности 0830) /Сост. В. В. Шаповалов, Ю. Н. Белогуров. - Донецк: ДПИ, 1988г. - 20 с.
8. Краткий справочник физико-химических величин. Изд. 8-е, перераб./ Под ред. А. А. Равделя и А. М. Пономаревой. - Л. Химия, 1983.
9. Получение обеззараживающих агентов при самораспространяющемся взаимодействии в системе CoCl2 - NaClO3. Кулик Т. А., Мнускина Ю. В. Збірка доповідей VIІІ Міжнародної наукової конференції аспірантів і студентів. Т. 2 - Донецьк: ДонНТУ, ДонНУ - 2009 г., с. 108-109.
10. Получение хлора в ходе самораспространяющегося взаимодействия в системе CoCl2 - NaO2. Кулик Т. А., Мнускина Ю. В. Збірка доповідей VIІ Міжнародної наукової конференції аспірантів і студентів. Т. 2 - Донецьк: ДонНТУ, ДонНУ - 2008 г., с. 134-135.