Константа скорости химической реакции. Энергия активации
И.М. Эммануэль, Д.Г. Кнорре.
Источник:И.М. Эммануэль, Д.Г. Кнорре. Курс химической кинетики, изд. "Высшая школа", 1979, с.73-76.
При заданных внешних условиях (температура, давление, среда, в которой происходит
процесс) скорость химического превращения является функцией только концентраций компонентов реакционной смеси. Уравнение,
описывающее зависимость скорости химического процесса от концентрации компонентов реакционной смеси, называется
кинетическим уравнением химического процесса.
Очень часто в химической кинетике приходится иметь дело с процессами, скорость
которых оказывается пропорциональной произведению концентраций реагирующих веществ в соответствующих степенях.
Если зависимость скорости реакции от концентрации реагирующих веществ записывается
в виде
 (1) (1)
то величины ni (i = I, 2, ..,, I) принято называть порядком
реакции по веществу Аi.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции.
Множитель и в кинетическом уравнении (1), показывающий, с какой скоростью идет химический процесс при концентрациях
реагирующих веществ, равных единице, называется константой скорости химического процесса. Наряду со скоростью константа
скорости химического процесса является основной величиной в химической кинетике.
Степенная зависимость скорости реакции от концентраций реагирующих веществ (1)
практически всегда выполняется для скорости отдельных стадий химического процесса. При этом как порядок по отдельному
компоненту, так и суммарный порядок реакции являются целыми положительными числами. Для отдельной стадии порядок
реакции никогда не превышает трех. Поэтому особо важное значение в химической кинетике имеют реакции первого, второго
и третьего порядка.
Константы скорости реакций различного порядка имеют разную размерность. Поскольку
размерность скорости реакции независимо от кинетического уравнении этой реакции есть [С] [t]-1, то из (1) следует, что
размерность константы скорости для реакции первого порядка [t]-1, второго порядка [С]-1 [t]-1, третьего порядка
[С]-2 [t]-2.
В соответствии с этим единицами измерения констант скорости являются:
- для реакции первого порядка: с-1
- для реакции второго порядка: м3/молекула · с (м3 · с-1) или М-1 · с-1 [л/(моль · с)]
- для реакции третьего порядка: м6/молекула2 · с (м6 · с-1) или М-2 · с-1 [л2/(моль · с)]
При использовании молярных единиц для выражения концентрации при расчетах в
системе единиц СИ следует помнить, что это эквивалентно использованию единиц кмоль/м3, и поэтому все остальные величины,
относимые к определенному количеству вещества (универсальная газовая постоянная, число Авогадро), должны также браться в
расчете на 1 киломоль.
Следует подчеркнуть, что константы скорости реакций разных порядков являются разными
физическими величинами и сопоставление их абсолютных значений лишено какого бы то ни было смысла. При переходе от одной
единицы измерения концентрации к другой константа скорости реакции первого порядка не изменяется, константа скорости
реакции второго порядка изменяется в 6,02 · 1026 раз, а константа скорости реакции третьего порядка — в 3,6 · 1053 раз.
Константа скорости химической реакции, как правило, резко растет с повышением
температуры. Зависимость константы скорости реакции от температуры в большом числе случаев может быть описана уравнением
Аррениуса
 (2) (2)
где Т — абсолютная температура; k0 и Е — постоянные параметры.
Поскольку концентрация реагирующих веществ практически не зависит от
температуры, то такое же соотношение получается и для скорости процесса
 (3) (3)
где 
Относительное увеличение скорости реакции с температурой характеризуется
логарифмической производной υ по Т:
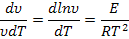 (4) (4)
Таким образом, чем больше Е, тем быстрее растет скорость реакции с температурой. Для
простых реакций параметр Е показывает, какой минимальной энергией (в расчете на один моль) должны обладать реагирующие
частицы, чтобы они могли вступить в химическую реакцию. Частицы, энергия которых больше или равна Е, называются активными,
а параметр Е в связи с этим называют энергией активации.
Для сложных реакций, состоящих из нескольких стадий, параметр Е в уравнении (2),
как правило, не имеет такого простого физического смысла и является некоторой функцией энергии активации отдельных стадий.
Тем не менее и в этом случае параметр. Е принято называть энергией активации, хотя правильнее было бы называть его
эффективной или эмпирической энергией активации.
Параметр k0 называется предэкспоненциальным множителем.
Параметры Е и k0 могут быть определены из зависимости константы скорости реакции
от температуры с помощью уравнения (2), записанного в виде
 (5) (5)
Литература
- Кондратьев В.Н. Константы скорости газофазных реакций. - М.: Наука, 1970, 351с.
- Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. - М.: Наука, 1971, 711с.
|