БОР-НЕЙТРОНОЗАХВАТНА ТЕРАПІЯ РАКУ
Батлук Н.С.
Донецький національний технічний університет, регіональна студентська конференція ФіНаТ-2005
Концепція нейтронозахватной терапії була запропонована G.L.Locher (Franklin Institute at Pennsylvania) в 1936 році, через 4 роки після відкриття нейтрона. Фізичний принцип простий і елегантний. Розчин, стабільний ізотоп, що містить, бор-10, вводиться в кров людини і через деякий час бор сорбирується в клітинах. Потім пухлина опромінюється потоком епітеплових нейтронів. В результаті захоплення теплового нейтрона стабільним ізотопом 10В відбувається ядерна реакція і утворюються енергетичні  -частинка, іон і в 94 % випадків -частинка, іон і в 94 % випадків  -квант. -квант.
Робота установки
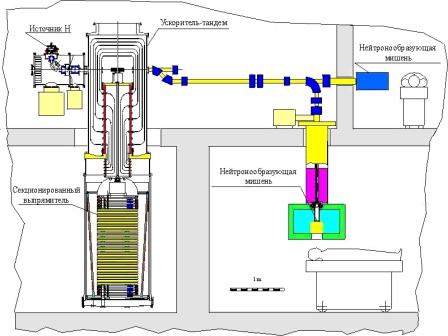
Можливий варіант установки для нейтронної терапії представлений на малюнку. Пучок негативних іонів водню інжектується в електростатичний прискорювач-тандем з вакуумною ізоляцією і після перезарядки негативного іона водню в протон в перезарядній мішені на виході з тандему формується протонний пучок, прискорений до подвоєної напруги високовольтного електроду. В результаті реакції 7Li (p,n) 7Be при скиданні інтенсивного протонного пучка на літієву мішень генерується потік нейтронів.
В звичайному, стандартному, даному режимі роботи при енергії протонів 2,5 МеВ нейтрони, що утворюються, мають широкий спектр енергій з максимумом при 790 кэВ. Придатний для БНЗТ нейтронний пучок формується за допомогою сповільнювачів, коллиматоров і відбивачів. Пацієнт звичайно розміщується на відстані не менше 0,5 метра від мішені після захисту.
Найпривабливіший режим роботи комплексу реалізується при енергії протонів 1,915 МеВ (на 34 кэВ вище за поріг реакції), коли завдяки кінематичній коллимації пучок нейтронів має добру спрямованість вперед і необхідний для БНЗТ спектр з середньою енергією 30 кэВ. Через дуже швидке зростання перетину поблизу порогу, що є особливістю цієї реакції, і через яскраво виражену спрямованість вперед потік вперед прямовикористаних епітепловых нейтронів всього на порядок менше потоку нейтронів вперед, народжених при енергії протонів 2,5 МеВ і мають широкий спектр енергій. В цьому режимі можливо розміщення пацієнта на відстані 10 см від мішені, що значно підвищує густину потоку нейтронів або знижує вимогу на струм.
Проаналізований наявний світовий досвід застосування різних типів прискорювачів як джерела нейтронів для дистанційної радіотерапії швидкими нейтронами. Оскільки для терапії швидкими нейтронами оптимальними є нейтрони з енергіями від 0,5 до 1,5 МеВ, то оптимальне джерело нейтронів реалізується скиданням 1 мА 2 МеВ дейтерієвого пучка на берилієву мішень. Створення такого джерела представляється більш простим, ніж для БНЗТ.
Вся установка розміщується в двоповерховій будівлі в чотирьох відокремлених один від одного приміщеннях. В одному з приміщень першого поверху розташовується високовольтне джерело напруги і основні могутні джерела живлення. Через отвір в стелі цього приміщення над високовольтним випрямлячем змонтований власне прискорювач-тандем, так що основна його частина - вакуумний бак з прохідним ізолятором, потенційними електродами і перезарядною мішенню - знаходяться на другому поверсі. В приміщенні другого поверху вісь інжектованого і прискореного пучка проходить на висоті порядку 1 м від підлоги. З одного боку прискорювача розташовується джерело негативних іонів водню з диференціальним вакуумним відкачуванням і оптичною системою транспортування пучка для інжекції в прискорювач. Після перезарядки прискорений до подвоєної енергії пучок (E = 2,5 МеВ) виходить з протилежної сторони тандему і системою паралельного перенесення зміщується в транспортний канал. Система паралельного перенесення здійснює сепарацію інтенсивного протонного пучка і слабкострумового пучка нейтралів, який може використовуватися як для контролю ефективності перезарядної мішені, так і для прецизійного вимірювання (після додаткового обдирання) енергії пучка з використанням спеціального поворотного магніта.
Транспортний канал направляє протонний пучок в два медичні приміщення (III, IV), розташовані на першому і другому поверхах, де здійснюється генерація терапевтичних нейтронних пучків в результаті скидання протонного пучка на нейтронотвірну мішень.
Фізичне значення процесу
Концепція нейтронозахватной терапії була запропонована G.L.Locher (Franklin Institute at Pennsylvania) в 1936 році, через 4 роки після відкриття нейтрона. Фізичний принцип простий і елегантний. Розчин, стабільний ізотоп, що містить, бор-10, вводиться в кров людини і через деякий час бор сорбирується в клітинах. Потім пухлина опромінюється потоком епітеплових нейтронів. В результаті захоплення теплового нейтрона стабільним ізотопом 10В відбувається ядерна реакція і утворюються енергетичні  -частинка, іон і в 94 % випадків -частинка, іон і в 94 % випадків  -квант. Малюнок нижче схематично ілюструє взаємодію нейтрона з ізотопом бору. -квант. Малюнок нижче схематично ілюструє взаємодію нейтрона з ізотопом бору.

Утворені  -частинка і іон 7Li швидко гальмуються і виділяють енергію 2,3 МеВ на довжині порядка 10 мікрон, тобто на довжині розміру клітини. Таке швидке гальмування і, відповідно, величезний локальний нагрів приводить до поразки саме тієї клітини, яка містила ядро бору. Тобто, якщо забезпечити більш високу концентрацію 10В в раковій клітині в порівнянні із здоровою, то борнейтронзахватна терапія дозволить здійснити вибіркову поразку ракової пухлини. -частинка і іон 7Li швидко гальмуються і виділяють енергію 2,3 МеВ на довжині порядка 10 мікрон, тобто на довжині розміру клітини. Таке швидке гальмування і, відповідно, величезний локальний нагрів приводить до поразки саме тієї клітини, яка містила ядро бору. Тобто, якщо забезпечити більш високу концентрацію 10В в раковій клітині в порівнянні із здоровою, то борнейтронзахватна терапія дозволить здійснити вибіркову поразку ракової пухлини.
Звичайно, є ще ряд ядер, які мають великий перетин захоплення нейтрона, але ядро 10В переважно із наступних причин. По-перше, цей ізотоп бору нерадіоактивний і легко доступний. Поширеність в природі ізотопу з масовим числам 10 складає приблизно 20 %. По-друге, утворені в результаті реакції енергетичні частинки швидко гальмуються і передають енергію. По-третє, довжина гальмування порядку розміру клітки. І, по-четверте, добре розуміння хімії бору дозволяє легко отримати безліч різних хімічних структур, що містять бор.
При опромінюванні тканини нейтронами крім ядерних реакцій, пов'язаних із захопленням нейтрона ядром бору, можливі і ядерні реакції 14N(n,p)14C і 1H(n, )2H, які приводять до появи протонів віддачі і )2H, які приводять до появи протонів віддачі і  -квантів. Хоча перетини захоплення нейтрона воднем і азотом на декілька порядків менше перетину захоплення нейтрона ізотопом 10В, але водень і азот присутній в такій великій концентрації, що це додаткове невиборче "фонове опромінювання" протонами віддачі і -квантів. Хоча перетини захоплення нейтрона воднем і азотом на декілька порядків менше перетину захоплення нейтрона ізотопом 10В, але водень і азот присутній в такій великій концентрації, що це додаткове невиборче "фонове опромінювання" протонами віддачі і  -квантами вносить значний внесок в поглинену дозу. Для того, щоб зменшити вплив цього "фонового опромінювання" необхідно забезпечити достатньо високу концентрацію бору в раковій пухлині. -квантами вносить значний внесок в поглинену дозу. Для того, щоб зменшити вплив цього "фонового опромінювання" необхідно забезпечити достатньо високу концентрацію бору в раковій пухлині.
В 1951 році Sweet з колегами вперше продемонстрував, що певне з'єднання з бором дозволяє отримати більш високу концентрацію бору в раковій пухлині в порівнянні із здоровою клітиною. Протягом 1950-60 рр. в Brookhaven National Laboratory і Massachusetts Institute Technology на спеціально побудованих медичних реакторах були проведені перші клінічні випробування, в яких застосовувалися теплові нейтрони і sodium borocaptate (Na210B12H11SH).На жаль, ці клінічні випробування не продемонстрували терапевтичну ефективність даного методу. Причина полягала в низькій концентрації бору, через що "фонове опромінювання" протонами віддачі і  -квантами в результаті реакцій 14N(n,p)14C и 1H(n, -квантами в результаті реакцій 14N(n,p)14C и 1H(n, )2H було достатньо велике. )2H було достатньо велике.
Не дивлячись на невдачу, японський нейрохірург Хатанака, який брав участь в клінічних випробуваннях в США, повернувшись до Японії в 1968 році продовжив розвиток цієї методики. Він трепанував череп, на відкритому мозку проводив хірургічну операцію, а потім опромінював пухлину пучком повільних нейтронів з енергією нижче за кімнатну температуру. Такою методикою декілька груп в Японії на різних реакторах пролікували більше 200 пацієнтів з дуже обнадійливими результатами.
Паралельно великий прогрес був досягнутий в синтезі фармпрепаратів, що містять ізотоп 10B. Отримані препарати, які створюють концентрацію ізотопу 10B в пухлинній тканині до 40 мкг/г, що в 3,5 рази більше, ніж в здоровій тканині. Така концентрація дозволяє зробити внесок фонового опромінювання достатньо малим і дійсно забезпечити можливість виборчої поразки ракової пухлини.
Досягнення Хатанаки і прогрес в синтезі фармпрепаратів привели до того, що в 1994 році поновилося лікування пацієнтів з гліобластомою мозку на реакторах в Брукхевені і Массачусетсі. В 1997 році клінічні випробування почалися в Голландії, в 1999 році - у Фінляндії. Зараз до цих робіт підключилися в Англії, Австралії, Аргентині, Італії, Німеччині, Швеції, Чехії, Росії і ін. країнах. Дуже обнадійливі результати отримані також при терапії меланоми. У стадії вивчення знаходиться бор-нейтронозахватна терапія раку порожнини рота, рака щитовидної залози і неонкологічне застосування - лікування ревматичного артриту.
Доцільність розвитку технології нейтронозахватної терапії обумовлена тим, що вона орієнтована на лікування таких видів злоякісних пухлин, які практично не піддаються ніяким іншим методам, - гліобластоми мозку і метастази меланоми. Так, щорічно приблизно 1 людина з кожних 20000 вражається гліобластомою мозку. Результат завжди фатальний і звичайно наступає через півроку. Хірургія або традиційна радіотерапія не зупиняють розповсюдження пухлини по всьому мозку і дозволяють хіба що продовжити життя на рік.
Прогрес бор-нейтронозахватної терапії в клінічних випробуваннях на реакторах і потенційна потрібність методики привели до інтенсивного обговорення питання розробки і створення нейтронного джерела на основі компактного і недорогого прискорювача, яким можна було б оснастити практично кожну онкологічну клініку. Були запропоновані прискорювальні системи, що відповідають основним вимогам нейтронозахватної терапії : електростатичні квадрупольні (ESQ), тандемні каскадні (TCA) і високочастотні квадрупольні (RFQ). Недоліком ESQ систем, про що свідчить багаторічний досвід обслуговування, є розташування джерела позитивних іонів водню під потенціалом 2,5 МВ. TCA системи володіють безперечною перевагою в тому, що іонне джерело розташоване під земляним потенціалом і потребує в два рази меншу напругу. Проте іонна оптика і конструкція прискорювальної трубки, що забезпечує необхідну швидкість відкачування і високовольтну міцність, обмежують проходження стаціонарного пучка 1 або 2 мА. Найпривабливішим з раніше перевірених прискорювачів є RFQ. RFQ система проста в роботі, має невисокі експлуатаційні витрати і іонне джерело розташовується під земляним потенціалом. Проте вона дуже дорога, і найбільший струм, отриманий до теперішнього часу, складає тільки декілька міліамперів.
Був необхідний новий підхід в прискорювальній концепції для отримання необхідного спектру і потоку епітеплових нейтронів у відносно компактній і недорогій системі. Новаторський підхід в концепції нейтронного джерела, запропонований нами в 1998 році, базується на використовуванні електростатичного тандемного прискорювача з вакуумною ізоляцією VITA (vacuum insulation tandem асcelerator) і припорогового режиму генерації нейтронів. Стаціонарний пучок негативних іонів водню інжектується в електростатичний прискорювач-тандем з вакуумною ізоляцією і після перезарядки негативних іонів водню в протони в перезарядній мішені на виході з тандему формується протонний пучок, прискорений до енергії, відповідної подвоєному потенціалу високовольтного електроду. При скиданні протонного пучка на літієву мішень в результаті порогової реакції 7Li (p,n) 7Be генерується потік нейтронів. Найпривабливіший новаторський режим генерації нейтронів реалізується при енергії протонів 1,889-1,9 МеВ, що на 10-20 кэВ вище за поріг реакції. В цьому випадку кінематично коллимірований вперед в конусі з кутом ~25| нейтронний пучок з середньою енергією 30 кэВ може бути прямо використаний для БНЗТ. В другому режимі при енергії протонів 2,5 МеВ нейтрони, що утворюються, мають складніший і широкий спектр аж до енергії 790 кэВ і можуть бути безпосередньо використаний для терапії швидкими нейтронами або для БНЗТ за допомогою сповільнювачів, коллиматорів і відбивачів. Відмітною особливістю всього проекту є отримання протонного пучка струмом в десятки міліамперів, забезпечуючого час експозиції в десятки хвилин для досягнення необхідної терапевтичної дози 20 Гр.
Реакція p + 6Li -> n + 7Be + Q
Q = -1,64461 МеВ
Дана ядерна реакція є пороговою. Тепловий ефект реакції або енергетичний вихід Q визначається масами частинок, що беруть участь в реакції:
Q = (mp + mLi - mn - mBe)c2.
Оскільки Q негативна величина, то в лабораторній системі координат, де Li покоїться, реакція відбувається лише тоді, коли кінетична енергія падаючого протона більше енергії порогу реакції
Et = |Q| (mp + mLi)/mLi = 1,88085 МэВ.
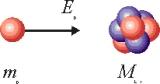
Розглянемо народження нейтронів при енергії протонів, що дорівнює Ep = 1,9 МеВ. Швидкість протонів в даному випадку рівна 1,9 107 м/с. На Мал. 1 схемно представлено початкове розташування протона і ядра літію в лабораторній системі координат.
Перейдемо в систему центру мас (Рис. 2).

Швидкість системи центру мас (швидкість ядра літію) рівна 2,4 106 м/с. В системі центру мас сума енергій протона і ядра літію перевищує поріг реакції Q на 17 кэВ
Ep + ELi - |Q| = 17 кэВ
Це означає, що взаємодіючі частинки долають дію розштовхуючої кулонівської сили і, зближуючись на відстань дії ядерних сил, мають ще надлишок енергії в 17 кэВ. В результаті ядерної реакції народжуються нейтрон і ядро берилія, сума кінетичних енергії яких складає величину 17 кэВ. На рис.3 показаний процес ядерної реакції в системі центру мас.
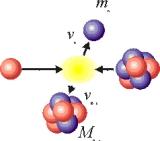
Народжений нейтрон із швидкістю 1,7 106 м/с вилітає, природно, під будь-яким кутом по відношенню до вектора швидкості протона.
Але давайте повернемося в лабораторну систему координат. Вектор швидкості нейтрона в лабораторній системі координат буде сумою вектора швидкості системи центру мас, рівної 2,4 106 м/с і направленої уздовж вектора швидкості падаючого протона, і вектора швидкості нейтрона в системі центру мас, рівній 1,7 106 м/с і направленої в будь-якому напрямі. Оскільки швидкість системи центру мас більше швидкості нейтрона в системі центру мас, то в лабораторній системі координат народжений нейтрон може летіти тільки вперед в деякому тілесному кутку. Характерні значення енергій і кутів нейтронів наступні. Якщо вектор швидкості нейтрона направлений уздовж вектора швидкості центру мас, то нейтрон летітиме строго вперед і матиме максимальну енергію, рівну 87 кэВ. Якщо ж вектор швидкості нейтрона направлений в протилежному напрямі вектора швидкості центру мас, то нейтрон летітиме строго вперед і матиме мінімальну енергію, рівну 2,5 кэВ. Максимальний кут, на який може відхилитися нейтрон по відношенню до напряму падаючого протона рівний 35 градусів.
Як інший приклад корисно знати граничний випадок, коли енергія протона рівна порогу реакції. В цьому випадку народжений відразу у порогу нейтрон летітиме строго вперед з енергією 29 кэВ.
Тут можна скористатися простою програмою для оцінки енергій і кутів. Акуратний рахунок енергетичного і просторового розподілу нейтронів
здійснюється групою В. М. Кононова (ФЕІ, Обнінськ). Саме Віктор Миколайович вперше в світі запропонував використовувати припорогову генерацію нейтронів для нейтронозахватної терапії. Це і є кінематична коллимація, яку бажано здійснити в даному проекті.
Переріз реакції
Найбільший з відомих перерізів ядерних реакцій 5х107 барн (0,5 ангстрем2) зміряно в експериментах по обстрілу ультрахолодними нейтронами ядер гадолінію (Gd). Великий переріз взаємодії ядер гадолінія з нейтронами раніше був передбачений теоретично. Переріз такий великий унаслідок існування у ядер гадолінія певної конфігурації енергетичних рівнів, що забезпечує резонанс, при цьому ядра гадолінія захоплювали нейтрони на відстані в 10 4 раз більшому їх діаметра . Експеримент проводився H. Rauch і його колегами у Віденському інституті атома. Мішенню для обстрілу був розчин гадолінія у важкій воді D2O. Нейтрони в пучку летіли із швидкістю Валерія Борзова - 10 м/с, що відповідає температурі близько 1 мК. Повільні нейтрони проводять більше часу біля ядра і тим самим мають більше шансів для взаємодії, тому зі зменшенням швидкості перетин реакції росте. При швидкості менше 4 м/с дослідники знайшли відхилення від передбаченого теоретично закону 1/v. Передбачається, що це відхилення обумовлено розрідженістю розчину гадолінія, так що на шляху нейтрона знаходилося в середньому менше одного ядра.
|