УДК 661.8, 678.02
Источник: H 34 Наукові праці Донецького національного технічного університету. Серія: Хімія і хімічна технологія / Гол. ред. Башков Є.О. - Донецьк: ДВНЗ «ДонНТУ», 2010. - Випуск 14(162) - 192 с.
Рассмотрены физико-химические основы процесса взаимодействия сероуглерода головной фракции сырого бензола с аммиаком. Изучено влияние температуры и мольного соотношения реагентов на степень извлечения сероуглерода из головной фракции. Показана возможность полного извлечения сероуглерода из головной фракции обработкой ее водным раствором аммиака.
Ключевые слова: головная фракция сырого бензола, сероуглерод, аммиак, автоклав.
Розглянуто фізико-хімічні основи процесу взаємодії сірковуглецю головної фракції сирого бензолу з аміаком. Досліджено вплив температури та мольного співвідношення реагентів на ступінь вилучення сірковуглецю з головної фракції. Показано можливість повного вилучення сірковуглецю з головної фракції обробкою її водним розчином аміаку.
Ключові слова: головна фракція сирого бензолу, сірковуглець, аміак, автоклав.
Во всех схемах переработки сырого бензола, получаемого при коксовании угольной шихты, важной технологической операцией является выделение сероуглеродной фракции (далее – головной фракции) [1,2].
Состав головной фракции зависит от условий ректификации и состава исходного сырого бензола. Головная фракция сырого бензола характеризуется следующими показателями [1]:
| Плотность при 20 °С, кг/м3 | 930-980 |
| Разгонка, °С: | |
| начало кипения | 30-38 |
| температура при отгонке 95% | 66-75 |
| Состав, %: | |
| сероуглерод | 20-30 |
| циклопентадиен + дициклопентадиен | 20-40 |
| непредельные соединения | 10-28 |
| насыщенные углеводороды | до 4,0 |
| бензол | 10-50 |
Близость температур кипения сероуглерода и циклопентадиена (42,5 и 46,5 °С) при примерно одинаковом их содержании весьма затрудняет выделение концентрированной сероуглеродной фракции только ректификацией.
В настоящее время в промышленности получил распространение способ переработки головной фракции методом термической полимеризации, основанный на свойстве циклопентадиена образовывать под действием нагрева дициклопентадиен с резко отличной от всех остальных компонентов фракции температурой кипения 170 °С [1,2].
Такой способ переработки головной фракции сырого бензола требует больших затрат времени и энергии, громоздкого оборудования, процесс сопровождается большими потерями сероуглерода.
Технический сероуглерод содержит значительное количество непредельных соединений, которые легко осмоляются и ухудшают его качество. Получение высококачественного сероуглерода требует повторной ректификации. Сероуглерод ядовит и легко воспламеняется. Выделение его из головной фракции в свободном виде сопряжено с пожаро- и взрывоопасностью.
В свете вышеизложенного представляется актуальной разработка новых методов переработки сероуглеродной фракции сырого бензола.
В настоящей статье представлены результаты по исследованию в лабораторных условиях способа извлечения сероуглерода из головной фракции путем связывания его химическим реагентом с получением ценных химических продуктов, безопасных при использовании, хранении и транспортировке.
В качестве реагента для извлечения сероуглерода из головной фракции был испытан водный раствор аммиака. Выбор аммиака обусловлен тем, что он является относительно недорогим и доступным. Кроме того, аммиак может избирательно взаимодействовать с сероуглеродом головной фракции. Получаемые при взаимодействии сероуглерода с аммиаком соединения могут быть использованы для производства важных и ценных химических продуктов.
Применение аммиака не требует специального оборудования, высоких температур и дорогих катализаторов. Другое преимущество данного процесса – высокая скорость взаимодействия при обычных условиях и легкость отделения в виде водных растворов соединений сероуглерода с аммиаком.
В зависимости от температуры химизм процесса взаимодействия сероуглерода с аммиаком может быть представлен следующими реакциями [3-5]:
Схема 1, t ≥ 120°C
S
медл. ||
S=C=S + NH2−H ↔ H2N−C−SH (1)
дитиокарбаминовая кислота
S S
|| швидк. ||
NH3 + H2N−C−S−H ↔ H2N−C−S−NH4 (2)
дитиокарбаминат аммония
S S
|| ||
H2N−C−S NH4 → H2N−C−NH2 + H2S (3)
тиомочевина
_______________________________________
> 120 0С
CS2 + 2NH3→ H2NC(S)NH2 + H2S (4)
тиомочевина
Cхема 2, t=113°C
S
медл. ||
S=C=S + NH2−H ↔ H2N−C−SH (5)
H2N−C−SH ↔ HN=C=S + H2S (6)
роданистоводородная кислота
NH2−H + HN=C=S → NH4S−C≡N (7)
роданид аммония
__________________________________________
< 120 0С
S=C=S + NH2−H → NH4S−C≡N + H2S (8)
Схема 3. Изомеризация роданида аммония в тиомочевину, t ≥ 160°C
S
||
NH4S−C≡N → H2N−C−NH2 + H2S (9)
тиомочевина
В соответствии с представленными реакциями при взаимодействии сероуглерода с аммиаком можно получить роданид аммония, тиомочевину, соли дитиокарбаминовой кислоты.
Кислотное разложение дитиокарбамината аммония, которое реализуется в обычных условиях, позволяет регенерировать сероуглерод.
S
|| - +
H2N−C−SNH4 + H2SO4 → (NH4)2 SO4 + CS2 (10)
Таким образом, представляется возможным реализация технологии производства чистого сероуглерода из головной фракции в виде готового продукта.
Очищенный сероуглерод является сырьем для производства вискозного волокна, ксантогенатов и др. [2,6].
В настоящее время промышленный органический синтез сероорганических соединений основан на применении сероуглерода или тиомочевины и ее производных. Применение роданистого аммония взамен токсичного и взрывоопасного сероуглерода позволит расширить ассортимент сероорганических продуктов, таких как замещенные тиомочевины, этилен- и пропилентиомочевины и др. Роданистоводородная кислота способна легко изомеризоваться в весьма реакционноспособную изотиоциановую кислоту, которая легко вступает в реакции присоединения с ненасыщенными соединениями, аминами. Соли ее легко алкилируются, образуя при этом роданоорганические соединения или реакционноспособные изотиоцианаты.
Основной задачей на данном этапе исследований ставилось извлечение сероуглерода из головной фракции. Поскольку взаимодействие сероуглерода и аммиака протекает через ряд последовательных стадий и зависит от условий проведения процесса, необходимо было определить влияние соотношения реагентов и температуры на степень извлечения сероуглерода из головной фракции.
В лабораторных условиях была проведена серия экспериментов, в которой использовалась головная фракция следующего состава, % (масс.):
Исследования проводили в автоклаве в температурном интервале 80-150 °С, куда помещали смесь головной фракции и водного раствора аммиака.
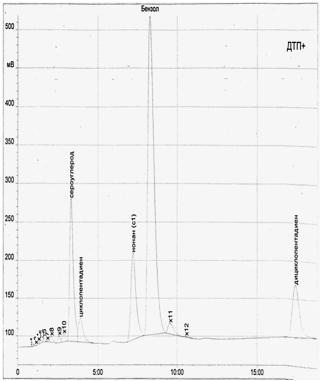
Компонентный состав головной фракции до и после взаимодействия определяли хроматографическим методом. Хроматограммы представлены на рис.1 и рис.2.

Рисунок 1 – Хроматограма головной фракции сырого бензола перед экспериментом
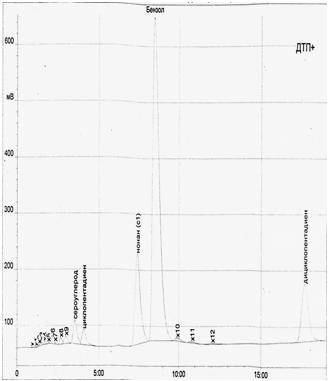
Рисунок 2 – Хроматограма головной фракции сырого бензола после эксперимента
Аммиак использовали в виде водного раствора с концентрацией NH3 – 25 %, плотностью 0,910 г/см3 (15 °С), парциальное давление паров аммиака 0,1 МПа (40 °С).
Так как температура кипения сероуглерода 42 °С, а водный раствор аммиака имеет высокое парциальное давление, очевидно, что взаимодействие между CS2 и NH3 в интервале температур 80-150 °С протекает в газовой фазе. Давление, создаваемое в автоклаве, благоприятно влияет на реакции 4,8, т.к. они идут в газовой среде с уменьшением числа молей компонентов системы и сопровождаются поглощением образующихся продуктов (дитиокарбаминат аммония, тиомочевина, роданид аммония) водной фазой.
На рис.3 представлены результаты экспериментальных исследований зависимости степени извлечения CS2 из головной фракции от мольного соотношения NH3 : CS2. Из полученных данных видно, что при изменении соотношения NH3 : CS2 с 2:1 до 7:1 степень извлечения сероуглерода увеличивается с 77,3 % до 99,8 %. При стехиометрическом соотношении NH3: CS2 = 2:1 степень извлечения CS2 составляет 77,3 %. Образующийся по реакциям 4,8 сероводород взаимодействует с аммиаком по схеме:
H2S + NH3→ NH4HS (11)
NH4HS + NH3 → (NH4)2S (12)
________________________________________________
H2S + 2NH3 → (NH4)2S (13)
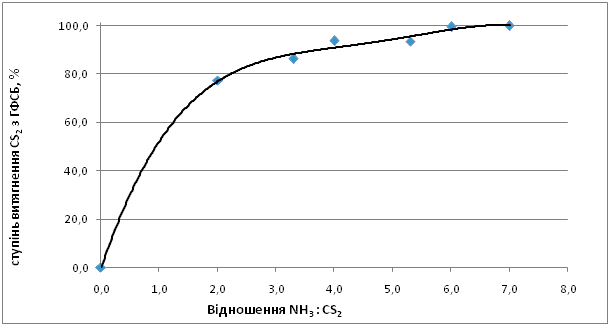
Рисунок 3 – Зависимость степени извлечения CS2 из ГФСБ от изменения
соотношения NH3 : CS2
Температура t = 120 0С, время выдержки τ = 3 ч.
Возрастание избытка аммиака способствует увеличению степени извлечения сероуглерода до 93,6 % (NH3 : CS2 = 4:1) и достигает значения 99,5 при соотношении NH3 : CS2 = 6:1.
Суммарное уравнение химической реакции при избытке NH3 может быть представлено в следующем виде:
S
||
CS2 + 4NH3 → H2N−C−NH2 + (NH4)2S (14)
CS2 + 4NH3 → NH4SCN + (NH4)2S (15)
Данные по влиянию температуры на процесс представлены на рис.4.
Анализ полученных данных показал, что при увеличении температуры с 85 до 150 °С степень извлечения сероуглерода возрастает с 75,5 до 98 % (соотношение NH3 : CS2 = 5:1). При температуре 115 °С достигается практически полное извлечение сероуглерода из органической фазы в водную фазу в форме роданистых соединений (при соотношении NH3 : CS2 = 7:1). После 115 °С изменение степени извлечения от температуры носит затухающий характер.
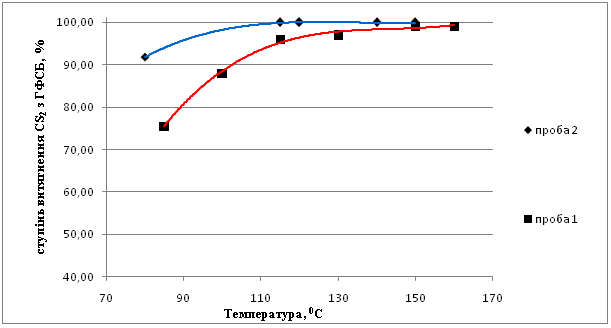
Рисунок 4 – Зависимость степени извлечения CS2 от температуры
проба 1: мольное соотношение NH3 : CS2 = 5:1, время выдержки τ = 3 ч;
проба 2: мольное соотношение NH3 : CS2 = 7:1, время выдержки τ = 3 ч.
Для выяснения механизма протекания химической реакции взаимодействия сероуглерода с аммиаком проанализировали водную фазу на содержание роданистого аммония и органическую фазу на содержание сероуглерода.
Кинетические кривые степени извлечения сероуглерода и степени его превращения в роданистый аммоний представлены на рис.5.

Рисунок 5 – Кинетические кривые степени извлечения сероуглерода из головной
фракции (I) и степени превращения сероуглерода в роданистый аммоний (II)
при соотношении CS2 : NH3 = 5:1, t = 115 0С
По кинетическим кривым можно сделать вывод, что взаимодействие сероуглерода и аммиака при t = 115 °С идет преимущественно по схеме 2 (реакция 8), так как степень превращения CS2 → NH4SCN составляет 87 % от степени извлечения сероуглерода из головной фракции. Однако, можно предположить, что параллельно наблюдается и превращение сероуглерода по схеме 1.
Выводы
Экспериментальные исследования процесса извлечения сероуглерода из головной фракции сырого бензола водным раствором аммиака показали, что процесс протекает через ряд последовательных стадий. По кинетическим кривым определено, что взаимодействие сероуглерода и аммиака при температуре 115 оС идет преимущественно с образованием роданида аммония. Установлено, что при мольном соотношении NH3 : CS2 = 7:1 достигается практически полное извлечение сероуглерода из органической фазы в водную в форме роданистых соединений.
Литература
© Крутько И.Г., Кипря А.В., Колбаса В.А., Комаров А.С., Сацюк К.А., 2010
Поступила в редакцию 21.10.2009 г.