Источник: Вісник Національного технічного університету "Харківський політехнічний інститут". Збірник наукових праць. Тематичний випуск "Хімія, хімічна технологія та екологія". - Харків: НТУ "ХПІ". - 2010. № 11. - 180 с.
В статті розглянуто фізико-хімічні основи процесу взаємодії сірковуглецю головної фракції сирого бензолу з аміаком. Досліджено вплив температури та мольного співвідношення реагентів на ступінь вилучення сірковуглецю з головної фракції. Показано можливість повного вилучення сірковуглецю з головної фракції обробкою її водним розчином аміаку.
Physicochemical basis of carbon disulphide from crude benzene head fraction interaction with ammonia were considered. The effect of temperature and molar ratio of reagents on extraction degree of carbon disulphide from head faction was studied. The possibility of carbon disulphide complete removal from head faction by processing an aqueous solution of ammonia was shown.
Сырой бензол, получаемый в процессе коксования каменных углей, сам по себе не находит практического применения и подвергается дальнейшей переработке для получения чистых продуктов. Схема переработки сырого бензола включает стадию предварительной ректификации, обеспечивающую отделение низкокипящих и высококипящих сернистых и непредельных соединений. Получаемая при этом смесь низкокипящих компонентов, называемая головной, или сероуглеродной фракцией содержит 25 – 45 % сероуглерода, 15 – 25 % циклопентадиена, и 15 – 35 % бензола. Выход головной фракции составляет 2,0 – 3,5 %. [1,2].
Сероуглерод и циклопентадиен обладают близкими температурами кипения (42,5 и 46,5 °С соответственно) поэтому их практически невозможно разделить только ректификацией.
В настоящее время в промышленности переработку головной фракции ведут методом термической полимеризации, основанным на свойстве циклопентадиена образовывать под действием нагрева дициклопентадиен с намного более высокой, чем у всех остальных компонентов фракции температурой кипения 166,6°С [1, 2].
Такой способ переработки головной фракции сырого бензола требует громоздкого оборудования, больших затрат времени и энергии. Процесс сопровождается большими (до 30%) потерями сероуглерода, бензола, циклопентадиена, сырьем для получения которых является в данном случае каменный уголь – невозобновляемый источник энергии. Упомянутые вещества являются весьма токсичными, попадая в атмосферу, они наносят вред окружающей среде. Таким образом, безвозвратные потери энергии и ресурсов сопровождаются ухудшением экологической обстановки. Выделение сероуглерода из головной фракции в свободном виде сопряжено с пожаро- и взрывоопасностью [1, 2].
В свете вышеизложенного представляется актуальной разработка новых методов переработки сероуглеродной фракции сырого бензола.
В настоящей статье представлены результаты по исследованию в лабораторных условиях способа извлечения сероуглерода из головной фракции путем связывания его химическим реагентом с получением ценных химических продуктов, безопасных при использовании, хранении и транспортировке.
В качестве реагента для извлечения сероуглерода из головной фракции был испытан водный раствор аммиака. Выбор аммиака обусловлен тем, что он является относительно недорогим и доступным. В зависимости от температуры химизм процесса взаимодействия сероуглерода с аммиаком может быть представлен следующими реакциями [3–5]:
Применение аммиака не требует специального оборудования, высоких температур и дорогих катализаторов. Другое преимущество данного процесса – высокая скорость взаимодействия при обычных условиях и легкость отделения в виде водных растворов соединений сероуглерода с аммиаком.
В зависимости от температуры химизм процесса взаимодействия сероуглерода с аммиаком может быть представлен следующими реакциями [3-5]:
t ≥ 120 °C
CS2 + 2NH3→ H2NC(S)NH2 + H2S (1)
тиомочевина
t > 120 °C
S=C=S + NH2−H → NH4S−C≡N + H2S (2)
роданид аммония
Изомеризация роданида аммония в тиомочевину, t ≥ 160 °C
S
||
NH4S−C≡N → H2N−C−NH2 + H2S (3)
тиомочевина
Основной задачей на данном этапе исследований ставилось извлечение сероуглерода из головной фракции. Было изучено влияние соотношения реагентов, температуры и времени контакта реагентов на степень извлечения сероуглерода из головной фракции.
В лабораторных условиях была проведена серия экспериментов, в которой использовалась головная фракция следующего состава, % (масс.):
Компонентный состав головной фракции до и после взаимодействия определяли хроматографическим методом. Аммиак использовали в виде водного раствора с концентрацией NH3 – 25 %, плотностью 0,910 г/см3 (15 °С).
Первые опыты показали, что реакция аммиака с сероуглеродом при комнатной температуре (20–25 °C) в реакторе с мешалкой протекает чрезвычайно медленно, а повышение температуры приводит к большим потерям из-за высокой летучести компонентов реакционной смеси. Поэтому реакцию проводили в герметичном автоклаве, куда помещали смесь головной фракции и водного раствора аммиака, при температуре 80–150 °С.
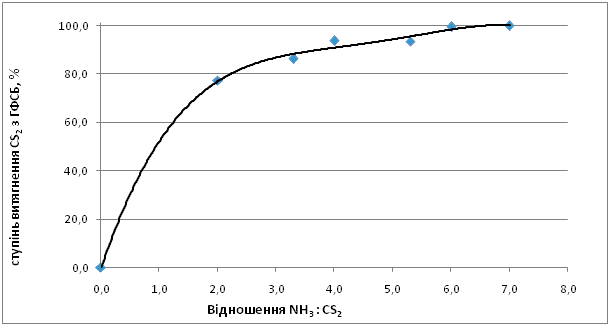
На рис.1 представлены результаты экспериментальных исследований зависимости степени извлечения CS2 из головной фракции от мольного соотношения NH3 : CS2. Из полученных данных видно, что при изменении соотношения NH3 : CS2 с 2:1 до 7:1 степень извлечения сероуглерода увеличивается с 77,3 % до 99,8 %. При стехиометрическом соотношении NH3 : CS2 = 2:1 степень извлечения CS2 составляет 77,3 %.

Рис.1. Зависимость степени извлечения СS2 от соотношения NH3 : CS2.
Температура 120 °С, время выдержки 3 ч.
Образующийся по реакциям 1 и 2 сероводород взаимодействует с аммиаком по схеме 4, что приводит к дополнительному расходу аммиака:
H2S + 2NH3 → (NH4)2S (4)
Возрастание избытка аммиака способствует увеличению степени извлечения сероуглерода до 93,6 % (NH3 : CS2 = 4:1) и достигает значения 99,5 % при соотношении NH3 : CS2 = 6:1.
Данные по влиянию температуры на процесс представлены на рис.2.
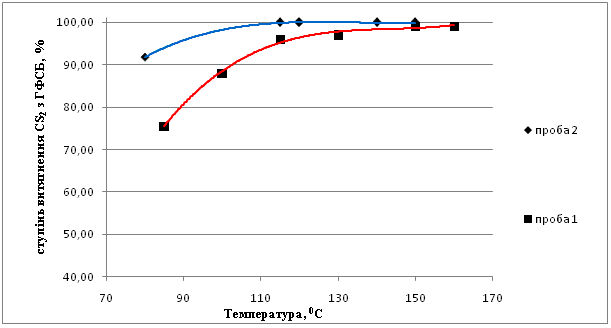
Рис.2. Зависимость степени извлечения сероуглерода от температуры.
1 – соотношение NH3 : CS2 = 5:1, 2 - соотношение NH3 : CS2 = 7:1
Анализ полученных данных показал, что при увеличении температуры с 85 до 150 °С степень извлечения сероуглерода возрастает с 75,5 до 98 % (соотношение NH2 : CS2 = 5:1). При температуре 115 °С достигается практически полное извлечение сероуглерода из органической фазы в водную в форме роданистых соединений (при соотношении NH2 : CS2 = 7:1).
Кинетические кривые степени извлечения сероуглерода и степени его превращения в роданистый аммоний представлены на рис.3 По кинетическим кривым можно сделать вывод, что взаимодействие сероуглерода и аммиака при t = 115 °С идет преимущественно с образованием роданида аммония, так как степень превращения CS2 в NH4SCN составляет 87 % от степени извлечения сероуглерода из головной фракции.

Рис.3. Кинетические кривые степени извлечения сероуглерода из головной
фракции(I) и
степени превращения сероуглерода в роданистый аммоний (II)
при соотношении CS2 : NH3 = 5:1, t = 115 0С
Выводы. Показана возможность извлечения сероуглерода из головной фракции сырого бензола обработкой ее водным раствором аммиака. По кинетическим кривым определено, что взаимодействие сероуглерода и аммиака при температуре 115 0С идет преимущественно с образованием роданида аммония. Установлено, что при мольном соотношении NH3 : CS2 = 7:1 достигается практически полное извлечение сероуглерода из органической фазы в водную в форме роданистых соединений.
Список литературы: 1.Лейбович Р.Е. Технология коксохимического производства / Лейбович Р.Е., Яковлева Е.И., Филатов А.Б.– М: Металлургия, 1982. – 360 с. 2.Коляндр Л.Я. Новые способы переработки сырого бензола / Коляндр Л.Я. – М.: Металлургия, 1976 – 192 с. 3.Химическая энциклопедия: в 5 т. / [ ред. Зефиров Н.С. ].– М.: Большая Российская энциклопедия, Т.4.– 1995 – 639 с. 4.Губен И. Методы органической химии: в 4 т./ Губен И. – М: ОНТИ, Т.ІІІ, вып.3.– 1935 – 628 с. 5.Кульберг Л.М. Синтезы органических реактивов для неорганического анализа / Кульберг Л.М. – М: Госхимиздат, 1947 – 165 с.
© Крутько И.Г., Кипря А.В., Колбаса В.А., Комаров А.С., Сацюк К.А., 2010
Поступила в редакцию 15.03.2010 г.