
Корниенко Юлия Александровна
Факультет экологии и химической технологии
Кафедра химической технологии топлива
Специальность: Химическая технология топлива и углеродистых материалов
Тема выпускной работы:
Взаимодействие карбазола со щелочью в гетерогенном процессе
Научные руководители: Бутузова Людмила Федоровна, Фролова Ирина Борисовна
Реферат по теме выпускной работы
План
Введение
Актуальность темы
Литературный обзор
Проведение эксперимента
Научная новизна
Практическое значение полученных результатов
Полученные результаты
Заключение
Список литературы
Введение
Каменноугольные смолы обладают огромными ресурсами ценнейших продуктов. К таким веществам в первую очередь относят карбазол, антрацен и фенантрен, общее содержание которых в смоле составляет 7-8%. Эти вещества сосредоточены в основном в сыром антрацене, выделяемом в процессе кристаллизации антраценовой фракции, получаемой при первичной разгонке смолы.
Актуальность темы: Карбазол может быть выделен из антраценовой фракции в чистом виде. Это имеет большое практическое значение, так как карбазол находит широкое применение в производстве поливинилкарбазола, который применяют в производстве электрографических материалов. Модификация карбазолом инден-кумароновых смол повышает их качество. Карбазол является исходным сырьем для производства ценного красителя - гидронового синего (прочнее индиго), сернистых красителей цвета хаки. Карбазол служит для получения тетранитрокарбазола (нирозан) - эффективный инсектицид. На основе карбазола может быть получен винилкарбазол, полимеризация которого приводит к получению ценных теплостойких пластмасс. Перспективной сферой использования карбазола является образование на его основе материалов для бессеребрянных светочувствительных слоев, где карбазол необходим в небольшом количестве, но высокой чистоты. А реакция образования карбазолята калия лежит в основе выделения чистого карбазола из антраценовых фракций. Эта реакция и явилась объектом исследования.
Литературный обзор
Выделение карбазола из антраценовой фракции может производиться следующими методами: физические и химические.
К традиционным физическим методам относят ректификацию и экстракцию.
Ректификация смесей полициклических ароматических углеводородов – один из наиболее простых и эффективных средств их разделения. Ее особенность определяется высокими температурами кипения и высокими температурами кристаллизации полициклических ароматических углеводородов. Это создает трудности, которые связаны с подводом тепла высоких параметров для обогрева низа колонны, опасностью осмоления и коксования в нижней части аппарата, выбором соответствующей системы конденсации (охлаждение горячим маслом или водой, которая кипит под давлением). Ректификация в вакууме повышает эффективность разделения и снижает опасность осмоления сырья, но в то же время сближает температуры конденсации и кристаллизации, которые усложняют проведение процесса. Усложняет ректификацию и возгонка полициклических ароматических углеводородов, которая приводит к забиванию коммуникаций, "воздушников", вентиляционных систем.
Кристаллизацию и растворение можно использовать для разделения благодаря разной растворимости близкокипящих полициклических ароматических углеводородов. Высокие температуры плавления ряда веществ облегчают отделение низкокипящих примесей и получение чистых веществ. Поэтому для очищения широко используют перекристаллизацию, кристаллизацию вместе с прессованием для отделения жидких веществ, кристаллизацию - плавление, кристаллизацию с добавлением растворителя, который смещает равновесие системы. В связи со значительными различиями в растворимости компонентов, которые входят в смесь кристаллов, часто используют экстрактивное растворение легкорастворимых компонентов. Общим недостатком этой группы методов является невысокая селективность разделения, которая обусловлена сопряженною растворимостью.
Применяя кристаллизационные методы, не удается обеспечить хорошее очищение низкоплавких веществ, так как они не освобождаются от примесей компонентов с высокой температурой кристаллизации [1]. Небольшие количества продуктов высокой степени очистки образовываются при использовании метода зонной плавки, который успешно применяется для очищения антрацена, фенантрена, нафталина и многих других полициклических ароматических углеводородов.
Химические методы разделения, как правило, связаны с большими затратами, чем физические. Приходится утилизировать отходы производства, включая неорганические материалы, которые нелегко утилизируются. К ним можно отнести следующие:
Методы, которые основаны на разности в скоростях сульфирования трудноразделяемых компонентов, и вдобавок более реакционноспособные соединения переводятся у сульфокислоты и выводятся из системы. Недостаток их состоит в необходимости изобретать пути утилизации больших объемов отработанной серной кислоты и сульфокислот, а также в невысокой селективности процесса.
Методы выделения примесей гетероциклических соединений, которые основаны на особенностях взаимодействия их с расплавами едкого кали. При этом азотосодержащие соединения (такие, как карбазол и индол) образовывают соли калия, которые растворимы в расплаве щелочи, и которые добываются из углеводородного слоя с выходом близким количественному [2,с.239]; [3с.368 сл.]. Соединения ряда дифенилоксида (дибензфурана) в таких условиях гидролизуются, образовывая дифенолы [4]. Если потребность в дифенолах отсутствует, то при нагревании за счет дегидратации можно получить исходные вещества. С помощью этих методов из смесей углеводородов выводятся кислородсодержащие гетероциклические соединения, и вдобавок к чистоте исходного сырья не предъявляют особых требований. Недостатками этих методов оказывается необходимость работы при высоких температурах (до 400 - 450°С), большая затрата щелочи, которую тяжело утилизировать, сильная коррозия аппаратуры, технические трудности при работе по расплавами щелочей.
Методы, которые основаны на большой реакционной способности линеарных полициклических ароматических углеводородов. Антрацен и ему подобные соединения образовывают с диенофилами (например, малеиновым ангидридом) продукты диенового синтеза (аддукты), что разрешает количественно выделять линеарные полициклические ароматические углеводороды из смесей с ангулярными [5]. Таким образом, выделяется антрацен и ряд более сложных соединений, таких, как тетрафен, дибензантрацены, 3,4-бензтетрафен, пентафен, 3,4,8,9-дибензтетрафен [6,7,с.194]. При нагревании водного раствора аддукта выделяется углеводород, а малеиновый ангидрид регенерируется при выпаривании полученной малеиновой кислоты и дегидратации последней. Метод имеет высокую селективность. Но при небольших масштабах производства приходится считаться с неэкономичностью регенерации дорогого и дефицитного малеинового ангидрида, а также значительной коррозией [8].
Методы, которые основаны на разной способности ароматических полициклических углеводородов к комплексообразованию. Неравномерность распределения электронной плотности в молекулах полициклических ароматических углеводородов дает возможность получить донороно-акцепторное взаимодействие их с разными комплексообразователями. Разность в стабильности комплексов разрешает, например, получать 1-метилнафталин из смеси с 2-метлнафталином, антрацен из смеси с карбазолом и фенатреном, пирен из смеси с флуорантеном (комплексообразователь трихлорид сурьмы). Вещества чистотой до 99% удается получить при использовании в качестве комплексообразователей пиромелитового диангидрида и нитробензойной кислоты [9]. Преимуществом метода является высокая чистота полученных продуктов и сравнительно высокая селективность. Недостатки метода сводятся к многостадийности, использованию дефицитных и дорогих комплексообразователей, сложность регенерации комплексообразователей и растворителей, которые применяются в данном процессе [10].
Для сравнения возможностей очищения разными методами приведены данные в таблице 1 по содержимому полициклических ароматических углеводородов.
Таблица 1- Содержимое полициклических ароматических углеводородов при разных методах очищения [11].
|
*к 90-95% при многоразовом растворении.
**малоэффективная при очищении от примесей веществ с высокой температурой плавления.
***степень добычи.
****при степени добычи 80-98%.
Проведение эксперимента
В Институте физико-органической химии и углехимии им. Литвиненко Л. М. НАН Украины реакция карбазола со щелочью проводилась в гетерогенных условиях. Для проведения эксперимента необходимо взвесить предварительно рассчитанные количества карбазола и щелочи в заданном соотношении. Щелочь нужно поместить в капсулу для предупреждения контакта с воздухом.
Эксперимент проводили в круглодонной двухгорлой колбе емкостью 250 см3 , которая оборудована стеклянным обратным холодильником и фторопластовым якорным смесителем. Обратный холодильник служил одновременно и для фиксирования смесителя. Нагрев осуществлялся с помощью масляной бани. Температура бани на протяжении всего эксперимента поддерживалась на уровне 120 – 125°С.
Загрузку реактивов велели в следующей последовательности: карбазол, растворитель – при комнатной температуре, а при достижении температуры 110°С в колбу вносили щелочь, помещенную в капсулу из фторопласта, одновременно включая секундомер. Момент внесения щелочи считали началом реакции. Процесс проводили при температуре кипения растворителя и без удаления воды из реакционной массы. Скорость размешивания (~800 1/мин) обеспечивала прохождение реакции в кинетической области.
Отбор проб проводили через 5, 15, 30, 45, 60, 120, 180 минут после начала реакции. Пробы отбирали с помощью специального пробоотборника (стеклянная трубка диаметром 4 мм с впаянной в ее торец пористой стеклянной пластинкой). Отбор проб проводили при отключенном смесителе и отводе обогрева. Анализ проб осуществляли спектрофотометрическим методом [12].
Научная новизна: Переход от плава в раствор, перенесение реакции в органическую фазу. При этом снижается температура проведения реакции с 250-400°С до 110°С и уменьшается время протекания реакции с 6-8 часов до 2 часов.
Практическое значение полученных результатов: Недостатками метода щелочного плава являются необходимость работы при высоких температурах, большой расход щелочи, который тяжело утилизировать, сильная коррозия аппаратуры, технические трудности при работе с расплавами щелочей. Метод, исследуемый в данной магистерской работе, позволяет заменить щелочной плав на гетерогенный процесс, что позволит применять его в лабораторних и промышленных условиях.
Полученные результаты
Таблица 1– Зависимость оптической плотности от времени при соотношении карбазол : щелочь=1:2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 2– Зависимость оптической плотности от времени при соотношении карбазол : щелочь=1:4
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 3 – Зависимость оптической плотности от времени при соотношении карбазол : щелочь=1:10
| |||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 4 – Зависимость оптической плотности от времени при соотношении карбазол : щелочь=1:11
| |||||||||||||||||||||||||||||||||||||||||
Таблица 5 – Зависимость оптической плотности от времени при соотношении карбазол : щелочь=1:12
| |||||||||||||||||||||||||||||||||||||||||

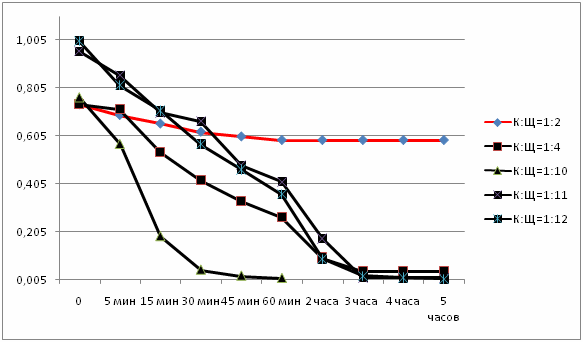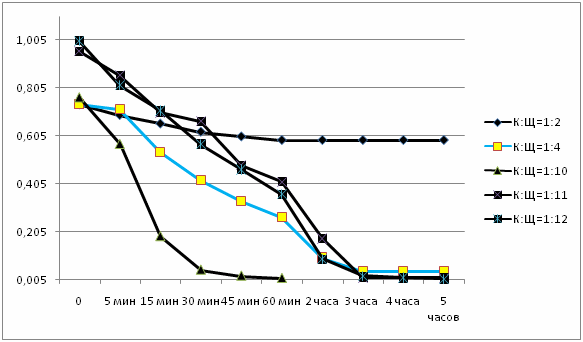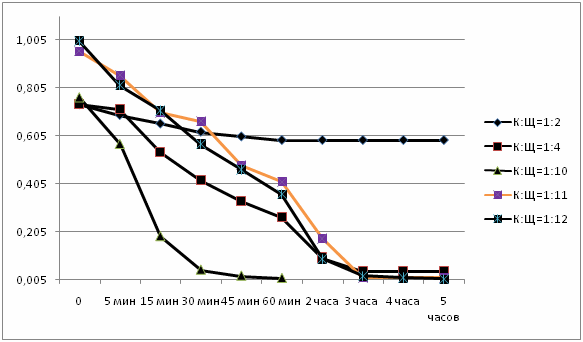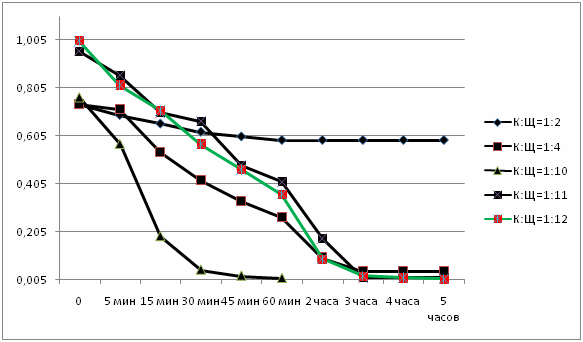
Рисунок 1 - Графическое отображение результатов, приведенных в таблицах (5 кадров, 7 повторений, размер 59,4 KB, сделано в MP Gif Animator)
Заключение
По итогам проделанной работы можно сделать следующие выводы:
Карбазол является исходным сырьем для производства многих ценных продуктов;
Реакция образования карбазолята калия лежит в основе выделения чистого карбазола из антраценовых фракций;
По таблицам и графикам видно, что чем больше количество щелочи, тем быстрее проходит реакция, тем больше начальная скорость химической реакции и степень ее прохождения.
Преимуществами проведения процесса в гетерогенных условиях в среде растворителя по сравнению с щелочным плавом являются:
Снижение температуры реакции до 110°С по сравнению с 240°С при щелочным плавом;
Сокращено время реакции: 2 часа вместо 8 часов.
На данный момент работа над магистерской диссертацией еще не закончена. Окончательное завершение декабрь 2010 г. Полный текст работы и материалы по теме могут быть получены у автора или у его руководителя.
Список литературы
Гуревич Б. С., Сизова Е. М., Исаенко М. М. – Кокс и химия, 1977, №1, С. 36 – 38.
Брон Я. А. Переработка каменноугольной смолы. – М.: Металлургия, 1963 – 272с.
Химические продукты коксования углей Востока СССР. Свердловск, Среднеуральское кн.. изд., 1965. Вып 3.
Пистрова П. Д., Харлампович Г. Д., Беднов В. М. – Химия твердого топлива, 1973, №2, с. 140 – 143.
Lang K. – Ang. Chem., 1951, Bd. 63, № 15, S. 345 – 349.
Полякова И. М. – Кокс и химия, 1938, № 2 – 3, с. 75 – 81.
Клар Э. Полициклические углеводороды. Пер. С англ.. В. В. Ершова – М.: Химия, 1971 – т. 1, 455с.
Литвиненко М. С. и др. – Кокс и химия, 1976, №3, с. 33 – 36.
Кузнецова Л. С. и др. – Кокс и химия, 1978, №1, с. 38 – 40.
Соколов В. З., Харлампович Г. Д. Производство и использование ароматических углеводородов – М: Химия, 1980. – 334с.
© ДонНТУ Корниенко Ю. А., 2010
ДонНТУ > Портал магистров ДонНТУ > Об авторе | Библиотека | Ссылки| Отчет о поиске | | Бальные танцы