Алгоритм сегментации водоразделом для анализа медицинских конфокальных изображений in vivo для ранней диагностики рака
Авторы: Man Kin Derek Ho
Автор перевода: Цыбулька Е.С.
Источник: 2007 REU Research Accomplishments, pp. 16-17
Аннотация
Данный проект успешно продемонстрировал технологию автоматизированной сегментации изображений для преодоления артефактов на изображениях in vivo в режиме реального времени, обеспечивающую точный анализ размеров ядер, плотности, ядерно-цитоплазматического соотношения, критических маркеров эпителиальных предраковых заболеваний. Алгоритм впервые был настроен с помощью изображений микрофлюидальных капель, а затем был применен на конфокальных изображениях тканей полости рта. Все изображения были успешно сегментированы и обеспечили точный подсчет (95% со стандартным отклонением 6.2%) клеток или капель.
Введение
Рак – это серьезная глобальная проблема здравоохранения, насчитывающая более 6.5 миллионов смертей ежегодно. Хотя многие считают его болезнью развитых стран, 60% случаев заболевания раком приходится на развивающиеся страны, в которых низкие медицинские расходы на душу населения, ненадежная инфраструктура и передовые технологии диагностики раковых заболеваний недоступны. Исходя из этих факторов, мы создали недорогую портативную микроэлектромеханическую систему, основанную на конфокальной микроскопии in vivo для субклеточных изображений тканей для раннего выявления
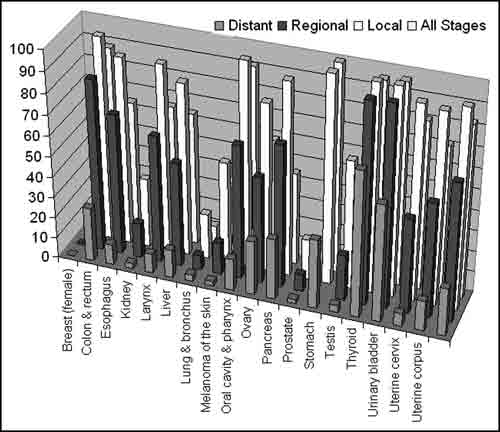
Рисунок 1. Статистика выживаемости людей при диагностике рака на различных стадиях
эпителиальных предраковых заболеваний, 85% из которых переходят в злокачественные. В настоящее время, эндоскопические процедуры проводятся для получения образцов биопсии и изображений, сегментированных вручную для начального тестирования предраковых заболеваний. Однако, это приводит к большим затратам времени, это дорого стоит, а также мы можем получить расхождения между различными методами сегментации и неудобство для пациентов. Поэтому необходим быстрый, недорогой расширенный алгоритм, дающий стандартизированные результаты, которые необходимы для обнаружения предраковых заболеваний in vivo.
Схема алгоритма
Изображение было импортировано в MATLAB ® и преобразовано в оттенки серого для более быстрой обработки с использованием встроенных функций. Imclearborder была использована для ликвидации неполных ядер и подсчета только полных и видимых. Была рассчитана величина градиента и был увеличен порог до контуров клеточных мембран.
Обычный метод водораздела, как правило, разделяет изображение на очень большое количество сегментов, поэтому мы использовали более продвинутые маркеры водораздела. Были маркированы лишь объекты переднего плана с локальными максимумами для обеспечения учета только интересующих объектов. Strel и graythresh были использованы для маркировки белых маркеров переднего плана на черном фоне, которые изменили размер. Для того, чтобы считать только минимумы маркеров, а не все изображение, был использован imimposemin, а затем преобразования были инициализированы в этой точке.
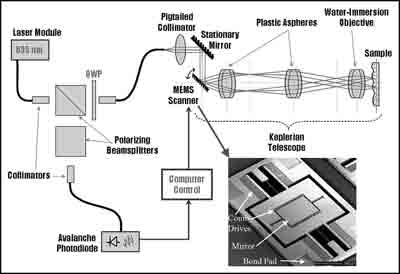
Рисунок 2. Иллюстрация нашего представления об установке микросканера, вид сверху (См. приложение)
Чтобы визуально представить работу функции водораздела, изображение рассматривается в качестве топографической поверхности. Алгоритм начинается с минимумов каждого маркированного объекта и расширяется однонаправлено, пока не достигнет границы другой области. Алгоритм водораздела – точный способ подсчета и сегментации отмеченных областей. Bwlabel метки связные компоненты изображения, которые позволяют numObjects и Regionprops предоставлять статистические данные о сегментированном изображении. На основании результатов предыдущих исследований, были установлены параметры для удаления ложных частей. Все размеры ядер были занесены в массив и был рассчитан средний размер ядра, а также было сделано отображение гистограммы распределения размера.
Алгоритм калибровки
Впервые алгоритм был откалиброван с помощью оптических изображений капель в микрофлюидальных каналах. Микрофлюидальные каналы были изготовлены при помощи полидиметилсилоксана (ПДМС) с быстрым прототипированием. Чистые пластины кремния были покрыты гексамитилдисилазаном (ГМДС), что обеспечило хорошую адгезию между кремнием и фоторезистом. Был применен фоторезист SU-8 2250 для того, чтобы изготовить образец соответствующей толщины, пластина была скручена на 1860 об/мин в течение 30 секунд. Под мягкой литографией, пластина была подвергнута воздействию ультрафиолета в течение 50 секунд и изготовлена в течение 3 минут. Для изготовления, особенности микрофлюидальных каналов передают сопротивлению, на этом производство завершается. ПДМС наливают на пластину после применения Sigma-Cote (название технологии) для снижения адгезии между ПДМС и пластиной, затем это запекается в течение 45 минут при температуре 70 ° C, и очищается, чтобы сформировать каналы. Образец может использоваться таким образом, чтобы надежно воспроизводить тысячи каналов, основываясь на этом проекте.
Капли воды, окрашенные в различные цвета, были введены в различные ответвления микрофлюидального канала. Эффективность слияния наблюдалась при различных скоростях потока и алгоритм был способен сегментировать и подсчитывать количество капель с 93% точностью и 8.7% стандартным отклонением. Чрезмерная сегментация произошла, когда множество капель не сливались в одну. Исходя из этого, был внедрен дополнительный параметр – сведение к минимуму неточно сегментированных капель.
Результаты и выводы
Для более жесткого и надежного тестирования алгоритма были использованы конфокальные медицинские изображения. Изображения взяты из полости рта свиньи при помощи нашего конфокального микроскопа. Алгоритм показал 95% точность и 6.2% стандартное отклонение от ручной сегментации. Хотя здесь и имела место чрезмерная сегментация, было очевидно, что ошибочно сегментированные области не содержали ядер и поэтому могли быть отброшены.
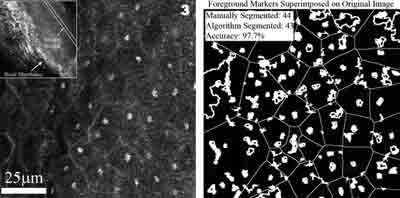
Рисунок 3. Слева - Ротовая полость свиньи, исходное изображение. Справа - сегментированное изображение
Результаты показывают, что данный алгоритм сегментации может анализировать изображения, полученные in vivo, и достаточно эффективно распознавать ядра. Наш алгоритм совместно с нашим ручным in vivo микроскопом, могут давать результаты в режиме реального времени и без биопсии.
Дальнейшая работа
Может быть реализован Байесовский классификатор для определения специфической формы и размеров объекта, что предоставит возможность наблюдения за различными стадиями рака и даст представление о том, какие требуются виды лечения. Для удобства можно написать GUI, тогда другие научно-исследовательские группы смогут получить пользу от автоматизированной сегментации изображений по сравнению с ручным подсчетом. Кроме того, в каждом изображении имеются различные объекты и сигналы, и может быть полезным выполнить преобразование Фурье для анализа этих изображений.
Благодарности
Я хотел бы поблагодарить NSF, NNIN за опыт исследований для студентов программы, доктора Sanjay Banerjee, NNIN Facility, а также Zhang Research Lab в UT Austin.
Источники
[1] K. Kumar, K. Hoshino, H.J. Shin, R. Richards-Kortum and X.J. Zhang, “High-reflectivity Two-Axis Vertical Combdrive Microscanners for Sub-cellular Scale Confocal Imaging Applications”, Proceedings of International Conference on Optical MEMS and their Applications (Optical MEMS ‘06), August 21-24, Montana, USA, 2006.
[2] Brette L. Luck, Kristen D. Carlson, Alan Conrad Bovik, Rebecca R. Richards-Kortum, “An Image Model and Segmentation Algorithm for Reflectance Confocal Images of In Vivo Cervical Tissue,” IEEE Image Proc., V14, #9, pp. 1265-1276, Sep. 2005.