
Углеродистые и низколегированные стали коррозионно не устойчивы в кислых агрессивных средах, однако степень их разрушения неодинакова, что может лимитировать конкретные технологические процессы и условия эксплуатации; при этом интенсивность коррозионного разрушения при данном химсоставе стали во многом зависит от предшествующей деформационно-термической обработки
Целью настоящей работы являлось установление различий и закономерностей коррозионного разрушения конструкционных и инструментальных сталей при кратковременном воздействии кислых сред.
Для исследований использовали промышленные стали с 0,4-0,9%С, легированные хромом и кремнием, с полной корродирующей поверхностью (0,7- 1,6)•10-3 м2 и массой 12-39г. В качестве кислых сред использовали водные растворы кислот – H2SO4 (20%), HNO3 (15%), HCl (10%). Длительность кратковременной экспозиции составляла 20 мин. Прямые экспериментальные исследования проводили газообъемным и весовым методами. Оценку экспериментальных и расчетных показателей производили по следующей методике.
1) Отрицательный показатель изменения массы , определяемый из прямых экспериментов:

где м0 – масса исходного образца, г; м1 – масса образца после воздействия растворов кислот, г; S – полная поверхность, м22; τ – длительность испытания, ч.
2) Объемный показатель , определяемый из прямых экспериментов газообъемным методом:

где Vг – объем выделившегося газа, мл; S – полная поверхность, cм2;
3) Объемный показатель , определяемый пересчетом из :
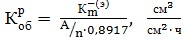
где А, n – атомная масса и валентность корродирующего металла
4) Отклонение расчетного и экспериментального объемного показателя (?, %):

5)Токовый показатель i, определяемый пересчетом:

Кинетика выделения газа при коррозионном воздействии растворов кислот на изучаемые стали приведена на рис. 1-3, а после компьютерной обработки результатов – в табл.1. Для расчета зависимостей использовали программу TCWIN. Видно, что зависимости не являются линейными и торможения процесса коррозии при кратковременном воздействии в кислых средах не наступает. Стали, корродировавшие в 20%-ом водном растворе H2SO4 и 10%-ом водном растворе HCl, подчиняются степенной зависимости, а в 15%-ом водном растворе HNO3 – логарифмической.
Экспериментально полученные и расчетные показатели коррозии изученных сталей в кислых средах приведены в табл.2. При расчете считали, что в раствор кислот переходит двухвалентное железо [4]. Возможность участия в коррозионном процессе с водородной деполяризацией атомов других элементов сталей, структурных составляющих и дефектов кристаллического строения не учитывали.
Определенный вклад в ускоренные показатели коррозии может вносить ее анизотропия. Как видно на рис.4, торцевые поверхности арматурного профиля класса А500С из стали Ст5сп корродируют интенсивнее боковых поверхностей.

Рисунок 1–Кинетика выделения газа при электрохимической коррозии сталей в 20% - ном водном растворе H2SO4 (1-У8А; 2-60С2; 3- ХС)

Рисунок 2 – Кинетика выделения газа при электрохимической коррозии сталей в 15% - ном водном растворе HNO3 (1- У8; 4- 40Х)

Рисунок 3– Кинетика выделения газа при электрохимической коррозии сталей в 10% - ном водном растворе HCl (2-60С2; 3- 9ХС; 4- 40Х)

Рисунок 4 – Кинетика выделения газа при электрохимической коррозии арматуры в 10% - ном растворе H2SO4 (1- боковая пов-ть профиля №10; 2- боковая пов-ть профиля №12; 3-торцевая пов-ть профиля №12; 4 - торцевая пов-ть профиля №10)
Таблица 1 – Аналитические зависимости объема газа (мл), выделившегося за время проведения электрохимической коррозии образцов

Таблица 2-Экспериментальные и расчетные показатели электрохимической коррозии сталей в растворах кислот

Анализ полученных результатов дает основания сделать следующие выводы:
1. При кратковременных испытаниях углеродистых и низколегированных сталей с 0,4-0,9%С в кислых коррозионно-активных средах торможения коррозионного процесса разрушения не наблюдается; закономерности разрушения описываются усложненными зависимостями.
2. В группе сталей 60С2, У8, 9ХС при воздействии 20%-ным раствором H2SO4 в меньшей мере разрушается сталь 60С2, в большей – 9ХС; при воздействии 15%-ным водным раствором HNO3 сталь 40Х предпочтительнее, чем сталь У8; в 10%-ом водном растворе также предпочтительнее сталь 40Х в сравнении со сталями 60С2 и 9ХС.
3. Отклонения в значениях объемного показателя, определенного расчетом из экспериментальных данных и пересчетом из показателя изменения массы, вызваны не только ошибками эксперимента, но и взаимодействием части травильного водорода с металлом, а также упрощением граничных условий.
4. Стали с высоким содержанием углерода в условиях эксперимента корродируют интенсивнее в связи с образованием большого количества микрогальванических пар.
5. Полученные результаты рекомендуются к использованию при назначении технологических процессов подготовки поверхности проката и изделий из него к последующим технологическим операциям, например, к нанесению покрытий.