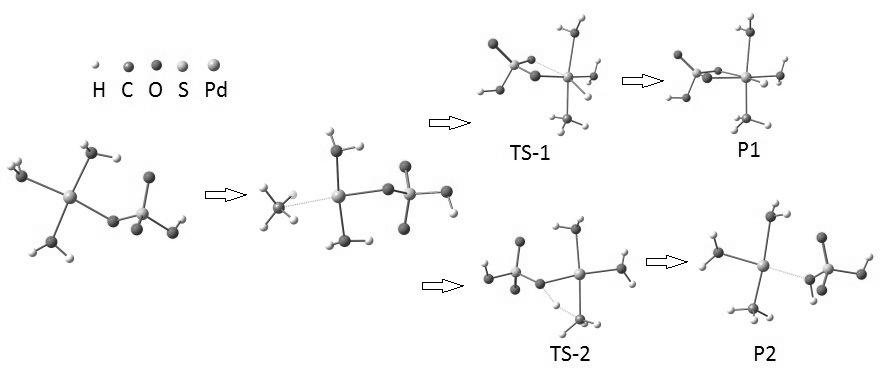
Рисунок 1 Возможные механизмы реакции каталитического превращения метана
АКТИВАЦИЯ МЕТАНА КОМПЛЕКСАМИ ПАЛЛАДИЯ
Андриевский А.П.1, Литвиненко С.Л.2
1Донецкий национальный технический университет
2Институт физико-органической химии и углехимии им. Л. Н. Литвиненко НАН Украины
Алканы являются самым распространенным классом органических соединений. Насыщенные углеводороды - наибольший источник сырья для химической промышленности и будет оставаться таким еще долгие годы. Однако этот класс соединений характеризуется относительно большой стойкостью. Например, метан при нормальных условиях реагирует только с хлором и фтором. У этого класса отсутствует выраженное сродство к большинству химических реагентов. Это обусловлено стойкостью связи С – Н, отсутствием в атомах углерода и водорода неподеленных электронных пар и легкодоступных орбиталей в совокупности с низкой полярностью, низким сродством с электроном и высоким потенциалом ионизации. За последние годы были найдены условия, которые позволяют вводить в состав алканов различные функциональные группы. Одним из перспективных направлений химической технологи является каталитическое превращение насыщенных углеводородов с помощью комплексных соединений переходных металлов. Таким образом, привлечение сырьевого ресурса алканов С1 - С4 в процессы химической переработки важно и актуально.
В современных химических исследованиях благодаря распространению мощных компьютеров широко применяются различные методы квантовой химии. В частности, в последние годы нашли применение неэмпирические квантовые вычисления, в которых из экспериментальных данных используются только заряды ядер атомов.
В данной работе было изучено каталитическое превращение метана с помощь палладиевого катализатора, проводился поиск наиболее приемлемого механизма активации низших алканов.
Расчет квантово-химических параметров выполнялся с помощью программы PC GAMESS. В данной работе использовалась теория функционала плотности (density functional theory DFT) в одной базисной системе B3LYP-SBKJC-p,d,f. Для визуализации молекулярных структур и колебаний был использован графический пакет ChemCraft.
В качестве исследуемой реакции была выбрана реакция активации метана комплексом палладия - Pd(HSO4)(H2O)3. Возможны два механизма активации метана комплексами палладия(II)(рис.1). Оба начинаются с образования комплекса метана с палладием - Pd(HSO4)(СН4)(H2O)2. Первый механизм представляет собой окислительное присоединение метана по связи С-Н, а второй – отрыв атома водорода координированным бисульфатным лигандом с одновременным формированием связи Pd-C
Все рассчитанные структуры переходных состояний (TS) характеризуются только одной мнимой частотой колебаний.

Рисунок 1 Возможные
механизмы реакции каталитического превращения метана
Табл. 1. Изменение параметров во время возможных механизмов реакции
|
∆Е, хартри/kcal |
∆H, ккал/моль |
∆G, ккал/моль |
∆S, кал/моль |
|
|
0/0 |
0 |
0 |
0 |
|
|
Pd(CH4)(HSO4)(H2O)2)++ H2O |
0,032992959/20,703 |
20,258 |
17,991 |
7,603 |
|
TS1 |
0,067222659/42,183 |
39,566 |
37,828 |
5,827 |
|
TS2 |
0,065397159/41,037 |
37,350 |
36,651 |
2,342 |
|
Р1 |
0,061587059/38,646 |
37,120 |
35,396 |
5,780 |
|
Р2 |
0,025055959/15,723 |
15,226 |
12,708 |
8,444 |
В табл. 1 приведены рассчитанные параметры активации для обоих механизмов. Из нее видно, что свободная энергия активации для отрыва Н-атома на 1,117 ккал/моль ниже, чем для окислительного присоединения, то есть этот механизм является более приемлемым.