ВИТЯГУВАННЯ СІРКОВУГЛЕЦЮ З ГОЛОВНОЇ ФРАКЦІЇ СИРОГО БЕНЗОЛУ РЕАГЕНТНИМ СПОСОБОМ ТА РОЗДІЛЕННЯ ОТРИМАНИХ ОРГАНІЧНИХ ПРОДУКТІВ
Автори: О.В. Кіпря, О.С. Комаров, Л.Г. Козлова
Джерело: «Донбас-2020: перспективи розвитку очима молодих вчених»/ Збірка доповідей VI Міжнародної науково-практичної конференції. – Донецьк: ДонНТУ, 2012.
Досліджено процес взаємодії сірковуглецю головної фракції сирого бензолу з аміаком. Розглянуто хімізм процесу, вплив температури, часу контакту та мольного співвідношення на перебіг реакцій. Проведено розділення отримуваної при цьому органічної фази на основні компоненти – бензол та дициклопентадієн.
Суміш низькокиплячих компонентів, що отримується при ректифікації сирого бензолу, зветься головною (ГФСБ), або сірковуглецевою фракцією. На підприємствах, що переробляють бензол, який отримано з сірчистого донецького вугілля, головна фракція вміщує 20-35% сірковуглецю, 15-35% циклопентадієну, 20-50% бензолу, 2-5% дициклопентадієну, до 10% ненасичених (олефіни C5H10) и до 4,0% насичених сполук (циклопентан й гомологи, пентан, гептан). Проте, на даний час, не існує простого, надійного та безпечного способу переробки ГФСБ. Отже, нагальною є потреба розробки принципово нового способу переробки цієї фракції.
Оскільки сірковуглець та циклопентадієн мають близькі температури кипіння (42,5 та 46,5°С відповідно), тому роз’єднати їх за допомогою лише ректифікації неможливо. Найбільше розповсюдження у промисловості для переробки головної фракції отримав метод термічної полімеризації. Проте, на наш час, цей спосіб вичерпав себе і не застосовується, внаслідок його пожежо- і вибухонебезпечності, не екологічності, великих (до 30%) втрат основних компонентів та значних економічних витрат [1,2].
У даній роботі описаний спосіб переробки ГФСБ – з використанням хімічного реагенту аміаку для зв’язування сірковуглецю. Вибір аміаку обґрунтовується тим, що він є відносно недорогим, доступним та може вибірково взаємодіяти з сірковуглецем головної фракції.
Взаємодія відбувається за такими схемами:
Схема 1, t ≥ 120 °С, утворюється тіомочевина
CS2 + 2NH3 → H2N−CS−NH2 + H2S (1)
Схема 2, t = 113 °С, утворюється роданід амонію
CS2 + 2NH3 → NH4−S−C≡N + H2S (2)
Схема 3. Ізомеризація роданіду амонію в тіомочевину, t ≥ 160 °С
NH4−S−C≡N
![]() H2N−CS−NH2
(3)
H2N−CS−NH2
(3)
Схема 4. Утворення сірчистого амонію
H2S + 2NH3 → (NH4)2S (4)
Для визначення оптимальних умов проведення процесу взаємодії ГФСБ та аміаку був досліджений вплив часу контакту на ступінь витягування CS2. Після 3 годин спостерігається незначна зміна ступеня витягування сірковуглецю, тому оптимальним часом для проведення подальших дослідів був прийнятий час – 3 години [3].
Температура кипіння сірковуглецю дорвнює 42,5 °С, а водний розчин аміаку має високий парціальний тиск. Очевидно, що взаємодія між CS2 і NH3 в інтервалі температур 80-150 °С протікає в газовій фазі. Тиск, що створюється в автоклаві, сприятливо впливає на реакції 1-3, оскільки вони йдуть в газовому середовищі зі зменшенням числа молей компонентів системи і супроводжуються поглинанням проміжних продуктів (дітіокарбамінат амонію, тіомочевина, роданід амонію, сірчистий амоній), що утворюються, водною фазою. За результатами дослідів видно, що при зміні співвідношення NH3 : CS2 з 2:1 до 7:1 ступінь витягування сірковуглецю збільшується від 77,3 % до 99,8 %. При стехіометричному співвідношенні NH3 : CS2 = 2:1 ступінь витягування CS2 складає 77,3 % [3].
Аналіз отриманих даних показав, що при збільшенні температури з 85 до 150 °С ступінь витягування зростає з 75,5 до 98 % (при співвідношенні NH3:CS2 = 5:1). При температурі 115 °С досягається практично повне витягування сірковуглецю з органічної фази до водної фази в формі роданистих сполук (при співвідношенні NH3:CS2 = 7:1) (рисунок 1)[4].
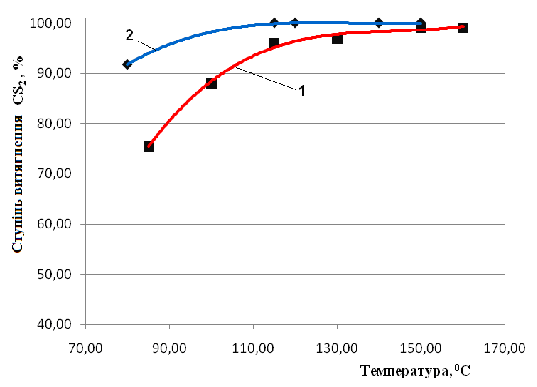
Рис. 1 - Залежність ступеня витягнення
сірковуглецю від температури, 1 - співвідношення NH3:CS2
= 5:1, 2 - співвідношення NH3:CS2
= 7:1
Таким чином, згідно з дослідами [3], було обрано мольне співвідношення NH3:CS2 = 7:1, час контакту 3 години, температуру 120 °С.
Внаслідок взаємодії ГФСБ з аміаком утворюються дві фази – водна
і органічна (рисунок 2).
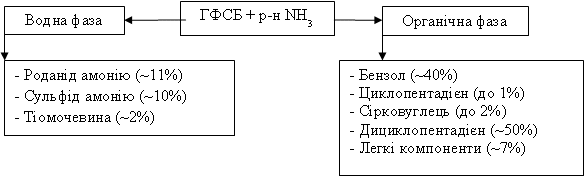
Рис. 2 – Схема утворення продуктів реакції
Органічну фазу розділяли на дві фракції згідно з температурами кипіння компонентів: низькокиплячу (температура відгону до 86 ºС, у складі переважно бензол) та висококиплячу. Випробували три способи розділення: просту перегонку, перегонку з водяною парою та під вакуумом.
Дициклопентадієн здатен при підвищенні температури до 115ºС самодовільно переходити у мономер, отже необхідно вести перегонку за якнайменшої температури. За цієї умови застосування простої перегонки стає не вигідним.
Продукти органічної фази розділяли відгонкою гострою парою, відштовхуючись від різних температур кипіння бензолу та дициклопентацієну (80,1 та 166,6 °С відповідно).
Хроматограми продуктів перегонки головної фракції з водяною парою, представлені на рисунку 3.
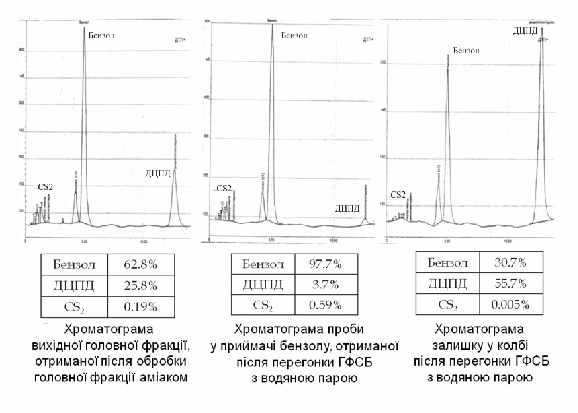
Рис. 3 – Хроматограми продуктів перегонки головної фракції з водяною парою
Під вакуумом переганяли органічну фракцію, що містила 0,19% сірковуглецю, 0,26% циклопентадієну, 58,82% бензолу, 21,53% дициклопентадієну. Внаслідок перегонки отримали такі дані:
- у приймачі: 0,22% сірковуглецю, 0,35% ЦП, 90,04% бензолу, 2,97% ДЦПД;
- залишок у колбі: 0,01% сірковуглецю, 17,68% бензолу, 42,0% ДЦПД.
Порівнюючи результати дослідних даних, можна зробити висновок, що перегонка з водяною парою та під вакуумом дають високі результати, при їх застосуванні отримуємо 90-97%-вий бензол та досить насичену дициклопентадієном (42-56%) залишкову фракцію.
Висновки
Експериментальні дослідження процесу витягнення сірковуглецю з головної фракції сирого бензолу водним розчином аміаку показали, що процес протікає через ряд послідовних стадій. Оптимальним для взаємодії обрано мольне співвідношення NH3:CS2 = 7:1, час контакту 3 години, температуру 120 °С. Найбільшу ефективність розділення продуктів органічної фази показали перегонка з водяною парою та під вакуумом.
Лейбович Р.Е., Яковлева Е.И., Филатов А.Б. Технология коксохимического производства. – М: Металлургия, 1982. – 360 с.
Коляндр Л.Я. Новые способы переработки сырого бензола. – М.: Металлургия, 1976. - 192 с.
О возможности извлечения сероуглерода из головной фракции сырого бензола химическим методом / И.Г. Крутько, А.В. Кипря, В.А. Колбаса, А.С. Комаров, К.А. Сацюк // Вісник Національного технічного університету «Харківський політехнічний інститут». Збірник наукових праць. Тематичний випуск «Хімія, хімічна технологія та екологія». – Харків: НТУ «ХПІ». – 2010. – № 11. – С. 43 – 47.