ПРИМЕНЕНИЕ ТЕРМИЧЕСКИХ МЕТОДОВ АНАЛИЗА К ИССЛЕДОВАНИЮ ФАЗОВОЙ СТАБИЛЬНОСТИ НИТРАТА АММОНИЯ
Автор: Попок В.Н.
Источник: ПОЛЗУНОВСКИЙ ВЕСТНИК № 3/1 2011
В статье представлены результаты исследования термическими методами анализа (дифференциальная сканирующая калориметрия, дифференциально-термический анализ, термогравиметрический анализ, термомеханический анализ) фазовой стабильности различных марок нитрата аммония. Проведены циклические испытания образцов в интервале температур от -50°С до +50°С. Установлено, что наиболее оптимальной маркой нитрата аммония в плане фазовой стабилизации является марка ЖВ.
Ключевые слова: дифференциальная сканирующая калориметрия, дифференциально-термический анализ, термогравиметрический анализ, термомеханический анализ, циклические испытания, нитрат аммония, полиморфные переходы.
Введение. Термические методы анализа, такие как дифференциальная сканирующая калориметрия (ДСК), дифференциально - термический анализ (ДТА), термогравиметрический анализ (ТГА), термомеханический анализ (ТМА) позволяют определять такие термокинетические параметры исследуемых веществ и их смесей, как температурные интервалы полиморфных и фазовых переходов, температуры плавления и разложения, испарения и соответствующие им тепловые эффекты, потерю массы в процессе нагревания (охлаждения), изменение линейных размеров в стационарных и нестационарных температурных условиях в различных газовых средах [1]. При этом современное оборудование, на котором внедрены эти методы исследования, позволяет проводить испытания с различными скоростями нагрева (охлаждения), различными массами исследуемых образцов, циклические испытания, выдержку образцов при определенной температуре [2].
Как отмечено выше, термические методы анализа позволяют определять температурные интервалы полиморфных переходов в кристаллической решетке различных веществ. В настоящей работе рассмотрено применение методов ДСК, ДТА, ТГА, ТМА в исследованиях фазовой стабильности такого окислителя энергетических конденсированных систем (ЭКС), применяемых в различных газогенераторах и энергетических установках, как нитрат аммония. Перспективность нитратных ЭКС обусловлена экологической чистотой продуктов его сгорания, низкой стоимостью и высокими параметрами безопасности на стадиях производства и применения ЭКС на его основе [3-22]. Одним из факторов сдерживающих широкое распространение нитратных ЭКС является наличие полиморфных переходов в кристаллической решетке НА в интервале температур от -50°С до +50°С [3-5]. В имеющихся сегодня работах [6-8] приводятся решения задачи блокирования полиморфных переходов НА различными методами, однако зачастую эти разработки не учитывают необходимость обеспечения стабильности физико-химических свойств фазостабилизированного НА во времени, его совместимость с другими компонентами ЭКС, влияние фазостабилизирующих добавок на такие характеристик ЭКС как баллистические и взрывчатые. Кроме того, работы по фазовой стабилизации НА, как компонента ЭКС, не учитывают большой опыт с этим окислителем в других областях, в частности в создании промышленных взрывчатых веществ[9].
Таким образом, целью настоящей работы является сравнение различных марок фазостабилизированного НА, в том числе выпускаемых в промышленных масштабах, в условиях циклических испытаний методами термического анализа.
Методы и объекты исследования. В качестве методов исследования выбраны дифференциально-термический анализ (ДТА), дифференциальная сканирующая калориметрия (ДСК), термогравиметрический анализ (ТГА) термомеханический анализ (ТМА). Первые два метода позволяют определять температуры полиморфных и фазовых переходов, температуру начала интенсивного разложения и соответствующие им тепловые эффекты. Метод термогравиметрического анализа позволяет устанавливать изменение массы образца в течение испытаний, методом ТМА исследуются линейные изменения образцов в течение эксперимента.
Исследования проводились при скорости нагрева 10°С/мин, в среде азота. Исследования методами ДСК, ДТА, ТГА проводились на образцах массой 5-7 мг. ТМА проводился на сферических гранулах диаметром 3 мм, на прессованных образцах (таблетках) порошков НА. В последнем случае использовались образцы следующих размеров: диаметр 10 мм,высота 3-5 мм. Давление прессования при изготовлении таблеток 300-600 МПа. Достигнутая плотность запрессовки составляла величину 0,9-0,95 от максимальной для монокристалла НА.
В качестве объектов исследования, как определено выше, выбраны образцы НА марок А и ЖВ, НА стабилизированный окисью никеля, меди и цинка, сокристаллизат (из водного раствора) НА с ПХА и бихроматом аммония (БХА) и другие [9-11].
Для проверки фазовой стабильности НА в смесях были исследованы ЭКС на основе рассматриваемых марок нитрата аммония и различных типов горючих-связующих (ГСВ) [12-14]. Рассматривались как смеси НА со связующими СКДМ-80 (полимер СКД, пластифицированный нефтяным маслом), ГН (полимер МПВТ, пластифицированный нитрамино-нитроэфирным пластификатором), ДС (полимер МПВТ, пластифицированный нитрамино-триазольным пластификатором) соотношение в смесях: 50-90 масс. % НА и 10-50 масс. % ГСВ, так и металлизированные смеси, содержащие 15 масс. % порошка алюминия марки АСД–6 [8, 9]. Все металлизированные смеси характеризуются значением коэффициента избытка окислителя α=0,5.Использовались порошки НА, приготовленные размолом гранулированной аммиачной селитры марок А и ЖВ. Для сравнения используются литературные данные для смесей фазостабилизированного оксидами металлов НА с аналогами используемых ГСВ[13, 16, 19].
Экспериментальные результаты и их обсуждение На рисунке 1 показаны кривые ДСК/ДТА порошков НА марок А, ЖВ и фазостабилизированного НА в широкой области температур вплоть до разложения образцов НА. Эндотермические эффекты на кривых ДТА соответствуют фазовым, полиморфным
переходам и разложению НА. Нитрат аммония марки А имеет полиморфные переходы в окрестности значений температур Т= -30°С,Т=52 °С, Т=80-90 °С и Т=128-130 °С. Фазовые переходы, соответствующие плавлению закристаллизованной воды (и эвтектики [15]) при Т=0 °С, плавлению НА при Тпл=169 0С и сублимации–разложению НА при температуре 200 °С Таблица 1 – Характеристика кристаллических модификаций нитрата аммония Полученные результаты в целом соответствуют данным для чистого НА, за исключением ярко выраженного смещения области полиморфного перехода фазы IV→III в область Т≈50-52 °С. ДТА, ДСК НА марки ЖВ показывают отсутствие полиморфных переходов в области температуры меньше +50 °С,а также полиморфного перехода при Т≈84 °С (III→II), который однозначно обнаруживаетсяв образцах НА марки А. Значения температуры Т и тепловых эффектов Q фазовых и полиморфных переходов, полученные методом ДСК следующие: Т≈°С, Q≈-(3-4) Дж/г; Т≈52 °С, Q≈-(16-25)Дж/г; Т≈84-90 °С, Q≈-15 Дж/г (отсутствует в НА марки ЖВ); Т≈128 °С, Q≈-50 Дж/г;
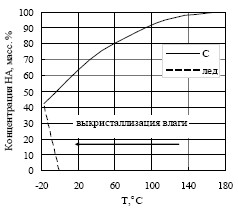
Тпл≈169-170 °С, Q≈ -70 Дж/г и хорошо согласуются с литературными данными [5, 9-11,15]. Оценки величины энергии активации (по данным ТГА) распада расплава НА марок А и ЖВ в интервале температур 200-300 °С дают значения 30-35 ккал/моль, что соответствует имеющимся литературным данным для чистого НА (32 ккал/моль) [5]. На рисунке 2 приведены данные по растворимости НА в воде при различных температурах [15], показывающие образование льда из раствора НА+Н2О при температуре Т≈-16 °С. Наличие остаточной влаги в образце НА должно приводить к смещению точек плавления–кристаллизации воды в зависимости от того нагревается или охлаждается образец в процессе эксперимента [5, 15]. На рисунке 1 показаны кривые ДСК, полученные при охлаждении образцов НА марок А и ЖВ.
Сравнение с кривыми ДСК, полученными при нагреве образцов, показывает незначительное (гистерезис) смещение положения полиморфного перехода II#8594;IV в низкотемпературную область в сравнении с переходом IV→III в НА марки А и IV→II в НА марки ЖВ и существенное смещение точки кристаллизации воды (фазовый переход) из раствора в область отрицательных температур Т≈ -25
°С, что соответствует данным работ [5, 15]. В целом, полученные для НА марки А результаты хорошо согласуются с результатами исследований фазовой стабилизации НА нитратом магния [16]. Смещение температуры полиморфного перехода IV#8594;III в область температур более 50 °С сохраняется до содержания влаги в образцах ≈1 масс. % с уменьшение температуры гигроскопической точки до ≈25 °С, что практически блокирует возможность применения нитрата аммония марки А в составах ЭКС. Повторный нагрев (как и многократные циклические температурные испытания) образцов НА марок А и ЖВ в этих условиях дает полностью идентичную картину расположения полиморфных и фазовых переходов, полученную в первом цикле нагрев-охлаждение. На рисунке 1 также приведены литературные данные по ДСК, ДТА НА, стабилизированного оксидами металлов, которые в целом соответствуют результатам испытаний НА марки А и образцам, изготовленным по методике работы [17], как по положению точки полиморфного перехода IV→III (Т≈52 °С), так и по наличию фазового перехода в окрестности температуры Т≈ 0 °С, обусловленного плавлением остаточной влаги в образце. Для сравнения смещений положения полиморфных и фазовых переходов в НА, стабилизированном оксидами металлов в цикле нагрев–охлаждение проведены эксперименты с получением НА, стабилизированного оксидами металлов в условиях ДТА [9, 10]. На рисунке 3 показаны результаты ДСК/ДТА смеси, сплава НА/ZnO и НА/ПХА/БХА с включением области высоких температур. Реакция НА с ZnO сопровождается мощным экзоэффектом (≈1 кДж/г) [9, 10].Разложение и сублимация образца заканчивается при Т≈ 250 °С, что меньше температуры полного разложения (сублимации) чистого НА. На этом же рисунке показаны кривые ДТА сплава НА/ZnO при охлаждении и повторном нагреве образца после нагрева до 180 °С.
Охлаждение образца однозначно показывает наличие полиморфного перехода при Т≈ 50 °С и фазовый переход в области Т≈ -30 °С. Последующий нагрев образца от -50 °С до +100°С обнаруживает фазовый переход, соответствующий плавлению льда при Т=0°С, полиморфный переход IV→III при Т≈ 50-
52 °С и полиморфный переход III→II при Т≈80-90 °С. Полученные результаты, в целом,
соответствуют литературным данным и хорошо согласуются с результатами по полиморфным и фазовым переходам в НА марки ЖВ, за исключением перехода III→II при Т≈80-90 °С, отсутствующего в НА марки ЖВ, как при нагреве, так и охлаждении образцов. Повторные циклические испытания полученного
образца фазостабилизированного НА приводят к распаду твердого раствора с восстановлением, по крайней мере, одного полиморфного перехода в области Т≈ -30 °С. Аналогичные исследования с использованием методов ДТА/ДСК были проведены и с образцами тройного сокристаллизата НА/ПХА/бихромат аммония (БХА) с соотношением компонентов в частях смеси соответственно 12/8/1. Результаты испытаний полностью согласуются с данными для НА марки
ЖВ [9, 10]. Использование бихромата аммония приводит к мощному катализу разложения сокристаллизата с узкой температурной областью полного разложения в окрестности
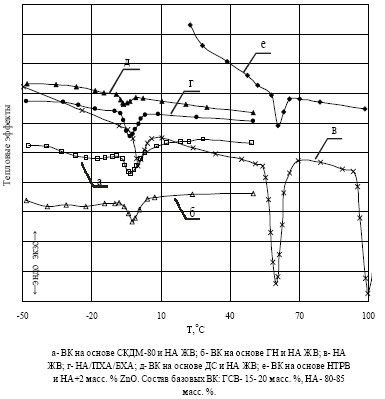
Т≈200 °С. Эвтектический сплав ПХА/НА (в соотношении 10/90 по массе) имеет полиморфный переход в области температур Т≈52-56 °С [9, 10]. Оценки тепловых эффектов плавления льда в рассмотренных образцах НА при Т≈0 °С соответствуют содержанию остаточной влаги на уровне ≈1 масс. %. В целом необходимо отметить, что тепловые эффекты полиморфных переходов для фазостабилизированных образцов НА значительно меньше, чем для чистого НА, что в целом соответствует данным ТМА. На рисунке 4 приведены данные ДСК по определению фазовых и полиморфных переходов в ЭКС на основе НА типа ЖВ и ГСВ СКДМ-80, ГН, ДС в области температур от -50°С до +50 °С. Если исключить из рассмотрения небольшой пик в окрестности Т=0 °С, то можно констатировать, что в рассматриваемом интервале температур полиморфные переходы как в НА типа ЖВ, так и в ЭКС на его основе,отсутствуют. Аналогичные результаты получены и для смесей на основе сокристаллизата НА с ПХА и бихроматом аммония. Введение алюминия в рассматриваемые смеси не изменило положения областей фазовых и полиморфных переходов в смесях. Сравнение полученных результатов (для НА марки ЖВ) с данными для смесей фазостабилизированного окислами металлов НА с ГСВ типа НТРВ [20], глицидилазидным связующим на основе полимера GAP [21, 22],являющимися базовыми для разрабатываемых за рубежом ЭКС, показывает полную идентичность расположения полиморфных переходов в области температур от -50 °С до
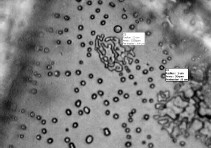
+100 °С. Анализ полученных результатов показывает, что в ЭКС на основе ГСВ ДС наблюдается существенное уменьшение эндоэффекта в окрестности 0 °С в сравнении с результатами для смесей с другими ГСВ и различными видами НА. Кроме этого, хранение ЭКС на основе ГСВ СКДМ-80, ДС, как безметальных, так и металлизированных в течение четырех лет при 0 °С≤Т≤+40 °С в герметичной упаковке не изменяет характеристик фазовых, полиморфных переходов и параметров разложения ЭКС [9, 10]. Результаты термомеханического анализа (ТМА) полностью соответствуют представленным данным ДСК [9, 10]. Проведены работы по приготовлению смеси активного ГСВ с мелкокристаллическим НА путем удаления растворителя из смеси раствора ГСВ и раствора НА. При этом происходит кристаллизация НА с образованием частиц размеров 1-5 мкм (рисунок 5). Таким способом приготовленная смесь не имеет полиморфных переходов и сохраняет фазовую стабильность более чем в 100 циклах температурных испытаний в области температур от -50 °С до +50 °С. Такой способ приготовления смесей с сопутствующей фазовой стабилизацией НА является перспективным для ЭКС с умеренным содержанием НА. В дополнение к изложенным результатам необходимо отметить, что стабилизация НА оксидами металлов (CuO, NiO, ZnO), бихроматом калия сопровождается неприемлемым снижением параметров химической стойкости ЭКС, в отличие от чистого НА [21,22]. Добавки, используемые при производстве НА марок А и ЖВ практически не оказывают влияния на параметры его термического разложения, в том числе в смесях с использованными ГСВ. Испытания ЭКС на основе рассмотренных ГСВ и НА марок А и ЖВ по ампульно-хроматографической методике дают уровень газовыделения при 80 °С за 24 часа в пределах 0,01-0,03 см3/г с увеличением объема газов до 0,06-0,08 см3/г при длительности термостатирования 72 часа. Для блокирования поглощения НА влаги, выделяющейся при частичном разложении, например, ГСВ используются цеолиты и аэросил [19]. Заключение Представленные результаты комплексного исследования с использованием различных термоаналитических методов, очевидно, не охватывают всей проблематики полиморфных переходов в кристаллической структуре НА, но показывают, что выпускаемые промышленностью России (и других
стран бывшего СССР) марки А и ЖВ нитрата аммония, практически идентичны по характеристикам фазостабилизированному оксидами металлов НА, интенсивно разрабатываемому в некоторых странах и показали свою устойчивость в естественных условиях длительного хранения [9, 10].Полученные экспериментальные данные по полиморфным переходам в кристаллической решетке НА промышленных марок показывают, что НА марки А не имеет полиморфных переходов в области температур 0 °С ≤
Т≤50 °С, а НА марки ЖВ не имеет полиморфных переходов в интервале температур
-50 °С ≤Т≤50 °С. Фазовый переход в НА марок А и ЖВ при Т≈0 °С обусловлен остаточной влагой. Поэтому, с учетом необходимости продолжения работ по фазовой стабилизации НА в широкой температурной области выглядит целесообразным рекомендовать к использованию в разрабатываемых ЭКС на основе НА промышленно выпускаемый НА марки ЖВ, который длительное время используется в производстве промышленных ВВ в смесях с различными классами соединений (нитроэфиры, нитрамины, триазолы, тетразолы, полимеры, порошки алюминия и др.), используемых в качестве компонентов рассматриваемых в настоящей работе смесевых ЭКС. Существующее приборное оформление термоаналитических методов позволяет проводить детальный качественный и количественный анализ фазовых, в том числе полиморфных, переходов в индивидуальных и смесевых ЭКС. Список литературы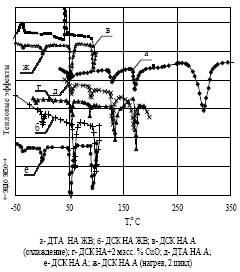
Модификация
Температурные границы, °С
Плотность, г/см3
I
169,6-125,8
1,55
ІІ
125,8-84,2
1,6
III
169,6-125,8
1,55
ІV
32,3-(-18)
1,7
V
ниже -18
1,72