Реферат по теме выпускной работы
Содержание
- Введение
- Постановка задачи
- 1. Анализ состояния вопроса во всемирной практике
- 2. Физико-химические основы процесса
- 2.1 Теория электролиза
- 2.2 Законы Фарадея, лежащие в основе электролиза
- 2.2.1 Первый закон Фарадея
- 2.2.2 Второй закон Фарадея
- 2.3 Факторы, влияющие на процесс электролиза
- 2.4 Импульсный электролиз
- 3. Экспериментальная часть
- 3.1 Обзор существующих установок
- 3.2 Методика выполнения эксперимента
- 3.3 Результаты эксперимента
- 3.4 Анализ результатов
- Список источников
Введение
Электрохимия, как наука, сформировалась на рубеже XVIII и XIX веков. Именно тогда были определенные проблемы, решение которых вывело на новый уровень теорию электрохимии. Толчком для создания и развития электрохимии, как науки послужило создание в 1799 г. итальянским физиком А. Вольтом "вольтова столба" - первого в истории человечества химического источника тока и опыты итальянского физиолога Л. Гальвани.
Электрохимия достаточно молодая наука. Только в начале прошлого века было установлено, что при прохождении электрического тока через водные растворы солей, происходят химические превращения, что приводит к образованию новых веществ.
И только в начале прошлого века возникла электрохимия - научное направление по изучению электрохимических процессов в растворах и расплавах веществ. Промышленное применение электролиза стало возможным после появления в семидесятых годах XIX века мощных генераторов постоянного тока.
Необходимо заметить, что электролиз является одним из важнейших направлений в электрохимии, в свое время послужил основой для важных научных открытий в области электрохимии[1].
Постановка задачи
Исследовать процесс электролиза, определить факторы, которые больше всего влияют на процесс. Разработать экспериментальную установку для получения продуктов электролиза и провести анализ и оптимизацию ее работы. Разработать электронный блок питания, который будет генерировать импульсы заданной частоты в широком интервале.
1. Анализ состояния вопроса во всемирной практике
Разнообразие методов получения водорода является одним из главных преимуществ водородной энергетики, поскольку повышает энергетическую безопасность и снижает зависимость от отдельных видов сырья.
К ним относятся:
- паровая конверсия метана и природного газа;
- газификация угля;
- электролиз воды;
- пиролиз;
- частичное окисление;
- биотехнологии.
В данный момент наиболее доступным и дешевым процессом является паровая конверсия. Согласно прогнозам, она будет использоваться в начальной стадии перехода к водородной экономике[2].
2. Физико-химические основы процесса
Электролитическими называются химические превращения, происходящие при воздействии на вещества электрического тока. Процесс электролиза, неодинаков во всех случаях и зависит от ряда факторов - природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов.
2.1 Теория электролиза
Электролиз происходит за счет энергии постоянного тока, подводимой и энергии, выделяющейся при химических превращениях на электроде. Таким образом, электролиз способен протекать только в средах, которые проводят электрический ток.
Энергия при электролизе расходуется на повышение гиббсовои энергии системы в процессе образования целевых продуктов и частично рассеивается в виде теплоты при преодолении сопротивлений в электролизере и других участках цепи. Исследуя продукты, выделяемые у электрода, при электролизе кислот, оснований и солей, установили, что у катода всегда выделяются металлы и водород, а у анода кислотные остатки или гидроксильные группы, которые затем подвергаются дальнейшим изменениям.
Рассмотрим более подробно процессы, протекающие при электролизе. Известно, что существуют проводники первого рода, в них электричество переносится с помощью электронов, и проводники второго рода, когда электричество переносится ионами. Электроны вступают во взаимодействие с ионами в местах электрической цепи, где проводник первого рода граничит с проводником второго рода. Таким образом, происходят электрохимические процессы.
Электрохимические процессы, протекающие у электродов при электролизе, прежде всего, будут зависеть от соотношения электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого связано с минимальной затратой энергии[1].
2.2 Законы Фарадея, лежащие в основе электролиза
2.2.1 Первый закон Фарадея
В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшего через электролит:
где k - электрохимический эквивалент вещества;
q - электрический заряд;
I - сила тока;
T - время, в течение которого пропускается ток.
Если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, которое выделяется при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.

где z – валентность атома (иона) вещества;
e – заряд электрона, e=1,062*10-19Кл;
F = eNA– постоянная Фарадея, F = 96485 Кл * моль-1.
2.2.2 Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты. Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент:
Второй закон Фарадея записывается в следующем виде:
где М - молярная масса данного вещества, образовавшегося (но не обязательно выделилась - она могла и
вступить в какую-либо реакцию сразу после образования) в результате электролиза;
I - сила тока, А;
Δt- время, в течение которого проводился электролиз, с;
n - количество электронов, участвующих в процессе, при достаточно больших значениях силы тока равна
абсолютной величине заряда иона, который принял непосредственное участие в электролизе (окисленного или восстановленного)[2].
2.3 Факторы, влияющие на процесс электролиза
Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта.
Сила тока или нагрузка на электролизер характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизер, тем больше продукта можно получить при эксплуатации данного электролизера. Наблюдается тенденция к созданию мощных электролизеров, рассчитанных в некоторых случаях на десятки и сотни тысяч ампер (производство хлора, алюминия и т.д.) напряжение на электролизере складывается из нескольких составляющих:
где: U – общее напряжение на блоке;
ea и ek – равновесные потенциалы анодной и катодной реакции;
e эл і e диафр – падение напряжения в электролите и в диафрагме;
e конт – падение напряжения в контактах.
Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идет непосредственно на изменение внутренней энергии веществ.
При электролизе стремятся к уменьшению напряжения на ячейке за счет величины поляризации и омического состояния баланса напряжения, т.е. составляющих, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а потому не может быть изменена. Значение приращений ea и ek могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путем перемешивания, повышения температуры электролита, изменения состояния поверхности электрода и за счет ряда других факторов.
Падение напряжения в электролите, выражается уравнением:
где ρ — удельное сопротивление электролита;
l — расстояние между электродами (без учета диафрагмы);
S — площадь поперечного сечения электролита.
Если электролиз сопровождается образованием газов, то приведенное выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что на электродах выделяются пузырьки газов, которые уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объема занимаемого в данный момент пузырьком воздуха к общему объему электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выражения:
где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита;
φ – газонаполнение.
Величина φ может быть уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удаление газов из ячейки.
Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей.
Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжения на ванне:
Плотностью тока называется отношение силы тока, проходящего через электролит к величине поверхности электрода; измеряют в А/см2(дм2 или м2). В промышленности работают с разной плотностью тока - от нескольких сотен А/см2(гальваностегия, гидроэлектрометаллургии, производство хлора) до нескольких тысяч А/см2(электролиз расплавов, электросинтез и т.д.)
Величина плотности тока характеризует количество продукта, получаемого с единицы электродной поверхности, т.е. производительность электролизера. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиза, стремятся к проведению процесса с максимально возможной плотностью тока.
Однако при выборе оптимальных значений плотности тока в некоторых случаях необходимо учитывать увеличение себестоимости продукта за счет повышения расхода электроэнергии на электролиз вследствие увеличения напряжения с ростом плотности тока. При электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде. Так ток пропускается через электролит, распределяется между несколькими процессами, протекающими на данном электроде одновременно:
где: I – ток, протекающий через электролизер;
i1 та i2 – ток, потребляемый в единицу времени на первую и вторую электролитическую реакцию.
Для того чтобы учитывать эффективность использования пропущенного через электролизер количества электричества на образования того или иного продукта вводится понятие выхода по току.
Теоретически необходимое количество электроэнергии - это количество ее, которое было бы необходимым для получения единицы количества вещества, если бы процесс происходил со 100% выходом по току и при напряжении, равном напряжению разложения. Итак, выход по энергии может быть определен по формуле:
Расход электроэнергии обычно относят к единице количества произведенного продукта, измеряют в (Вт*час)/кг или (Вт*год)/кг. Для расчета расхода электроэнергии постоянного тока на 1т произведенного продукта можно воспользоваться следующей формулой:
где: W – расход электроэнергии постоянного тока, (Вт*час)/кг;
U – напряжение на электролизере, В;
k – электрохимический эквивалент;
η струму – выход по току, доли единицы;
1000 – коэффициент для перевода вт*час в квт*час.
Расход электроэнергии переменного тока на единицу произведенного продукта может быть определена делением расхода электроэнергии постоянного тока на то же количество коэффициента при преобразовании переменного тока в постоянный.
2.4 Импульсный электролиз
Нередко в исследованиях по импульсному электролизу не указывается, о каких значениях плотности поляризующего тока и электродного потенциала идет речь. В общем случае поляризующий ток и потенциал являются несинусоидальными функциями времени. Тогда, согласно основам теоретической электротехники, следует различать мгновенные значения плотности тока j(t) и потенциала Е(t) (значения в любой момент времени периода), максимальные jmах, Еmах (наибольшие в любой момент времени), средние за период Т

и действующие значения; последние определяются как

Без указания, какими значениями той или иной величины оперирует автор, исследования не позволяют выполнить анализ влияния параметров режима на процесс осаждения. Для стационарных режимов электролиза (постоянным током) все значения j(t)=Jср=J=J_.
В то же время использование тех или иных значений потенциала и плотности тока бывает ошибочным. Прежде всего, это относится к средним значениям потенциала и поляризации, которые привлекают для суждений о кинетике электродных реакций при произвольной форме поляризующего тока. Среднее значение поляризации является только количественной мерой постоянной составляющей активной мощности электрода, равной ηср*Jср; иного практического смысла значения ηср не имеют. Возможность протекания того или иного электрохимического процесса величина ηср не характеризует. Это вызвано тем, что за период импульсного тока потенциал электрода принимает самые различные значения, порой существенно отличающиеся от средней величины Eср. Поэтому только мгновенные значения Е(t) (совместно с током j(t)) определяют энергетическое состояние электрода и тем самым обусловливают вероятность разряда тех или иных ионов в данный момент времени [5,6]. В связи с этим программное управление мгновенными значениями тока [7,8] и потенциала, а также временем удержания Е при таком значении, которое соответствует разряду требуемых ионов, является важной стороной развития импульсного электролиза. При экспериментальных исследованиях наиболее необходимые зависимости — записанные осциллографические кривые потенциал — время и плотность импульсного тока — время. Обычные компенсационные методы измерения потенциала непригодны для целей импульсного электролиза, поскольку дают только его среднее значение.
3. Экспериментальная часть
3.1 Обзор существующих установок
Есть несколько основных конструкций электролизеров, которые дают достаточно большой выход газов при сравнительно малых затратах энергии:
- водородная ячейка С. Мейера (Meyer Сell);
- водородная ячейка Джо (Joe Cell).
Остальные топливные элементы, которые используются в настоящее время, сделаны на основе первых двух, с некоторыми преобразованиями в конструкции самого топливного элемента, или в его питании.
Блок С. Мейера (рис. 3.1) имеет много общего с электролитическим блоком, за исключением того, что он работает при высоком потенциале и низком токе лучше, чем другие методы.
Электроды сделаны из параллельных пластин нержавеющей стали, образующие либо плоскую, либо концентрическую конструкцию. Выход газа зависит обратнопропорционально расстоянию между ними; предлагаемое патентом расстояние 1.5 мм дает хороший результат.
Значительные отличия заключаются в питании ячейки. Мейер использует внешнюю индуктивность, которая образует колебательный контур с емкостью ячейки, - чистая вода, очевидно, имеет диэлектрическую проницаемость около 5, - чтобы создать параллельную резонансную схему.
Она поднимается мощным импульсным генератором, который вместе с емкостью ячейки и выпрямительным диодом составляет схему накачки. Высокая частота импульсов производит потенциал, ступенчато поднимается на электродах ячейки до тех пор, пока не достигается точка, где молекула воды распадается и возникает кратковременный импульс тока.
Группа очевидцев независимых научных наблюдателей Великобритании свидетельствовала что американский изобретатель, Стэнли Мэйер, успешно разлагает обыкновенную водопроводную воду на составляющие элементы посредством комбинации высоковольтных импульсов, при среднем потреблении тока, измеряемого всего лишь миллиампер.
Зафиксированный выход газа был достаточным, чтобы показать водородно-кислородное пламя, которое мгновенно плавило сталь.
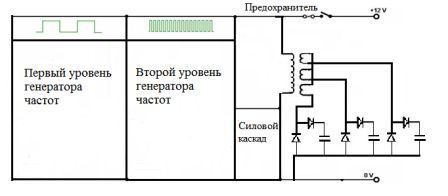
Рис. 3.1 - Электролитический блок Стэнли Мейера
Водородный блок Джо, как ячейка Мейера, это уникальный аппарат для получения большого объема водорода при минимальных затратах электроэнергии, питания можно осуществить от автомобильного аккумулятора, при малом вольтаже постоянного напряжения. Уникальность данного центра заключается в том, что в отличие от ячейки Мейера, это электролизер имеет несколько трубчатых резонаторов различного диаметра вставленных друг в друга (рис 3.2), конструктив очень простой, но эффективность такого аппарата очень велика, тем более что при работе электролизера замечено много впечатляющих новых эффектов, это такие эффекты не встречающихся при обычном электролитическом способе разложения воды. Во время работы устройства случалось что резонаторы, которые производят резонансный разделение воды, по каким-то причинам очень значительно снижают температуру на корпусе и аппарат покрывается инеем, хотя температура окружающей среды не обеспечивает данное состояние, то есть идет смена среды в поле устройства. Этот эффект охлаждения пока не выяснен, но имеет большое значение для понимания процесса резонансной технологии не только для получения водорода, а энергии вообще[3].
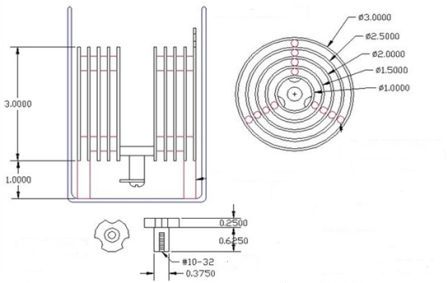
Рис. 3.2 - Электролитический блок Джо
Поиск условий моделирования процесса разложения воды на водород и кислород, который идет при фотосинтезе, привел к простой конструкции ячейки (рис. 3.3), в котором имитированы годовые кольца стволов деревьев в виде зазоров между коническими электродами. Оказалось, что процесс электролиза может протекать при напряжении 1,5-2,0 В между анодом и катодом и силе тока 0,02 А. Поэтому этот процесс называется низкоамперным.
Прежде всего, отметим, что материал анода и катода один - сталь, что исключает возможность формирования гальванического элемента. Тем не менее, на электродах ячейки появляется разность потенциалов около 0,1 В при полном отсутствии электролитического раствора в ней. После заливки раствора разность потенциалов увеличивается. При этом положительный знак заряда всегда появляется на верхнем электроде, а отрицательный - на нижнем. Если источник постоянного тока генерирует импульсы, то выход газов увеличивается[4]. Процесс низкоамперного электролиза может состоять из двух циклов, в одном цикле электролизер включен в сеть, а в другом - выключен[5].
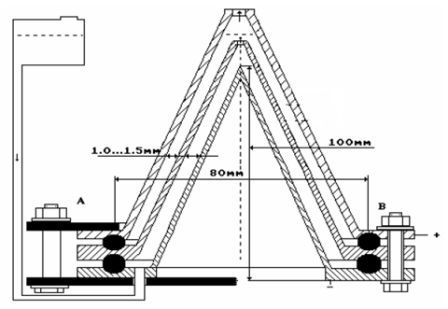
Рис. 3.3 - Низкоамперний электролизер (Пат. № 2227817)
Экспериментальная установка состоит из электролизера, регулируемого блока питания, амперметры и вольтметры.
3.2 Методика выполнения эксперимента
Пластины электродов развести полностью, включить питание и измерить выход газов, выделяющихся. Выход газов измерить при силе тока 2, 3, 4 и 5 ампер, а также измерить напряжение при этих значениях силы тока.
Опыт повторить для положения электродов А, Б и В (рис 3.4). Полученные данные занести в таблицу.

Рис 3.4 – Положение электродов
(анимация: 9 кадров, 5 циклов повторения, 125 килобайт)
3.3 Результаты эксперимента
Результаты эксперимента получены для трех случаев (табл. 3.1): пластины электродов разведены, пластины разведены наполовину и пластины разведены полностью.
Таблица 3.1 - Результаты эксперимента
| № опыта | Ток, А | Напряжение, В | Объем газов, мл/мин |
| Положение электродов А | |||
| 1 | 2 | 2,73 | 10,0 |
| 2 | 3 | 2,93 | 22,2 |
| 3 | 4 | 3,11 | 40,0 |
| 4 | 5 | 3,28 | 60,0 |
| Положение электродов Б | |||
| 1 | 2 | 2,62 | 12,0 |
| 2 | 3 | 2,73 | 25,0 |
| 3 | 4 | 2,84 | 40,0 |
| 4 | 5 | 2,93 | 66,7 |
| Положение электродов В | |||
| 1 | 2 | 2,59 | 6,0 |
| 2 | 3 | 2,69 | 25,0 |
| 3 | 4 | 2,78 | 33,3 |
| 4 | 5 | 2,84 | 50,0 |
Рассчитаем мощность тока и удельную мощность, которая расходуется на образование 1 мл газов, по формулам:

где: Vг – объем газов, выделившихся, мл
Результаты расчетов, занесем в таблицу (табл. 3.2)
Таблица 3.2 - Результаты расчетов
| № опыта | Ток, А | Напряжение, В | Объем газов, мл/мин | Мощность, Вт | Удельная мощность,Вт/мл |
| Положение электродов А | |||||
| 1 | 2 | 2,73 | 10,0 | 5,46 | 0,546 |
| 2 | 3 | 2,93 | 22,2 | 8,79 | 0,396 |
| 3 | 4 | 3,11 | 40,0 | 12,44 | 0,311 |
| 4 | 5 | 3,28 | 60,0 | 16,4 | 0,273 |
| Положение электродов Б | |||||
| 1 | 2 | 2,62 | 12,0 | 5,24 | 0,436 |
| 2 | 3 | 2,73 | 25,0 | 7,19 | 0,288 |
| 3 | 4 | 2,84 | 40,0 | 11,36 | 0,284 |
| 4 | 5 | 2,93 | 66,7 | 14,65 | 0,22 |
| Положение электродов В | |||||
| 1 | 2 | 2,59 | 6,0 | 5,18 | 0,863 |
| 2 | 3 | 2,69 | 25,0 | 8,07 | 0,323 |
| 3 | 4 | 2,78 | 33,3 | 11,12 | 0,334 |
| 4 | 5 | 2,84 | 50,0 | 14,2 | 0,284 |
3.4 Анализ результатов
В результате эксперимента получены зависимости выхода газов от силы тока (рис. 3.5) при различных положениях электродов относительно друг друга.
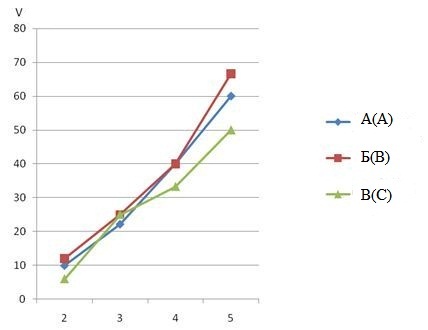
Рис. 3.5 - Зависимость выхода газов от силы тока
По графику зависимости выхода газов от силы тока можем сделать вывод, что чем больше сила тока, тем больше выход газов в каждом случае. Выход газа возрастает при возведении электродов до определенного положения относительно друг друга, а затем начинает падать. При сводных электродах с повышением силы тока от 2 до 3 ампер выход газов резко возрастает, однако с дальнейшим повышением силы тока скорость роста выхода газов уменьшается. Это можно объяснить тем, что на поверхности электродов появляется слой пузырьков, которые не успевают удаляться, тем самым уменьшается продуктивная площадь электродов.
Для определения оптимальных условий рассмотрим зависимость удельной мощности от силы тока. График зависимости удельной мощности от силы тока при разных положениях электродов относительно друг друга приведена на рисунке 3.6.
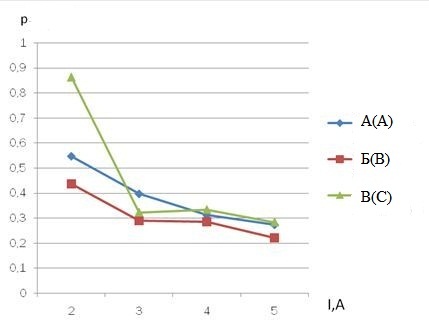
Рис. 3.6 - Зависимость удельной мощности от силы тока
С повышением силы тока удельная мощность уменьшается, т.е. уменьшается количество энергии, которую нужно затратить на получение 1 мл газов. Потребление большого количества энергии при положении электродов В и силе тока 2А может быть обусловлена существованием некоторого энергетического барьера, для преодоления которого нужно потратить дополнительное количество энергии.
Пропуская через электроды постоянный ток приходится тратить большое количество энергии на электролиз. Профессор Канарев в своей статье «Низкоамперный электролиз воды» от 28 декабря 2003г высказывает предположение, что если источник постоянного тока будет генерировать импульсы, то выход газов должен увеличится. [4] Поэтому была поставлена задача создать генератор, который будет генерировать импульсы заданной частоты в широком интервале.
За основу генератора была взята интегральная микросхема программируемого генератора LTC6904, которая генерирует квадратные импульсы. Управление микросхемой осуществляется с помощью аппаратной вычислительной платформы Arduino. Плата Arduino состоит из микроконтроллера Atmel AVR (ATmega328 и ATmega168 в новых версиях и ATmega8 в старых) и элементной обвязки для программирования и интеграции с другими схемами. Интегрированная среда разработки Arduino это кроссплатформений приложение на Java, включающий в себя редактор кода, компилятор и модуль передачи прошивки в плату. Среда разработки основана на языке программирования C / C++, дополненной некоторыми библиотеками и спроектирован для программирования новичками, не знакомыми близко с разработкой программного обеспечения.
Принципиальная схема установки приведена на рисунке 4.1. Установка состоит из генератора частот, силового каскада и электролизера. Принципиальная схема генератора частот приведена на рисунке 4.2.
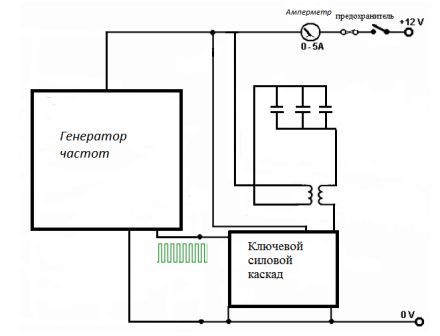
Рис. 4.1 - Принципиальная схема установки
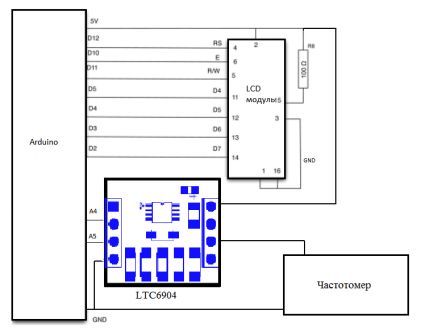
Рис. 4.2 - Принципиальная схема генератора частот
На данном этапе проводятся опыты с использованием импульсного блока питания, и ведется обработка и анализ полученных результатов
Список источников
- Основы процесса электролиза.[электронный ресурс]. – Режим доступа: http://studyport.ru
- Производство водовода. Материал из Википедии — свободной энциклопедии. [электронный ресурс]. – Режим доступа: http://ru.wikipedia.org/wiki/Производство водорода
- Водородная энергетика - CyberEnergy.ru - альтернативная энергетика. [электронный ресурс]. – Режим доступа: http://cyberenergy.ru/vodorodnaya/ (заглавие с экрана)
- Канарёв Ф.М. Начало физхимии микромира. Монография./ Ф.М. Канарёв, 15-е издание. – К.: Краснодар, 2010. – 487 с. [электронный ресурс]. – Режим доступа: http://www.micro-world.su
- Канарёв Ф.М. «ЭЛЕКТРОЛИЗ ВОДЫ» ,2010. [электронный ресурс]. – Режим доступа: http://www.micro-world.su
- Проблемы водородной безопасности. Кириллов И.А., Коробцев С.В. Доклад на Международной конференции «Альтернативные источники энергии для больших городов», Москва, 12-13 октября 2006 г.
- Костин Н. А. Импульсный электролиз /Н. А. Костин, В. С. Кублановский, А. В. Заблудовский, — К.: Наук. думка, 1989.— 168 с. [электронный ресурс]. – Режим доступа: http://mirknig.com/knigi/nauka_ucheba/1181445685-impulsnyy-elektroliz.html
- Князевский Б. А. Охрана труда в электроустановках /Б. А. Князевский, Т. П. Марусова, Н. А. Чекалнн, Н. В. Шипунов; под ред. Б. А. Князевского,— 3-е нзд. — М.: Энергоатомиздат, 1983.— 336 с.
