СПЕКТРОФОТОМЕТРИЧЕСКИЙ МЕТОД ИЗМЕРЕНИЯ РАЗЛОЖЕНИЯ КАТАЛАЗИРОВАННОЙ ПЕРЕКИСИ ВОДОРОДА
РОЛАНД Ф. БИИРС Мл., ИРВИН В. САЙЗЕР
Автор перевода: Павленко А.А.
(Факультет биологии, Массачусетский институт Технологий, Кембридж, Массачусетс)
(Получено для публикации 24 сентября 1951 г.)
Многие методы были разработаны для наблюдения за разложением катализированной перекиси водорода, но они не были достаточного количества материала или не были слишком быстротечны, чтобы предоставить над?жные данные в течение критических первой и второй минут реакции. Химические процессы, в которых остаточная перекись титрируется с перманганатом (1 – 3) или излишек перманганата измеряется колорометрически (4), являются правильными и точными за исключением реакционного периода, который длится меньше минуты, хотя Лемберг и Фоулкс (5) изобрели микрометод для получения данных каждые 10 секунд (см. также Огура и др. (6)). Впрочем, значительная изменчивость неизбежна, когда образцы должны быть собраны в такие короткие интервалы. Манометрический метод для измерения кислорода произош?л из системы, проверенной детальными исследованиями о непригодности для использования быстрого разложения перекиси, при которой процесс диффузии в среде жидкость-вода становится ограниченным. Это выражается изменениями в обеих средах порядка реакции и скорости изменения кислорода с колебаниями пиков реакционной смеси (7). Точное измерение перекиси водорода полярографией обеспечивает хорошие количественные данные в течение первой минуты реакции, которая соответствует кинетике реакции первого порядка (6). Вместе с тем, для таких измерений необходима специальная тщательно разработанная электронная цепь. Более того, как отметили Боннишен, Чэнс и Теорелл (8), этот метод, как оказалось, скорее, да?т меньшую величину для активности каталазы, чем осуществляет метод тетрирования.
|
Чэнсем и Гербертом были описаны предварительные эксперименты по исследованию распада перекиси водорода, которые наблюдались снижением световой абсорбции раствора перекиси в ультрафиолете (10). Возможности этого метода были исследованы и количественная, спектрофотометрическая техники для исследования разложения перекиси водорода были разработаны для обычных исследований каталазы.
ЭКСПЕРИМЕНТ
Спектрофотометрические изучения
Поскольку уменьшение поглощения ультрафиолетового излучения перекисью водорода в зависимости от периода времени будет использоваться для исследования реакции каталазы и перекиси, знание характеристики поглощения перекиси водорода является неотъемлемым. Спектр поглощения перекиси водорода. измеряемый от 200 до 400 м?, показан на Рис. 1. На любой длине волны в этом диапазоне возможно использовать светопропускание как измерение концентрации перекиси в соответствии с законом Биир-Ламберта. Продукты реакции, кислород и вода, не поглощают свет в этой спектральной области и не катализируют концентрацию (обычно 10-9 м); отсюда, поглощение в ультрафиолете – это точное измерение концентрации перекиси в системе реакции каталазы и перекиси. Если в системе содержатся другие вещества, которые поглощают ультрафиолет, погрешность в результате может быть минимизирована, используя длины волны, на которой поглощение иных компонентов являются минимумом в диапазоне от 200 до 300 м?, или при подготовке новой калибровочной кривой для перекиси, к которой было добавлено нужное количество иных абсорбирующих веществ.
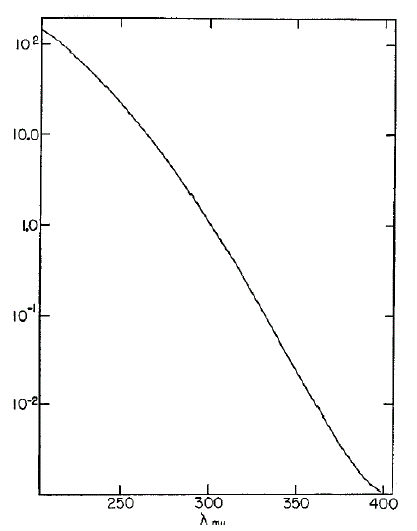
Рис.1 - Кривая поглощения ультрафиолета перекисью водорода в дистиллированной воде.
Неизвестная абсорбирующая примесь в системе реакции каталазы и перекиси будет выявлена не только за сч?т увеличения начальной оптической плотности, но и из-за явного изменения в скорости и порядке реакции. Для расчета константы скорости оптической плотности показаний, полученных на последовательных интервалах времени достаточно, и, в частности, может быть использован эксперимент на любой удобной длине волны, поскольку постоянная скорость реакции первого порядка не зависит от типа занятых единиц. Удобная начальная оптическая плотность – между 0.5 и 1.0. В спектральном диапазоне от 2100 до 2400 A можно использовать перекись в концентрациях от 5x10-4 до 3x10-2 М.
Материалы и аппаратура
Подготовка каталазы – кристаллы каталазы говяжьей печени (Worthington), помещ?нных в насыщенный раствор сульфата аммония растворяются диализом против 0,05 М фосфатного буфера с рН 7,0. Затем раствор янтарного цвета центрифугирую,т и аликвоты в супернатанте удаляются для кинетических исследований. При условии, что буфер не менее 0,05 М, финал концентрации 10-9 М каталазы достаточно стабилен при комнатной температуре, чтобы позволить шести до восьми последовательных кинетических проб, прежде чем наступает ощутимая инактивация.
Подготовка основания – примерно 5х10-3 M раствора перекиси подготавливается путем разбавления 0,15 мл тридцатипроцентного раствора перекиси водорода с 25 мл 0,05 М фосфатного буфера с pH 7.0.
В ультрафиолетовом спектрофотометре Бекмэна (модель DU) при контролируемой температуре используется монтажный блок и три комплекта охлаждения катушки, предоставленные Национальной Технической Лабораторией. Монтажный блок и охлаждающие катушки, прилегающие к фотометру, находятся в водопроводной воде близкой к комнатной температуре. Центральный катушек, прилегающий к кюветам, регулируются термостатом водяной бани до температуры ±0.1°. Четыре кварцевых 1-см кювета используются в каждом из трех кинетических испытаний.
Кюветы очищают суспензией оксида магния в дистиллированной воде с помощью ватного тампона, пропитанного в концентрированной азотной кислоте в течение 12 часов, затем тщательно промывают дистиллированной водой с последующей сушкой струей фильтрованного воздух или азота. Очищение спиртом неэффективно. До тех пор, пока не будут проводиться адекватные меры предосторожности, чтобы во время реакции предотвратить формирование пузырей кислорода на стенках кювета, будут происходить серьезные ошибки.
Особенно пузыри склонны формироваться, если распад перекиси водорода длится более тр?х минут, или если на поверхности кварцевых кюветов остаются следы грязи и жира.
Метод
В каждом из четырех кюветов пипеткой помещаются 2 мл. раствора буферизированной каталазы; в один, который служит в качестве контрольного, добавляется 1 мл буфера. Струна реохорда катушки устанавливается на оптическую плотность вблизи начального значения для перекиси водорода, и ширина щели регулируется согласно выбранной длине волны. Для обычных испытаний 2400 А была признана самой лучшей длиной волны. Переключатель установлен на уровне 1,0.
В начальный момент времени, 1,0 мл. буферизированной перекиси водорода продувается из пипетки в виде непрерывного потока непосредственно в раствор фермента в кювете. Это обеспечивает быстрое и полное перемешивание двух растворов через 2 – 3 секунды. Крышка быстро сменяется на корпусе кювета устройства и показания оптической плотности снимаются каждые 10 секунд (определ?нные заранее моменты данной техникой).
Таблица I
Сравнение в процентах стандартных отклонений хронометрического и наблюдательного методов исследования для измерения активности каталазы*
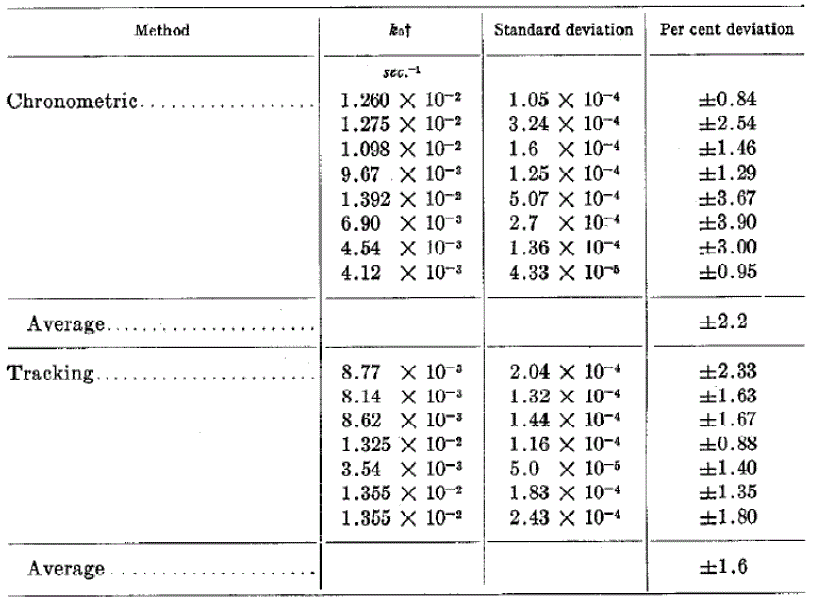
* Температура 20°; рН 7,0; 0,05 М фосфатный буфер
*Константы скорости были определены в среднем от шести последовательных кинетических исследований для каждого эксперимента. В трех случаях одно кинетическое испытание было исключено из среднего значения, потому что его отклонение в два раза больше стандартного.
Каталитический процесс должен быть под внимательным наблюдением, по крайней мере, до половины разрушения основания в целях облегчения расчета порядка и константы скорости. Та же процедура повторяется для двух других кюветов.
Два изменения вышеописанной спектрофотометрической методики были использованы специальные исследования каталазы. В хронометрических изменениях константы скорости первого порядка не учитываются возможные изменения в порядке реакции, произведенные путем ингибирования процессов. Половину времени реакции можно легко определить с помощью секундомера. Выбирается специальное значение оптической плотности и когда отметка на гальванометре проходит через нулевую отметку, начинается отсч?т на секундомере. Шкала оптической плотности ставится на половину первоначального показателя и часы останавливаются, когда нулевая отметка вновь достигнута. Константа скорости определяется коэффициентом (ln 2) / (необходимое время для прохождения половины спектра).
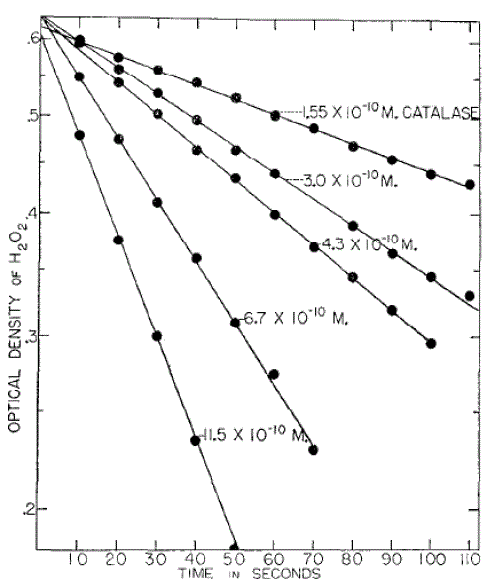
Кривая скорости разрушения перекиси водорода путем изменения концентрации каталазы (рН 7,0, 0,01 м фосфатный буфер, температура 25,5°, длина волны 240 м?, исходная концентрация перекиси водовода примерно 0,015 м).
Таблица I показывает сравнение результатов, полученных хронометрическим и наблюдательным методами. Широкая вариативность в стандартных отклонениях, наблюдаемая в прошлом методе, (0,88% к 3,90%) связана с (1) меньшим числом точек, определяемых константу скорости, (2) отклонения от норм первого порядка, вызванными ингибиторами, и (3) колебания спектрофотометра. Все три источника ошибки принимаются во внимание в наблюдательном методе, таким образом, позволяя рассчитать более точную скорость константы.
Таблица II
Экспериментальные и теоретические значения первого порядка константы скорости* с различной концентрации каталазы

*k0 = k8xE; k8 = 2x107 литров моль-1 сек-1. Е – молярная концентрация ферментов
Таблица III
Стандартны значения скорости каталазы говяжьей печени

Следовательно, в среднем стандартные отклонения ниже (1,6%), и показывают меньшие колебаниям, чем в хронометрическом методе.
Для реакции каталазы в кристаллизованной говяжьей печени следует использовать более широкий спектр ферментов и концентрацию перекиси (рис. 2, табл. II), и реакции первого порядка происходят дольше, чем период полураспада, если молярность буфера составляет 0,05 М. Кинетика (динамика), полученная спектрофотометрическим способом, такая же, как и полученная другими способами (5,8).
Таблица III представляет значения константы первого порядка, k0, полученной спектрофотометрическим методом, для порядка концентрации каталазы. Молярность каталазы была рассчитана от остановки коэффициента на 4050 А с помощью значения 340 см -1х мм-1 и для каталазы печени лошади, сообщили Боннишен (соавт.) (8). Довольно резкие колебания активности каталазы представлены в таблице III, они связаны с изменениями в стабильности фермента в различных препарата. Средний уровень константы скорости, k8, в расчете на 1 м каталазы 2 O ± 0,7 • 107 литров моль-1 с-1 и может быть по сравнению с 3,0 • 107 литров моль-1 с-1, говорит Боннишен (соавт.) (8) для каталазы печени лошадей.
Ряд экспериментов, выполненных в диапазоне температурах 11 – 35°; было использовано уравнение Аррениуса для вычисления энергии активации реакции каталазы с перекисью водорода. Энергия активации очень разнообразна и чувствительна к изменениям в ионной силе и к наличию небольшого количества ингибиторов (7, 11). В 0,005 М фосфатного буфера с рН 7.0, экспериментальная энергия активации в одной из серий экспериментов составляла 600 калорий, значение значительно превысило пределы погрешности (±100 калорий) применяемого метода. Эта энергия активации заметно ниже, чем значение сообщалось ранее (8, 12), и неопубликованные данные показывают, что предыдущие исследователи, возможно, имели дело с частично подавляемой каталазой, которая характеризуется гораздо высшей энергией активации (7). В случае каталазы, однако, измеренные энергии активации не имеют обычное значение, так как это результирующее влияние температуры на два разных процесса, а не на один.
ЗАКЛЮЧЕНИЕ
Простой, быстрый, количественный спектрофотометрический метод для воздействия каталазы на перекись водорода, основанный на измерении ультрафиолетового поглощения перекиси, подходит для исследования кинетики каталазы. С помощью этого метода распада перекиси водорода было обнаружено последовательность кинетики первого порядка при различных условиях и линейное увеличение концентрации каталазы. Скорости этой реакции при низкой ионной силе незначительно увеличивается с температурой, соответствующей энергия активации составляет 600 калорий.
БИБЛИОГРАФИЯ
1. Bach, A., and Zubkowa, S., Biochem. Z., 126, 283 (1921).
2. Hennicks, S., Biochem. Z., 146, 286 (1924).
3. von Euler, H., and Josephson, K., Ann. Chem., 452, 158 (1927).
4. Goldblith, S. A., and Proctor, B. E., J. Biol. Chem., 187, 705 (1950).
5. Lemberg, R., and Foulkes, E. C., Nature, 161, 131 (1948).
6. Ogura, Y., Tonomura, Y., Hino, S., and Tamiya, H., J. Biochem., Japan, 37, 153(1950).
7. Beers, R. F., Thesis, Massachusetts Institute of Technology (1951).
8. Bonnischen, R. K., Chance, B., and Theorell, H., Acta &em. Scand., 1,685 (1947).
9. Chance, B., J. Biol. Chem., 179, 1299 (1949).
10. Chance, B., and Herbert, D., Biochem., J., 46, 402 (1950).
11. Agner, K., and Theorell, H., Arch. &o&em., 10, 321 (1946).
12. Sizer, I. W., J. Biol. Chem., 164,461 (1944).
|
|
|