Сагайдак И.С.
ОПРЕДЕЛЕНИЕ НИТРАТОВ В ПРИРОДНОЙ ВОДЕ
Донецкий национальный технический университет
В данном докладе рассматриваются нитратомеры- приборы для измерения концентрации нитратов в воде, а также методы, с помощью которых реализуются работа этих приборов.
Ключевые слова: нитрататы, концентрация, нитратомер, потенциометрческий метод.
This report examines the nitrate- devices for measuring the concentration of nitrates in the water, as well as the methods bywhich the realized performance of these devices.
Keywords: nitrataty, concentration, nitrate, potentsiometrcheskymethod.
Актуальность. Качество среды жизни и состояние здоровья человека, его трудоспособность и продолжительность жизни определяется в первую очередь качеством атмосферного воздуха, питьевой воды и потребляемой пищи. Охрана здоровья человека становится актуальной задачей современности. В результатеантропогенной деятельности человечество все больше отдаляет себя от природы и условий, которые способствовали формированию в процессе эволюции адаптационных механизмов организма. Человек становится заложником технического прогресса, испытывая давление иных, созданных им самим условий.
Вода - ценнейший природный ресурс. Она играет исключительную роль в процессах обмена веществ, составляющих основу жизни. К одним из основных и наиболее опасных загрязнителей водных источников относятся нитраты. При длительном употреблении питьевой воды и пищевых продуктов, содержащих их значительные количества (от 25 мг/дм3 по азоту и выше), они могут оказывать токсическое действие. Избыточное количество нитратов вызывает не нормальный ход функционирования природных экосистем и живых организмов, происходит снижение биологической ценности продукции и возрастает негативное воздействие на человека и животных.[6]
Постановка задачи.
Определить процентное содержание нитратов в природной воде, с помощью автоматизированного определения и оценки количественного содержания нитратов в воде.
Разработать структурную схему измерительного канала нитратов в природной воде.
Основная часть.
Объектом контроля являются водоемы нашего региона, такие как: река Кальмиус, канал «Северский Донец-Донбасс», водохранилища, из которых берется вода и на технические нужды, и на производство питьевой воды.
Одной из причин загрязнения питьевой воды является рост городов, который приводит как к повышению водопотребления, так и к увеличению количества сточных вод. Промышленные и сельскохозяйственные предприятия сбрасывают в реки загрязняющие вещества. В результате в природных водах уменьшается количество растворённого кислорода, ухудшаются условия разложения органических веществ, которые интенсивно накапливаются, увеличивается концентрация азота, фосфора, различных металлов, хлорорганических и других вредных соединений. Нитраты - соли азотной кислоты. В результате деятельности бактерий в водоемах аммонийные ионы могут переходить в нитрат-ионы, кроме того, во время гроз некоторое количество нитратов возникает при электрических разрядах – молниях. Повышенное содержание нитратов в поверхностных водоемах ведет к их зарастанию, азот, как биогенный элемент, способствует росту водорослей и бактерий. Это называется процессом эвтрофикации. [1]
Процесс этот весьма опасен для водоемов, так как последующее разложение биомассы растений израсходует весь кислород в воде, что, в свою очередь, приведет к гибели фауны водоема.
Азотосодержащие вещества входят в состав удобрений (нитраты NO3-, нитриты NO2- и аммонийные соли NH4+) почти всегда присутствуют во всех водах, включая подземные, и свидетельствуют о наличии в воде органического вещества животного происхождения. Являются продуктами распада органических примесей, образуются в воде преимущественно в результате разложения мочевины и белков, поступающих в неё с бытовыми сточными водами. [2]
По нормам СанПиН ПДК в воде нитритов - 0,5 мг/л; нитратов - 50,0 мг/л.
Загрязнение воды нитратами может быть обусловлено как природными, так и антропогенными причинами. Наибольшие концентрации нитратов обнаруживаются в поверхностных и приповерхностных подземных водах, наименьшие – в глубоких скважинах. Очень важно проверять на содержание нитратов воду из колодцев, родников, водопроводную воду, особенно в районах с развитым сельским хозяйством. Различают первичную токсичность собственно нитрат-иона; вторичную, связанную с образованием нитрит-иона, и третичную, обусловленную образованием из нитритов и аминов нитрозаминов. Смертельная доза нитратов для человека составляет 8-15 г. При длительном употреблении питьевой воды и пищевых продуктов, содержащих значительные количества нитратов, возрастает концентрация метгемоглобина в крови. Снижается способность крови к переносу кислорода, что ведет к неблагоприятным последствиям для организма, подавляется кроветворная функция, особенно у детей.
Под воздействием нитратов (выше 44,6 мг/л) снижается артериальное давление, повышается риск заболеваний хроническими нефритами и гепатитами. Однако повышенное содержание нитратов в воде опасно для здоровья не только детей, но и взрослых. Это связано с ролью нитратов в синтезе нитрозаминов и нитрозамидов, которым свойственно мутагенное и канцерогенное действие и как следствие - повышению онкологической заболеваемости населения. Также повышенное содержание нитратов может являться первопричиной высокой мертворождаемости, токсикозов при беременности, врожденных аномалий развития. [5]
Количество нитратов в природных водах определяется воздействием комплекса факторов (биологические, гидрохимические, геоморфологические, климатические, физико-химические свойства почв водосборной территории).
Содержание нитратов в природных водах в зависимости
от источника загрязнения
Вид природных вод |
Условия загрязнения |
1^0а-, мг/л |
Поверхностные воды |
Естественное |
0,431.33 |
|
Сельскохозяйственное производство |
2.66-26,12 |
|
Бытовые стоки |
3.54219,6 |
Дренажные воды |
Естественное |
4.438.86 |
|
Сельскохозяйственное производство |
19.4958.48 |
|
Осушительная мелиорация |
2.21-124,04 |
|
Орошение |
0.6635,6 |
|
Удобрение пастбищ |
7,72-44.а |
Грунтовые воды |
Естественное |
0,4031.91 |
|
Сельскохозяйственное производство |
0.4475,31 |
|
Глубинные подземные |
0-0.71 |
Концентрация нитратов в этих водах может превышать 120 мг/л. В естественных (природных) условиях количество их не превышает 9 мг/л. Наибольшее количество (свыше 200 мг/л) нитратов находится в бытовых стоках и в стоках животноводческих комплексов. Существенному повышению количества нитратов в природных водах способствуют азотные удобрения.[7]
Существуют различные методы и средства, с помощью которых можно определить содержание нитратов в воде. На сегодняшний день существуют известны: фотометрический, гравиметрический, титриметрический, потенциометрический, манометрический. В аналитической химии известно несколько методов качественного определения нитратов и нитритов в растворе.
Потенциометрический метод анализа является одним из наиболее эффективных способов определения содержания в воде неорганических веществ.
Потенциометрический метод - это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом. Этот метод анализа основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. В идеальном случае измерительный электрод избирательно (селективно) реагирует на определенный ион (или группу ионов), а его потенциал зависит от содержания этих ионов в растворе и подчиняется уравнению Нернста(1).
![]()
где:
а - активность анализируемых ионов в растворе;
S - крутизна электродной функции (2.3 RT/nF).
Прямая потенциометрия.
Метод основан на установлении зависимости потенциала измерительного электрода от концентрации раствора (построение калибровочного графика или настройка измерительного прибора) и последующим ее использовании для анализа растворов неизвестной концентрации. Метод достаточно прост и экспрессен. Наиболее широко применяется для измерения рН. Точность метода зависит, в первую очередь, от типа измерительного электрода. Так для рН-электродов достижима точность 0,01 рН и выше, а для ионоселективных электродов принято оценивать погрешность величиной 4% для однозарядных ионов и 8% для двухзарядных.
Точность измерений так же заметно зависит от степени отклонения крутизны электродной функции от теоретического значения. Поэтому крутизна электродной функции является показателем качества электрода. Реальная крутизна электродной функции обычно равна или несколько ниже теоретического значения, превышение ее над теоретической величиной чаще всего говорит об ошибке эксперимента. Следует помнить, что со временем, по мере выработки ресурса электрода, крутизна снижается, и погрешности измерений возрастают.
Достоинством и недостатком метода одновременно является то, что измеряемый потенциал зависит от активности. Это единственный метод прямого определения активности ионов в растворах. Но с другой стороны аналитиков чаще интересует концентрация, а пересчет активности ионов в концентрацию с применением эмпирических коэффициентов активности вызывает некоторую дополнительную погрешность.
Существует вариант метода, в котором в калибровочные и анализируемые растворы вводится индифферентный электролит. Это позволяет проводить калибровку и последующий анализ в единицах концентрации.
Потенциометрический, или ионометрический, метод определения концентрации – это метод, в котором используются электроды, потенциал которых зависит от содержания каких-либо ионов в растворе. Чаще всего на практике используют пару электродов, один из которых имеет постоянную величину потенциала (электрод сравнения). А в качестве ионоселективного используется электрод, потенциал которого зависит от концентрации того или иного иона в растворе. Для определения концентрации иона замеряют величину ЭДС, по которой затем рассчитывают концентрацию ионов в растворе. Либо заранее строят калибровочный график зависимости ЭДС от активности иона и по нему определяют искомую концентрацию.
В настоящее время существуют приборы, шкала которых при использовании данной пары электродов уже откалибрована на концентрацию определяемого иона. Примером такого прибора может служить нитратомер, рН-метр, прибор для измерения концентрации СО2. В данной работе для определения содержания нитрат-ионовNO3 - был использован иономер рХ-150.1МИ.
В качестве измерительного электрода применяется мембранный ионоселективный электрод ЭЛИС-121NO3, в качестве электрода сравнения - хлорсеребряный электрод ЭСр-10103/3,5.[11]
С целью определения содержания нитратов в воде разработаны специальные приборы - нитратоанализаторы,предназначенные для определения активности и концентрации ионов NO-3, а также температуры воддных проб растительной, пищевой продукции, почв, природных и сточных вод. Имеет хорошие метрологические характеристики, простота и надежность, не высокая стоимость. Они способны за несколько секунд сделать необходимый анализ, показав реальное содержание нитратов в анализируемой среде.
Для них характерно применение потенциометрического метода анализа, который основывается на измерении разности потенциалов двух электродов измерительного и вспомогательного, помещенных в измеряемый раствор. Используется зависимость этой разности потенциалов от состава анализируемого раствора.
Нитратомеры смогут формировать унифицированные сигналы с дальнейшей их передачей по стандартизированным протоколам к контроллеру и на операторские пульты.
На основании этого метода разработана структурная схема (рис.1):
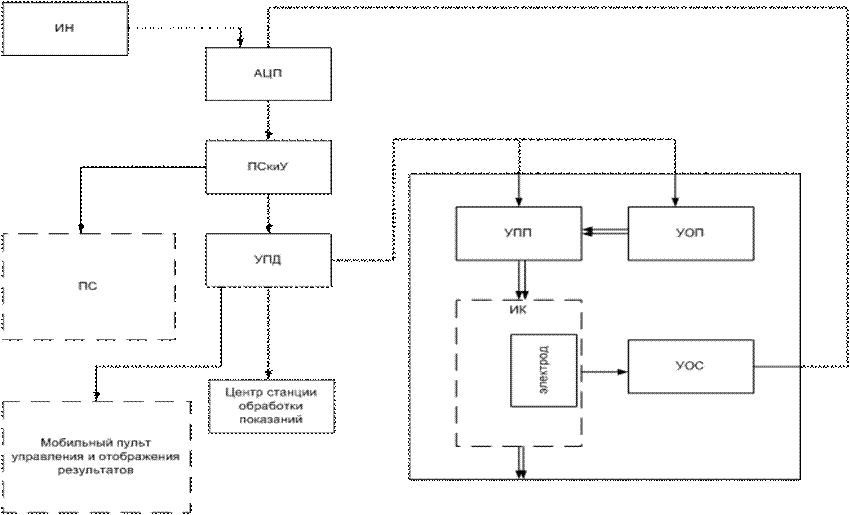
Рис. 1. Структурная схема
Сама система многоканальная, выделяем один из каналов.
На рисунке обозначено:
ИК- источник напряжения;
АЦП- аналого-цифровой преобразователь;
ПСкиУ- процессорное средство контроля и управления;
УПП- устройство пробоподготовки;
УОП- устройство отбора проб;
УОС- устройство отображения сигнала;
ИК- измерительная кювета;
ПС- программное средство;
УПД- устройство передачи данных;
Выводы.
Поверхностные источники характеризуются большими колебаниями качества воды и количества загрязнений в отдельные периоды года. Качество воды рек и озер в большей степени зависит от интенсивности выпадения атмосферных осадков, таяния снега, а также от загрязнения ее поверхностными стоками и сточными водами городов и промышленных предприятий. [3]
Нитраты присутствуют и в природных водах, являясь продуктом аэробного (происходящего в среде, содержащей кислород) окисления органических азотосодержащих веществ в водоемах.[4]
Сейчас качество воды оценивают не за экологическими показателями, а за наличием в ней минеральных и органических веществ. Загрязнение водоемов разделяют на биологическое и антропогенное.
В соответствие с поставленной целью сформулированы основные требования и получена укрупненная структурная схема. Показана актуальность этой разработки, исходя из анализа экологической безопасности окружающей среды. Также, рассмотрены и учтены стандартные методики и некоторые технические средства.
Литература.
1. http://vostokaqua.com.ua/water/172-issledovanie-vody
2. http://www.milkon-nt.ru/kachestvo_vody
3. http://arhivknig.com/raznoe/3289-n.n.abramov-vodosnabzhenie.html
4. http://chuguevsovet.at.ua/news/chem_opasny_nitraty/2011-01-30-165
5. http://dolphin.dp.ua/naibolee-vazhnye-ximicheskie-pokazateli-kachestva-vody
6.http://www.cawater-info.net/bk/water_land_resources_use/docs/hydrochem2.html
7. http://free-referat.ru/referats/ekologia/id5227/page12/
8.Фомин Г.С. Вода. М.: Протектор, 2000 848 с.
9. Клячков В.А., Апельцин И.Э. Очистка природных вод. М.: Стройиздат. 1971. 579 с.
10. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Просвещение, 1975;
11. Мидгли Д., Торренс К., «Потенциометрический анализ воды», Мир, 1980.