Назад в библиотеку
Разработка информационной модели компьютеризированной системы учета качества медицинских препаратов
Автор: Лабинская Д.Е., Блощицкий В.П.
Источник: Інформаційні управляючі системи та комп’ютерний моніторинг (ІУС КМ-2011) / Матерiали II міжнародної науково-технiчної конференцiї студентiв, аспiрантiв та молодих вчених. – Донецьк, ДонНТУ – 2011, Том 3, с. 28–32.
Аннотация
Лабинская Д.Е., Блощицкий В.П. Разработка информационной модели компьютеризированной системы учета качества медицинских препаратов. Рассмотрена классификация некачественных медицинских препаратов. Определены способы учета количества некачественных препаратов по результатам инспекционных проверок.
Построена логическая модель данных.
Общая постановка проблемы
Обеспечение населения Украины качественными безопасными и доступными
лекарственными средствами – один из приоритетов национальной лекарственной политики.
Ее реализация во многом зависит от качества работы государственных органов в сфере
контроля качества лекарственных средств, которые призваны защитить пациента от
субстандартной и фальсифицированной продукции [1].
В настоящее время население Украины обеспечено лекарствами как отечественного,
так и зарубежного производства по всем нозологиям болезней. Но необходимо пристальное
внимание к фармацевтической отрасли. На первый план выносятся проблемы качества,
эффективности, безопасности и экономической доступности лекарственных препаратов. В
последнее время доля отечественных лекарственных средств на внутреннем рынке
постепенно растет, улучшается их качество. Однако отсутствие на большинстве
отечественных предприятий системы контроля качества лекарственных средств, которая бы
отвечала требованиям надлежащей производственной практики, риск выпуска ими
субстандартной продукции остается достаточно высоким. Еще одной весьма серьезной
проблемой является определение поддельной продукции. Как правило, поддельные
лекарства за качеством, безопасностью и эффективностью не являются равноценными
оригинальным аналогам. Даже когда они имеют надлежащее качество или содержат
необходимое количество активного вещества, их производство и распространение находятся
вне сферы деятельности контролирующих органов.
Государственной инспекцией по контролю качества (ГИКК) лекарственных средств
МОЗ Украины ведется постоянный контроль соблюдения требований хранения медицинских
препаратов, сроков их годности, соответствия упаковки лекарственных средств требованиям
действующего законодательства, а также следит за динамикой продаж, проверок,
соотношением качественных и некачественных препаратов. При выявлении в обращении
лекарств, не соответствующих установленным требованиям, Государственная Служба
выдает соответствующие распоряжения об изъятии из обращения определенного
наименования препарата или отдельной серии [2].
На основе протоколов инспекционных проверок разработаем информационную
модель компьютеризированной системы учета качественных и некачественных медицинских
препаратов за определенный период времени.
Анализ существующих моделей
В настоящее время в ГИКК используется программное обеспечение, позволяющее
вести базу данных протоколов проверок с сохранением отчета в виде Excel-файла, что не обеспечивает достаточную гибкость в работе. К тому же типы несоответствия
некачественных препаратов (будут рассмотрены ниже) не определяются автоматически, а
вносятся оператором базы данных.
Исследования
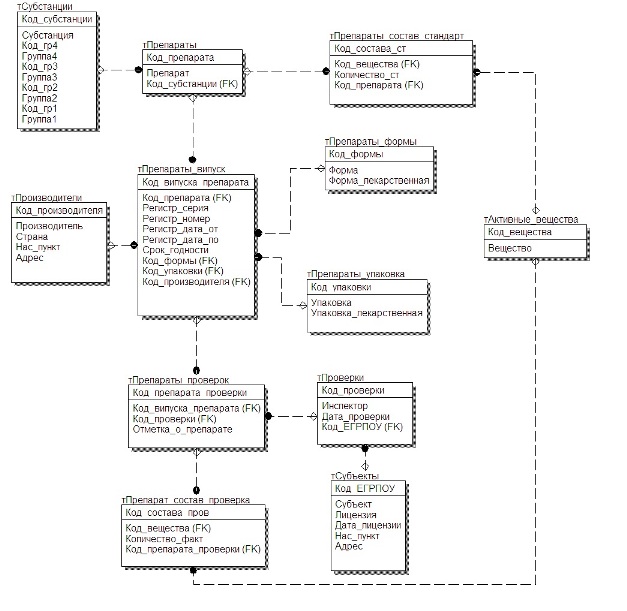
Для выполнения поставленной задачи, была разработана логическая модель данных,
в которой содержится информация о субъектах проверки, о препаратах, о производителях, о
составе препаратов, согласно классификации АТС, о форме выпуска и т.п. Данная модель
была разработана на основе протоколов инспекционных проверок [4].
Рисунок 1 – Логическая модель данных
Сущности тСубстанции, тПрепараты_форма, тПрепараты_упаковка, тАктивные_вещества являются справочными. тСубстанции содержит сведения по АТС классификации.
Классификационная система АТС – система разделения лекарственных препаратов
на группы в зависимости от их действия на определенный анатомический орган или систему,
а также от их химических, фармакологических и терапевтических свойств.
Лекарственные препараты классифицируются по группам 5 различных уровней.
1-й уровень указывает на анатомический орган или систему органов и имеет
буквенный код. Каждая группа первого уровня имеет подчиненные группы второго уровня.
Группы 2-го уровня имеют трехзначный буквенно-цифровой код. Пример подгрупп второго уровня для группы А:A01 Стоматологические препараты.
Группы 3-го уровня имеют четырехзначный код, группы 4-го уровня – пятизначный
код. Пример подгрупп 3 и 4 уровня для группы А02:A02A Антациды, A02AA Препараты магния
Пятый уровень ATC классификации указывает на определенное вещество. Пример
групп пятого уровня для группы A02BA:A02BA Блокаторы гистаминовых H2-рецепторов[3]. Для каждого препарата есть характерная субстанция из АТС.
тАктивные_вещества содержит сведения об активных веществах препарата, которых
может быть несколько. Действующее (активное) вещество – химическое вещество или
уникальная биологическая субстанция в составе лекарственного средства, с
физиологическим действием которой на организм связывают лечебные свойства данного
препарата. Именно по их наличию будет проводиться анализ соответствия медикамента
заявленному стандарту.
тПрепараты_форма и тПрепараты_упаковка хранят данные об общепринятых
сокращениях лекарственных форм и упаковок, а также их полных названий, например: амп. –
ампулы [5].
Выше упоминалось о несоответствии препаратов, которое может быть следующим:
- фальсифицированные препараты – лекарственные средства, преднамеренно и
противоправно снабженные этикеткой, неверно указывающей достоверность препарата или
производителя;
- незарегистрированные – не прошедшие регистрацию или перерегистрацию;
- субстандартные лекарственные средства – препараты, изготовленные легальным
производителем с правильной маркировкой, но которые при отсутствии надлежащих
условий производства, транспортировки и хранения потеряли соответствие установленным
требованиям нормативных документов.
Незарегистрированные медицинские средства будут вычисляться по проверке
значений полей из таблицы тПрепараты_выпуск:
- Регистр_серия и Регистр_номер не должны быть пустыми;
- Регистр_дата_до - Регистр_дата_от = 5;
- тПрепараты_выпуск.Регистр_дата_до > тПроверки.Дата_проверки.
Каждое лекарственное средство подвергается внешнему осмотру: проверяются
условия хранения препаратов (температура, влажность, защищенность от солнечного света),
упаковка (форма, размер, материал, содержание упаковки, маркировки). После распаковки
контейнера проверяется лекарственное средство относительно формы выпуска, цвета,
запаха, массы и т.д., а также сопровождающие документы. При сопоставлении номера серии
и регистрационного номера с информацией Министерства здравоохранения, ГИКК
необходимо убедиться, не был ли прекращен выпуск этих лекарственных препаратов либо
продажа этих серий и т.д [1]. Все найденные нарушения должны быть зафиксированы. В
нашей модели данных для этого есть поле Отметка_о_препарате в таблице
тПрепараты_проверок. Это поле можно оформить в виде списка с наиболее часто
встречающимися нарушениями, например: отсутствует маркировка, упаковка повреждена,
нечеткая надпись и т.п. Таким образом, если поле непустое, то препарат является
субстандартным. Также, к данному типу несоответствия относятся просроченные препараты,
которые вычисляются:
тПрепараты_выпуск.Срок_годности > тПроверки.Дата_проверки.
Если в результате такого тестирования сделан вывод, что лекарственное средство не
соответствует стандартам, реализацию нужно приостановить.
Для учета фальсифицированных медицинских препаратов из таблиц
тПрепараты_состав_стандарт и тПрепарати_состав_проверка сравнивается наличие
активных веществ, а также их количество.
Особое внимание при проверке уделяется составу препарата.
Математическая постановка задачи
Для оценки качества используется относительная погрешность. При проверке может оказаться, что действующее вещество не соответствует установленному стандарту. Однако,
если это соответствие незначительно, можно ли считать, что препарат некачественный?
Определим некоторый критерий:

j – лекарственный препарат;
i – действующее вещество;
Зij – заявленное по стандарту количество действующего вещества;
Фij – фактическое количество действующего вещества, полученного при проверке.
Данный критерий сравнивается с некоторым допустимым для данного вещества
отклонением Oj (имеются нормы допустимых отклонений при изготовлении лекарственных
средств [6]).
При Kj < Oj вещество будет считаться качественным.
Выводы
Полученная логическая модель данных может быть использована для разработки
компьютеризированной системы учета качества медицинских препаратов и реализоваться в
любой системе управления базами данных. Такая информационная модель значительно
упростит действия оператора баз данных. При необходимости, можно получить отчет за
любой период о количестве некачественных препаратов, их производителе, группе веществ,
составить статистику по выявлению нарушений у отдельных субъектов проверок. Данная
модель легко может быть расширена и дополнена.
Список использованной литературы
1. Аптека [сайт]/Интернет-ресурс. – Режим доступа:http://www.apteka.ua.
2. Ваше здоровье [сайт]/Интернет-ресурс. Медицинское издание. – Режим
доступа: http://spregnant.ru/med/46-05/2.htm.
3. Компендиум [сайт]/ Интернет-ресурс. – Режим доступа: http://www.compendium.com.ua/atc.
4. Аптека [сайт]/ Интернет-ресурс. – Режим доступа: http://www.apteka.ua/article/75644.
5. Практическое руководство по антиинфекционной химиотерапии. [сайт] / Интернет-ресурс. – Режим доступа: http://www.antibiotic.ru/ab/abbr_frm.shtml.
6. Нормативные документы [Электронный ресурс] / Интернет-ресурс. – Режим доступа: www.businesspravo.ru/Docum/DocumShow_Docu