Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Характеристика стічних вод
- 2. Методи очищення стічних вод
- 3. Стадії очистки стічних вод промислових підприємств
- 4. Коагуляція та флокуляція
- 4.1 Характеристика коагулянтів і флокулянтів
- 4.2 Види коагулянтів і флокулянтів
- 4.3 Змішання реагентів з водою
- 5. Лабораторний експеримент
- Висновки
- Перелік посилань
Вступ
Очищення стічних вод — одна з найважливіших проблем коксохімічної промисловості.
На більшості коксохімічних підприємств для очищення стічних вод від фенолів використовують метод біохімічної очистки, залишковий вміст фенолів після якої становить 4 — 5 мг/л, що значно перевищує ГДК (0,001 мг/л). Тому розробка ефективного методу очищення стічних вод коксохімічних підприємств представляється завданням державної ваги.
Вода після БХУ, що йде на гасіння коксу, не відповідає санітарним нормам за показниками: вміст фенолів, аміаку, роданидов, кількості активного мулу та ін. Доведення показників води до норми є важливою і технічно складною проблемою.
За допомогою літературного аналізу можно зробити висновок, що одним з найбільш ефективних способів доочищення стічних вод є їх обробка коагулянтами і флокулянтами, але існують інші способи доочищення, наприклад, за допомогою твердих вуглецевих адсорбентів.
Очищення вод методом коагуляції, флокуляції та адсорбентами стічних вод дозволить вирішити важливу соціальну проблему — суттєво зменшити негативний вплив пароподібних викидів при гасінні коксу на здоров’я працівників і мешканців довколишніх до підприємств районів. Це дозволить суттєво зменшити кількість лікарняних листів, витрати на лікування і відновлення здоров’я працівників, а так само змінити негативне ставлення до діяльності підприємства.
1. Характеристика стічних вод
Забруднення водних джерел включає в себе будь‑які зміни фізичних, хімічних, біологічних властивостей води у водних об’єктах, обумовлених скиданням в них твердих, рідких та газоподібних речовин, які заподіюють або створять проблеми, що роблять воду небезпечною для споживання, завдаючи шкоди діяльності людини, здоров’ю людини та екологічної безпеки населення.
Забруднюючі речовини, потрапляючи у водні об’єкти, викликають якісні зміни, які виявляються в зміні фізичних і хімічних властивостей води (поява запаху, неприємного присмаку та ін.).
Промислові стічні води як правило забруднені викидами і відходами виробництва. Якісний кількісний і склад даних стічних вод різний і залежить від галузі промисловості та виробничих процесів.
Особливо небезпечним забруднюючим речовиною є фенол. Фенол присутній у стічних водах більшості нафтопереробних і коксохімічних підприємств. У присутності фенолів значно знижуються біологічні процеси водних об’єктів, процес самоочищення, вода набуває досить неприємний запах.
У коксохімічної промисловості обсяг стічних вод, забруднених відходами виробництва, складає близько 38% від кількості коксованої сухий шихти. Приблизно 30% з них становлять надсмольні води після виділення з них аміаку і летких фенолів. Майже на всіх коксохімічних заводах працюють пароціркуляційні обесфенолівальні установки, на яких переробляється близько 10 млн. м3/рік надсмольної води і виходить понад 10 тис. т фенолів. У стічній воді після цих установок залишається ще 150 — 400 мг/л летючих фенолів і практично вся кількість нелетких фенолів (~360 мг/л). Значно краще надсмольна вода знефенолівается екстракційним методом, який отримав широкий розвиток за кордоном[1].
Уявлення про склад загального стоку коксохімічного заводу та його окремих складових дає табл. 1.
Таблиця 1 — Приблизний склад води подається на гасіння коксу
| Забруднюючі речовини | Кількості забруднюючих речовин до очищення, мг/л |
| Феноли | 220 |
| Ам. Летючий | 68 |
| Сірководень | 87 |
| Роданіди | 31 |
| Зв’язаний аміак | 1495 |
Крім даних зазначених у таблиці 1, стічні води містять смоли, масла і зважені частинки, тому на більшості заводів здійснюють відстій. На деяких заводах встановлені кварцові фільтри, які ефективно вилучають смолисті речовини з надсмольной води, і флотаційні установки для знешкодження стічних вод, а також біологічні установки для знешкодження стічних вод.
Робота біологічних установок ускладнена різкими коливаннями складу стічних вод, в результаті залпових скидів в них продуктів і відходів виробництва, а також в окремих випадках недосконалістю застосовуваної технології.
Кількість стічних вод може бути значно зменшено шляхом проведення низки організаційно-технічних заходів, в першу чергу сушіння шихти, впровадження вогневого підігріву поглинальне масла в бензольних відділеннях, упорядкування скидання чистих вод, а також шляхом використання окремих складових загального стоку в оборотних системах технічного водопостачання заводу[2].
2. Методи очищення стічних вод
Очищення стічних вод проводиться з метою усунення шкідливих і небезпечних властивостей, які можуть призвести до згубних наслідків у навколишньому середовищі. Застосування різних технологій очищення спрямоване на нейтралізацію, знешкодження або утилізацію цінних компонентів. Таким чином, вибір технології очищення та обладнання залежить в першу чергу від властивостей стічних вод і їх відхилень від властивостей природних вод. Іншими словами, вибір методу очищення стоків залежить від шкідливих факторів (ШФ), якими володіє стічна вода.
В якості шкідливих факторів можуть виступати не тільки токсичні речовини — нафтопродукти, ПАР, іони важких металів, але й такі узагальнені показники, як агресивність середовища, загальна жорсткість (вище допустимої), вміст амонійного азоту, окислюваність та ін.
Щоб мінімізувати ці проблеми, зважені частинки, як правило, необхідно усунути або зменшити до прийнятного рівня перед використанням.
Великі частинки можуть бути легко видалені механічним шляхом фільтрації або відстоюванням. Більш дрібні частинки, також відомі як колоїдні частинки, видалити важче і необхідна фільтрація або осадження[3].
Наявність у стічній воді шкідливих факторів визначається з аналізу характеристик води. Кожному ШФ може відповідати група показників, тобто наявність у воді ШФ може визначатися декількома характеристиками, і в разі відсутності у воді якийсь характеристики відсутня і ШФ.
Шкідливі фактори стічних вод зручно виділити в класи і кожному класу зіставити один або групу показників, які б однозначно визначали цей клас. Цю групу показників будемо називати ідентифікатором класу ШФ.
Аналіз численних літературних джерел дозволив виявити кілька класів ШФ і безліч методів, здатних знешкоджувати ці класи. Список деяких виявлених класів ШФ, їх ідентифікатори та групи методів знешкодження дані у таблиці 2.
Таблиця 2 — Типи забруднюючих речовин у стічних водах і методи очищення
| Тип забруднюючих речовин | Група забруднень | Методи очищення стічних вод |
| Грубодисперсні завислі речовини | Зважені речовини з розміром частинок більше 0,5 мм | Просіювання |
| Первинне відстоювання без реагентів | ||
| Фільтрація | ||
| Грубодисперсні емульговані частки | Краплинні забруднення, органічні речовини, не змішуються з водою | Гравітаційна сепарація |
| Фільтрація | ||
| Флотація | ||
| Електрофлотація | ||
| Мікрочастки | Зважені речовини з розміром частинок більше 0,01 мм | Фільтрація |
| Коагуляція | ||
| Флотація | ||
| Напірна флотація | ||
| Стабільні емульсії | Нафтопродукти в кількості > 5мг/л, речовини, що екстрагуються сірчаним ефіром | Тонкошарова седиментація |
| Напірна флотація | ||
| Електрофлотація | ||
| Колоїдні частинки | Розмір частинок від 0,1 до 10 мкм | Мікрофільтрація |
| Електрофлотація | ||
| Агресивність середовища | pH, загальна лужність, загальна кислотність | Нейтралізація |
| Масла | Концентрація масел більше 10мг/л | Гравітаційна сепарація |
| Флотація | ||
| Електрофлотація | ||
| Феноли | Концентрація фенолів 0,5 — 5 мг/л | Біологічне очищення + озонування |
| Сорбція на активованому вугіллі | ||
| Концентрація фенолів 5 — 500 мг/л | Біологічна очистка | |
| Флотація + Біологічна очистка | ||
| Коагуляція + озонування | ||
| Високий вміст органічних домішок | Біологічна очистка | |
| Хімічне окислення (озон) | ||
| Сорбція на активованому вугіллі | ||
| Іони важких металів | Концентрації Cu2+, Zn2+, Ni2+, Feобщ,Cd2+ 5 — 100 мг/л | Електрофлотація |
| Реагентний + відстоювання | ||
| Електродіаліз | ||
| Електрокоагуляція | ||
| Ультрафільтрація | ||
| Іонний обмін | ||
| Ціаніди | Концентрація CN− 1 — 10 мг/л | Хімічне окислення |
| Електрофлотація | ||
| Електрохімічне окислення | ||
| Хром (VI) | Концентрація Cr6+ 1 — 100 мг/л | Хімічне відновлення + електрофлотаціі |
| Електрохімічне відновлення | ||
| Електрокоагуляція | ||
| Хром (III) | Концентрація Cr3+ 5 – 100 мг/л | Електрофлотація |
| Осадження + Фільтрація | ||
| Концентрація Cr3+ 0,5 — 5 мг/л | Іонний обмін | |
| Ультрафільтрація | ||
| Сульфати | Концентрація (SO4)2- > 2000 мг/л | Реагентний + відстоювання +Фільтрація |
| Вакуумне випарювання | ||
| Концентрація (SO4)2- < 2000 мг/л | Нанофільтрація | |
| Зворотний осмос | ||
| Хлориди | Концентрація Cl− > 300 мг/л | Зворотний осмос |
| Вакуумне випарювання | ||
| Електродіаліз | ||
| Загальне солевміст | Нанофільтрація | |
| Зворотний осмос | ||
| Вакуумне випарювання | ||
| Електродіаліз | ||
| Поверхнево-активні речовини | Аніонні і неіоногенні ПАР | Флотація |
| Електрофлотація | ||
| Сорбція на активованому вугіллі | ||
| Аніонні, катіонні і неіоногенні ПАР | Ультрафільтрація | |
| Нанофільтрація | ||
| Озонування |
Як видно з таблиці кожному типу стічних вод відповідає метод або група методів, придатних для їх очищення. У той же час, багато методи очищення стічних вод дозволяють видаляти більше одного типу забруднень, що і застосовується при проектуванні і будівництві установок очистки води та очисних споруд.
Вибір найкращих доступних технологій очищення води є для проектувальників досить складним завданням, обумовленої різноманітністю забруднюючих речовин в стічній воді і високими вимогами, що пред’являються до якості її очищення. Можлива утилізація цінних компонентів зі стічних вод, кислот і лугів з використанням, наприклад, керамічних мембранних елементів. На підставі результатів аналізу стічної води можна спроектувати очисні споруди і підібрати відповідне обладнання. Вибір обладнання для очищення стічних вод потрібно здійснювати методом порівняння даних про якість води з характеристиками даних технологічного обладнання[4].
Очисні споруди стічних вод проектуються на підставі аналізу виробничих процесів і складу стоків. Наприклад, використовуються деструктивні методи очищення стічних вод промислових підприємств, з розкладанням шкідливих речовин або переказів їх у нетоксичні з’єднання, і регенеративні методи, що базуються на утилізації й витягу забруднень з води.
3. Стадії очистки стічних вод промислових підприємств
Процес очищення стічних вод виробничого підприємства, як правило, включає декілька стадій, на кожній з яких можливе застосування різних методів очищення стічних вод і відповідного технологічного устаткування. Дана ситуація зумовлена в першу чергу тим, що багато методів, в особливості тонкої очистки стічних вод не можна використовувати, якщо в них присутні завислі речовини та емульсії. Крім цього, більшість методів очищення стоків має верхню межу концентрацій по забруднюючим речовинам, від яких даний метод повинен очищати стік. Отже, виникає необхідність попередньої обробки стоків перед застосуванням основних методів їх очищення. Застосування стадійний очищення стічних вод промислових підприємств обумовлено також тим, що комбінуванням декількох типів процесів обробки можливо досягти необхідного ступеня очищення з мінімальними витратами[5].
На різних промислових виробництвах використовується різна кількість стадій очищення води. Це залежить від організації очисних споруд, використовуваних методів очищення та складу стоків. Для розробки інформаційної системи процеси очищення стоків слід розглядати на основі більш узагальненого підходу.
Найбільш раціональним, очевидно, буде поділ процесу очищення стоків на чотири етапи, відповідно до поділом забруднюючих речовин на основі їх агрегатного стану за класифікацією академіка Кульського.
4. Коагуляція та флокуляція
4.1 Характеристика коагулянтів і флокулянтів
В останні роки на ринку нашої країни з’явилося багато різних коагулянтів і флокулянтів, при цьому не існує строгого поділу речовин на коагулянти і флокулянти. У загальному вигляді до коагулянту, що призводить до агрегації частинок, відносять низькомолекулярні органічні або неорганічні електроліти, до флокулянтів — неорганічні або органічні високомолекулярні сполуки, що сприяють утворенню агрегатів за рахунок об’єднання декількох частинок через макромолекули адсорбованого або хімічно зв’язаного полімеру.
Ключовою відмітною ознакою в даному випадку є молекулярна вага. З хімічної точки зору, що відбиває фізико-хімічні взаємодії при освітленні і обесцвечивании води, флокулянти обумовлюють агрегацію частинок в результаті хімічної взаємодії на відміну від коагулянтів, що впливають на електрокінетіческій потенціал частинок. У зарубіжних виданнях, як правило, немає поділу на коагулянти і флокулянти, а всі хімічні реагенти, які беруть участь в агрегації і седиментації домішок води, називають флокулянтами. Тим не менш Ла Ме запропонував коагуляцією називати агрегацію частинок під дією простих іонів, а флокуляцією — агрегацію під дією полімерів[6].
Поняття коагуляції і флокуляції часто використовуються як синоніми. Вони обидва будуть агломератами колоїдних частинок, але вони виконують це по-різному. Коагуляція нейтралізує заряди на частинках, вони відштовхуются між сабой, що дозволяє їм наблизитися до агломерату. Флокуляция з’єднує частинки щоб зробити їх ще більше, таким чином вони можуть бути видалені більш ефективно і результативно.
4.2 Види коагулянтів і флокулянтів
Усі коагулянти і флокулянти діляться на органічні та неорганічні. Найбільшого поширення набули неорганічні коагулянти, вони представляють собою солі алюмінію, заліза або їх суміші і суттєво рідше солі титану, магнію, цинку. Органічні коагулянти являють собою катіонні поліелектроліти, які ведуть себе як первинні (неорганічні) коагулянти. Але якщо дія неорганічних коагулянтів засноване на дестабілізації шляхом стиснення подвійного електричного поля, що оточує частинки, то органічні коагулянти здійснюють дестабілізацію за рахунок абсорбції довгих молекулярних ланцюжків з подальшим утворенням містків між частинками і молекулами полімеру. Органічні коагулянти на відміну від флокулянтів є низькомолекулярними водорозчинними полімерами з молекулярною масою 10000-300000.
У загальному вигляді всі неорганічні коагулянти можна представити хімічної брутто формулою:
[KMex(OH)aClb(SO4)c(NO3)d]n
де а + b + с + d = 2/6, К — катіон, Ме — іон металу, X = 1/2.
В якості катіона можуть виступати калій, натрій, амоній, а основний метал-іон — залізо або алюміній. У кристалічному вигляді неорганічні коагулянти, як правило, являють собою кристалогідрати, добре розчинні у воді.
Коагулянт сульфат алюмінію являє собою кристалічну речовину, проводиться у вигляді різних фракцій у формі шматків і пластинок невизначеної форми або в гранульованому вигляді. Коагулянт призначений для очищення води господарсько-питного та промислового призначення, стічних вод, а також у технологічних процесах різних галузей промисловості.
Неорганічні коагулянти на основі заліза. Коагулянти на основі заліза використовуються поряд з алюмосодержащімі коагулянтами для очищення промислових і комунальних стічних вод. Застосування хлориду і сульфату заліза (ІІІ) дозволяє видалити такі забруднення природних і стічних вод, як:
- зважені речовини (каламутність);
- кольоровість;
- хімічне та біологічне споживання кисню (ХПК і БПК);
- фосфати;
- нафтопродукти;
- синтетичні поверхнево-активні речовини (СПАР);
- важкі метали.
Вище наведені реагенти ефективно працюють при низькій температурі оброблюваної води, а також при високому значенні рН (9 і більше).
Крім того, використання коагулянтів на основі заліза забезпечує видалення запахів сульфідного походження (в тому числі меркаптозє’днаній і сірководню), з утворенням осаду сульфіду заліза:
2FeCl3 + 3H2S = Fe2S3↓+ 6HCl;
Fe2(SO4)3 + 3H2S = Fe2S3↓+ 3H2SO4;
У зв’язку з цим солі заліза ефективно використовуються для кондиціонування опадів комунальних станцій аерації: оброблених осад має більш щільну структуру, легше зневоднюється і не має характерного запаху.
Органічні коагулянти. Органічні коагулянти є катіонними, добре розчинними у воді низькомолекулярними поліелектролітами з молекулярною масою 1000 — 300000 а. е. м.
Органічні коагулянти характеризуються:
- високим катіонних зарядом, необхідним для дестабілізації негативно заряджених колоїдних часток і забезпечення швидкого утворення хлоп’їв;
- відносно низькою молекулярною масою й в’язкістю, необхідної для того, щоб забезпечити гарний розподіл полімеру в оброблюваній воді і катіонних зарядів навколо колоїдних частинок;
Застосування органічних коагулянтів дозволяє:
- зменшити витрату неорганічних коагулянтів;
- скоротити обсяг утворюється осаду після коагуляції-флокуляції;
- підвищити здатність осаду до зневоднення;
- підвищити ефективність і стабільність очищення води.
Флокулянти використовуються на додаток до коагулянту для збільшення розмірів утворюються пластівців і їх подальшого видалення. У даному випадку застосовуються продукти з високою молекулярною масою, слабкою катіонів (до 15%) або аніони (від 0 до 50%). Флокулянти полімерного типу застосовуються після дестабілізації колоїдної суспензії коагулянтами, щоб збільшити ефективність процесу очищення. Завдяки своїй дуже великої молекулярної масі флокулянти утворюють містки між мікропластівцями, що виникли при коагуляції, створюючи більш великі макропластівці[7].
Використання слідом за коагуляцією дуже малих кількостей флокулянтів (0,01 — 0,5 мг/л) максимізує захоплення частинок, прискорює утворення пластівців і робить пластівці більш щільними і швидко осідають. Використання флокулянтів для цієї мети дозволяє також обмежити дозування коагулянтів до мінімальної кількості, необхідного для дестабілізації колоїдної суспензії, оскільки при цьому не потрібно надмірну кількість коагулянту для утворення суспензії, здатної випасти в осад.
Застосування флокулянтів рекомендується після дестабілізації колоїдної системи коагулянтами. Для кращого пластівцеутворення рекомендується вводити робочий розчин флокулянту через 20-30 секунд після внесення коагулянта.
Флокулянти дозволяють:
• максимізувати якість води при мінімізації часу відстоювання;
• збільшити продуктивність без капітальних витрат;
• підвищити ефективність системи фільтрації і збільшити термін служби фільтрів;
4.3 Змішання реагентів з водою
При коагулюванні домішок води необхідно швидке і рівномірний розподіл реагентів в її обсязі для забезпечення максимального контакту частинок домішок з проміжними продуктами гідролізу коагулянту (які існують протягом короткого проміжку часу), так як процеси гідролізу, полімеризації і адсорбції протікають протягом 1с. Перекінетічна (молекулярно-кінетична) коагуляція закінчується, коли частинки досягають розміру 1 . . 10 мкм, що практично збігається з періодом швидкого розподілу коагулянту в оброблюваній воді в змішувачах. Неефективне змішання призводить до перевитрати коагулянту і малій швидкості агломерації домішок води при даній дозі реагенту. Отже, необхідно створити оптимальний режим роботи змішувачів, при якому коагулянт вступив би в зіткнення з максимальним числом частинок домішок води до того, як закінчаться реакції гідролізу і полімеризації.
5. Лабораторний експеримент
Оптимальні реагенти можуть бути:
- негашене вапно;
- сульфат заліза;
- поліакриламід.
Технологія застосування процесів коагуляції і флокуляції складається з 3-х стадій:
- дозування і змішування негашеного вапна з водою до рН = 7,2 — 7,5;
- введення і змішування коагулянту з водою (витримка до хлоп’яутворення);
- введення і змішування поліакриламіду з водою;
- відстоювання води від зважених часток.
Таблиця 3 — Показує допустимі та фактичні значення показників води та можливі заходи завдяки яким буде досягнуто потрібне значення показників.
| Назва показника | Допустимі значення | Фактичне значення | Пропоновані заходи | Досягнутий ефект |
| рН | Не більше 8,5 і не менше 6,5. Оптимальне 7,0 — 8,5. | 6,5 | Додавання СаО до перед коагуляцією | Підвищення рН до 7,5 |
| Температура | +6 — +30° С. При збільшенні температури з 15 до 25 ° С швидкість окіленія фенолів збільшується в 2 рази. Оптимальне +25 — +30° С. | - | - | - |
| Загальна концентрація розчинених солей | Не більше 10 г/л. | Не менше 12 г/л. | Подщелачіваніе, коагуляція і флокуляції | Можливе зменшення показника не менше, ніж на 10 — 15% з урахуванням розчинності додаються реагентів. Без урахування 20 — 25% |
| Зважені частки | Відсутність | За зовнішнім виглядом значна кількість | Коагуляція та флокуляція | Візуально практично повне видалення |
| Смолисті домішки | Відсутність | Значна кількість | Коагуляція та флокуляція | Виходячи з характеру осаду і візуального освітлення води, видаляється значна частина. |
| Зміст Н2S і сульфіди | Безпосередньо не нормується, але робить істотний вплив на потребу в кисні | Значні кількості | Подщелачіваніе, коагуляція і флокуляції | Видалення до залишкового вмісту менше 70 мг/л |
Після проведення очищення було зроблено порівняння за допомогою мікроскопу початкової та очищеної води за допомогою різних коагулянтів. Результати наведено на рисунку 1.
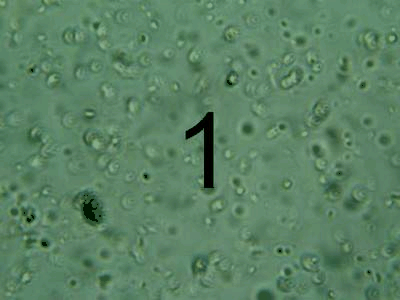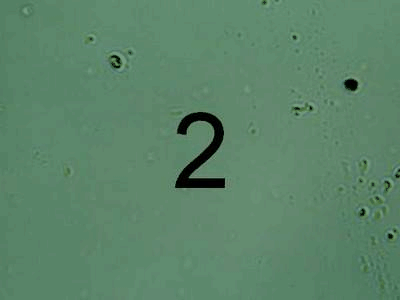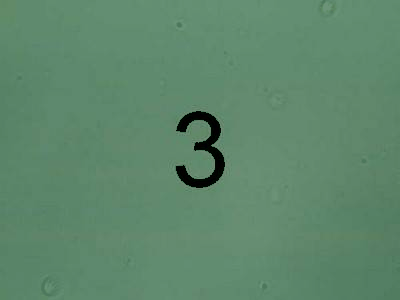
Рисунок
1 —
Результати
зроблені за допомогою
мікроскопу. 1 — результат до очищення, 2 — очищення
за
допомогою FeCl3,
3 — очищення за допомогою
Al2(SO4)3
(анімація: 3 кадрів,
7 циклів повторення, 154 кілобайт)
За результатами хімічних та мікробіологічних досліджень можна зробити висновок, що краще очищення стічних вод коксохімічного виробництва досягається за умов використання Al2(SO4)3.
Висновки
Були обгрунтовані основні характеристики стічних вод та можливі методи очищення їх у коксохімічної промисловості, було виявлено на які стадії краще розбити очищення стічних вод.
Підібрані можливі коагулянти та флокулянти, які найкраще всього підходять до доочистки фенольно-аміачних вод перед мокрим гасінням коксу. Розглянуті інші методи доочищення вод, які можуть буду використовані при рішенні проблеми доочищення.
Завдяки доочищенню стічних вод були досягнуті показники які відповідають санітарним нормам, а саме завдяки проведенним лабораторним іспитам у яких використовувалась різна кількість коагулянтів и флокулянтів зменшилась кількість шкідливих речовин у воді, суттєво зменшився негативний вплив пароподібних викидів при гасінні коксу на здоров’я працівників і мешканців довколишніх до підприємств районів. Найкращі показники отрамані у результаті іспитів дала суміш Al+3, Fe+3 і сорбент, кількість фенолів зменшилась у 2300 разів, летучого аміаку у 2,7 раза а роданідів — 21 раз.
З отриманних даних можливо зробити висновок, що дуже багато факторів впливають на кінцевий результат, а саме які використовуються флокулянти и коагулянти, у якій кількості, який вид змішувача та камери хлоп’яутворення, але можно зробити висновок, що температура води не впливає на кінцевий результат. Змогли досягти практично повного осідання у воді активний мулу. Концентрація основних шкідливих речовин істотно зменшилася, вода покращила свій колір і запах. Завдяки аналізу літературних даних були знайдені багато різних коагулянтів та флокулянтів, але виникає економічне питання при очищенні вод, яке в наш час стоїть в першу чергу.
При написанні даного реферату магістерська робота ще не завершена. Остаточне завершення: грудень 2013 року. Повний текст роботи та матеріали по темі можуть бути отримані у автора або його керівника після вказаної дати.
Перелік посилань
- Баркалов А.А. Синтез устройств управления на программируемых логических устройствах / А.А. Баркалов. — Донецк: ДонНТУ, 2002. — 262 с.
- Проскуряков В.А., Шмидт Л.И. Очистка сточных вод в химической промышленности. Л. «Химия», 1997
- Драгинский В.Л. Коагуляция в технологии очистки природных вод. 2005
- Лазорин С.Н., Папков Г.И., Литвиненко В.И. Обезвреживание отходов коусохимических заводов, М. «Металлургия», 1997
- Запольский А.К., Баран А.А. Коагулянты и флокулянты в процессах очистки воды, Л. «Химия», 1987
- Великодный В.А., Пикашов В.С. Технология утилизации фенольной воды // Энерготехнологии и ресурсосбережение. — 2010. №2. с. 67 — 71.
- Гарин В.М., Клёнова И.А., Колесников В.И. Экология для технических вузов. Серия «Учебники для технических вузов»: Феникс, 2001.
- Кульский Л.А., Даль В.В., Кудельская Г.А., Кузнецова Л.Г. Методы очистки промышленных сточных вод / Л.А. Кульский, В.В. Даль, Г.А. Кудельская, Л.Г Кузнецова. — К.: УКР НИИ НТИ. — 1978.
- Небольсина Л.А., Передерий О.Г., Харлампович Г.Д., Дербышева Е.К. Состояние перспективы очистки сточных вод коксохимических предприятий от эмульгированных масел // журнал Кокс и Химия — M.: Металлургиздат — 1985. — № 10. — с. 28.
