Бричкин В.Н., Васильев В.В., Кремчеева Д.А., Радьков В.В.
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
г. Санкт-Петербург, Россия
Современная термодинамика производства глинозёма по способу Байера прошла длительный исторический путь развития от эмпирических представлений о состоянии щелочных алюминийсодержащих растворов, заложенных в патентах К.И.Байера, до современной термодинамики многокомпонентных систем, позволяющей вести множественную оптимизацию технологических процессов. При этом были выработаны два независимых подхода представления физико-химического равновесия в системе Na2O-Al2O3-H2O, которая является базовой не только для способа Байера, но и значительного количества других щелочных способов производства глинозёма. Традиции российской и западной школы производственной термодинамики, несмотря на современное взаимопроникновение бизнеса, сохраняются до настоящего времени, что не мешает их развитию на пользу глинозёмной промышленности.
Западная школа специалистов традиционно использует такие ведущие характеристики алюминатных растворов, как ТС (total caustic), TA (total alkaline) и A/TC, где только А (alumina) полностью соответствует принятому в отечественной практике представлению концентрации алюминия в щелочных растворах в пересчёте на Al2O3. Здесь ТС – это объёмная концентрация NaOH в пересчёте на Na2СО3, ТА – общая концентрация титруемых щелочей, т.е. суммы каустика и соды в пересчёте на Na2СO3, а отношение A/TC является показателем насыщения щелочных растворов относительно термодинамически устойчивой твёрдой фазы. Отличия приведённых показателей от исторически сложившихся в России не так велики. Им соответствуют принятые в отечественной металлургии и близкие по смыслу величины каустической щёлочи (Na2Oк или Nк), общей щёлочи (Na2Oоб или Nоб) и каустического модуля (Αк), представляющего собой молярное отношение каустической щёлочи и Al2O3 в растворе. Не трудно заметить, что все перечисленные показатели имеют строгие стехиометрические связи, облегчающие переход от одних величин к другим:
Nк = ТС•62/106; Nоб = ТА•62/106; Αк = 102•ТС/106•А,
где 62, 106, 102 – соответственно молекулярные массы Na2O, Na2СО3 и Al2O3
Простота и достаточность аналитического контроля растворов по указанным компонентам, в том числе для оценки равновесного состава, удобство использования относительных характеристик и их независимость от разбавления определили использование данного набора показателей в исследовательской и заводской практике глинозёмного производства. Так, например, концентрационная константа равновесия основной реакции способа Байера
Al2O3mH2O + Na2O•H2O + (3 – m)H2O = Na2O• Al2O34 H2O, (1)
независимо от фазового состава гидроксида алюминия в твёрдой фазе, однозначно определяется равновесным каустическим модулем по уравнению:
Кс = 1/(Αк – 1). (2)
Из уравнения (2) видно, что увеличение выхода конечных продуктов, зависящее от смещения равновесия реакции (1) влево или вправо, связано с возможностью достижения наиболее низких значений каустического модуля при выщелачивании и возможно высоких значений при декомпозиции. В реальных производственных условиях эти величины находятся в достаточно узком диапазоне 1,3÷3,8, а зачастую и ещё более ограниченном. Это делает невозможным достижение высоких показателей по выходу продуктов и степени использования реагентов. В то же время возникает возможность обратимого ведения процесса, представляющего безусловное достоинство способа Байера. При этом степень разложения алюминатных растворов, характеризующая выход Al2O3 в твёрдую фазу при декомпозиции, рассчитывается по уравнению:
η = 1 - Αк н/ Αк к, (3)Отсутствие понятия каустического модуля в западной традиции приводит к тому, что расчёт степени разложения (декомпозиции) растворов обычно ведётся по уравнению:
η = (Ак – Ак)/Ан, (4)
где Ан, Ак – соответственно начальная и конечная концентрации Al2 O3 в растворе. Неточность этого выражения связана с тем, что оно не учитывает концентрирование раствора при декомпозиции в результате связывания трёх молей воды в гидроксид алюминия и поэтому даёт несколько заниженные результаты по сравнению с расчётами по уравнению (3).
Степень полезного использования каустической щёлочи при выщелачивании алюминиевого сырья по уравнению (1) оценивается величиной 1/Αк, и одновременно появляется возможность расчёта эффективности оборота щёлочи по уравнению:
Э = 1.645(Nк)о(1/(Αк)а- 1/(Αк)о), (5)где (Nк)0 – концентрация Na2 Oк в оборотном растворе; (Αк)а,(Αк)о - соответственно каустический модуль алюминатного раствора после выщелачивания и оборотного раствора.
Рассмотрение приведённых показателей позволяет сделать однозначный вывод о фундаментальном значении равновесия в системе Na2O-Al2O3-H2O для обоснования оптимальных технологических режимов всех основных гидрометаллургических операций, образующих цикл Байера. С этих позиций становится понятным тот вклад, который был сделан С.И. Кузнецовым в развитие термодинамики этой системы и в целом гидрометаллургии щелочных способов переработки алюминийсодержащего сырья. Монография С.И. Кузнецова и В.А. Деревянкина «Физическая химия процесса производства глинозёма по способу Байера» на многие десятилетия определила научные подходы развития глинозёмного производства, обеспечила подготовку высококвалифицированных отечественных специалистов, да и, пожалуй, до настоящего времени является одной из наиболее цитируемых публикаций по теории процессов в алюминатных растворах. В этой работе были обобщены и получили дальнейшее развитие представления о состоянии многокомпонентных систем глинозёмного производства, промышленной термодинамике и кинетике в идеальном и реальном производственном цикле способа Байера, а само изложение этих вопросов практически без изменений или с незначительными дополнениями перекочевало на страницы последующих научных изданий и учебников [1-4]. Значительно позже уже устоявшиеся термодинамические представления были дополнены равновесиями с участием природных минералов алюминия и материалами по структуре алюминатных растворов [4-6].
Заметным шагом в развитии термодинамики алюминатных растворов стало математическое и физико-химическое моделирование равновесий, обеспечивающее непрерывность описания функции стояния системы в многофакторном пространстве. Одна из первых работ в этой области представляет математическое описание известных экспериментальных данных о равновесии в системе Na2 O- Al2O3-СО2 -H2 O, что обеспечило решение большого класса технологических задач с приемлемой точностью [8]. В середине 90х годов двадцатого века была разработана термодинамическая модель равновесия алюминатных растворов байеровского производства, позволяющая учитывать вклад значительного количества технически значимых факторов в растворимость гиббсита [9]. Эти модели, в том числе, сделали возможным аналитическое решение вопроса об определении теоретической степени разложения алюминатных растворов и введение в практику декомпозиции относительной степени разложения растворов, что позволяет полнее понять достигнутый уровень осаждения алюминия. Данное положение наглядно иллюстрируется рис. 1, где определение состава раствора в (∙) Д представляет известную трудность в условиях реального распределения температурного поля по батарее декомпозёров и управления концентрационным режимом разложения. Например, при использовании математической модели по работе [8] равновесный состав раствора в конце декомпозиции определяется совместным решением уравнения изотермы равновесия (6) и линии декомпозиции (7):
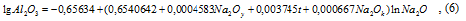
Aк = 102/156(1 – Nк к / Nк н) + 1,645Nк к /Αк н , (7)
где Nк н, Nкк – концентрации каустика соответственно в начале и конце декомпозиции при достижении равновесия, масс %; Na2 Oк и Na2 Oу - концентрация каустической и углекислой щёлочи (соответственно) в равновесном растворе, г/л; Aк и Al2O3– концентрация оксида алюминия в равновесном растворе конца декомпозиции, соответственно масс % и г/л.
Понятно, что при расчётах по уравнениям (6) и (7) необходимо знание плотностей исходного и равновесного раствора.
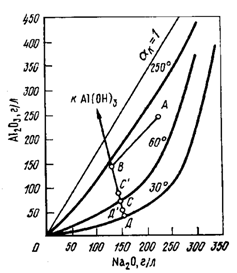
Рис.1. Изменение концентрации алюминатного раствора в процессе разбавления (АВ) и декомпозиции (ВС) в системе Na2 O- Al2O3-СО2 -H2 O (цифры у кривых – температура, °С)
Один из наиболее обсуждаемых в последние десятилетия вопросов физической химии производства глинозёма по способу Байера – это скорость разложения алюминатных растворов, которая неизменно связывается с кинетикой кристаллизации твёрдого гидроксида алюминия. Не вызывает сомнений значение этого вопроса для понимания механизма процесса и его интенсификации. При этом, исходя из кинетических закономерностей кристаллизации, особое значение приобретает характеристика абсолютного и относительного пересыщения среды кристаллизации, т.е. неравновесного алюминатного раствора. В современной теории кристаллизации абсолютное пересыщение в большей степени связывается с лимитирующей стадией химического или диффузионного сопротивления, что позволяет использовать его для описания кинетики процесса с помощью универсального эмпирического уравнения:
j = dm/dτF = K(C – Cо) n , (8)
где j – поток кристаллизации; m и F – соответственно масса и поверхность кристаллизующегося вещества; τ – время; n – кинетический параметр, не совпадающий с порядком химической реакции; C, Cо – концентрация пересыщенного и равновесного растворов по кристаллизующейся фазе.
Относительное пересыщение C/Cо (коэффициент пересыщения), как правило, входит в уравнения для описания интенсивности зародышеобразования, что показывает его кинетическое значение при лимитирующей стадии этого процесса. Таким образом, абсолютное и относительное пересыщение могут быть использованы в качестве одного из параметров оптимизации процесса разложения алюминатных растворов. На рис. 2 и 3 представлены результаты расчёта пресыщений в системе Na2O-Al2O3-H2O при постоянном отношении Nк /Nоб и температуре 60°С как функции концентрации каустической щёлочи в растворе и степени его разложения. На рис. 2 хорошо видно, что профиль поверхности абсолютных пересыщений имеет пространственный максимум, который в зависимости от степени разложения смещается по оси концентраций каустика. Линейный профиль максимумов в зависимости от каустического модуля растворов для ряда температур приведён на рис. 4, а зависимость концентрационной координаты максимума от степени разложения раствора на рис. 5.
Кинетическое описание кристаллизации гиббсита по уравнению (8) обычно связывается с квадратичной зависимостью абсолютного пересыщения раствора. Пространственное положение этого кинетического параметра в координатах Nк, Αк приведено на рис. 6. Для широкого диапазона режимов в работе [9] рекомендуется использование более сложного кинетического параметра [(C – Cо)/( Nк – 0,0078С)] 2, входящего в уравнение (8). Собственные исследования показали возможность описания скорости разложения алюминатных растворов с приемлемой точностью при использовании следующего параметра (C/Cо–1) 2, а его пространственное положение, приведённое на рис. 7, в целом совпадает с поверхностью отклика для кинетического параметра Кинга.
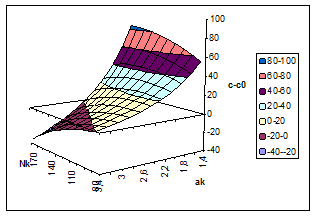
Рис. 2. Зависимость абсолютного пересыщения по Al2O3 (г/л) в системе Na2O-Al2O3-H2O от концентрации каустика (г/л) и каустического модуля раствора
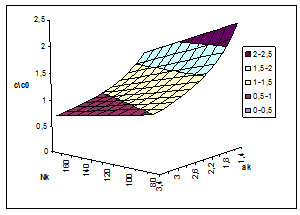
Рис. 3. Зависимость относительного пересыщения по Al2O3 в системе Na2O-Al2O3-H2O от концентрации каустика (г/л) и каустического модуля раствора
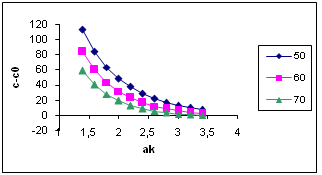
Рис. 4. Профиль максимумов абсолютных пересыщений (г/л) в системе Na2O-Al2O3-H2O в зависимости от Αк раствора, при температуре 50, 60 и 70 °С
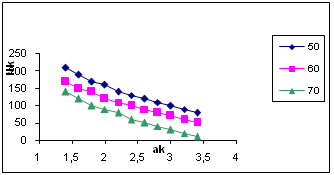
Рис. 5. Зависимость концентрации каустической щёлочи (г/л) в максимуме абсолютного пересыщения системы Na2O-Al2O3-H2O от αк раствора, при температуре 50, 60 и 70°С
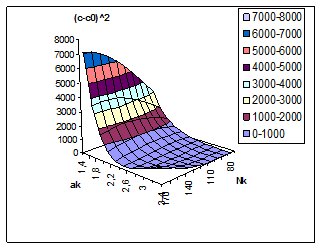
Рис. 6. Зависимость кинетического критерия (C – Cо) 2 от концентрации каустика (г/л) и каустического модуля раствора
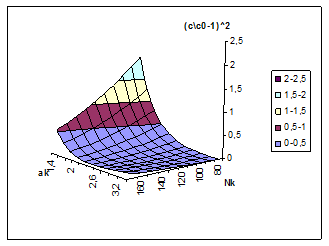
Рис. 7. Зависимость кинетического критерия (C/Cо - 1) 2 от концентрации каустика (г/л) и каустического модуля раствора в системе Na2O-Al2O3-H2O
Полученные результаты устанавливают сложный характер зависимости как показателей пересыщения алюминатных растворов, так и кинетических критериев их разложения от ведущих параметров состояния системы Na2O-Al2O3-H2O, что позволяет отрабатывать оптимальные технологические режимы процессов для решения разнообразных научных и производственных задач.
Таким образом, современное состояние теории производства глинозёма способом Байера представляет собой динамично развивающееся учение, впитавшее в себя многолетние традиции, унаследованные от старшего поколения исследователей, и достижения передовых технологий. Такое сочетание подходов способствует дальнейшему расширению фундаментальной базы переработки алюминиевого сырья, решению комплекса производственных вопросов и в конечном итоге обеспечивает конкурентоспособность предприятий, работающих по технологии способа Байера.
Литература1. Справочник металлурга по цветным металлам. Производство глинозёма /Под редакцией Ю.В. Баймакова, Я.Е. Канторович. М.: Металлургия, 1970. 320с.
2. Беляев А.И.. Металлургия лёгких металлов. М.: Металлургия, 1970. 368с.
3. Лайнер А.И. Производство глинозёма / А.И.Лайнер, Н.И.Ерёмин, Ю.А.Лайнер, И.З.Певзнер. М.: Металлургия, 1978. 344с.
4. Абрамов В.Я. Физико-химические основы комплексной переработки алюминиевого сырья (щелочные методы)/ В.Я.Абрамов, Г.Д.Стельмакова, И.В.Николаев. М.: Металлургия, 1985. 288с.
5. Сизяков В.М. Повышение качества глинозема и попутной продукции при комплексной переработке нефелинов/ В.М.Сизяков, В.И.Корнеев, В.В.Андреев. М.: Металлургия, 1986, 111c.
6. Тихонов Н.Н. О равновесном соотношении между каустической щёлочью и оксидом алюминия в алюминатно-щелочных растворах// Цветные металлы, 2000. № 1. С. 21 – 22.
7. King W. Some Studies in Alumina Trihydroxide Precipitation Kinetics// Light metals (AIME), 1979. Vol. 2. P. 551-563.
8. Steven P. Rosenberg and Steven J. Healy. A Thermodynamic Model for Gibbsite Solubility in Bayer Liquors// Fourth International Alumina Quality Workshop. Darwin, 2-7 June 1996. P. 301-310.