Формирование оптимальной структуры поликристаллических осадков, безусловно, относится к одной из важнейших задач химико-металлургической технологии, так как именно на этапе выделения твердой фазы из раствора (или расплава) закладываются её продукционные и технологические свойства, позволяющие эффективно использовать или перерабатывать полученный продукт. При кристаллизации из растворов зачастую требуется обеспечить химическую однородность и чистоту осадка, коррозионную устойчивость или химическую активность, оптимальные физико-механические характеристики, такие, как низкая слёживаемость и пыление, высокая технологичность в отношении отделения и промывки твердой фазы, сушки и обжига, транспорта и хранения, ряда других операций. Во многих случаях находятся приемлемые технические решения для достижения поставленных целей. Наиболее трудно решаются поставленные задачи в отношении химических осадков, т.е. малорастворимых продуктов химических реакций, характерных для гидрометаллургии цветных металлов. В последнее время наметилась тенденция в решении данного вопроса, связанная с использованием высокоэффективного оборудования для фильтрации, промывки и гидроклассификации, с применением синтетических флокулянтов на стадии сгущения, и технологических систем, уменьшающих самоизмельчение материала. Это позволяет частично снять остроту проблемы, переведя её в плоскость повышения эффективности смежных операций, но не дает возможности в полной мере использовать технологические резервы самого химического осаждения.
Всё сказанное в полной мере относится к задачам, решаемым при осаждении гидроксида алюминия из растворов в производстве глинозёма по способу Байера. Особенную остроту эти вопросы приобрели в последнее время в связи с повышением требований к качеству глинозёма при использовании алюминиевых электролизёров, оборудованных системой автоматизированного питания глинозёмом. В то же время интерес к разработке фундаментальных основ кристаллизации гидроксида алюминия и подходов направленного формирования его кристаллофизических свойств имеет достаточно давнюю историю.
С.И. Кузнецова с полным правом можно отнести к пионерам исследования кристаллизации гиббсита из алюминатных растворов, применившим передовую методику электронной микроскопии для изучения нестационарных ростовых процессов [1]. Тем самым, были заложены научно-методические основы последующих работ в этой области, многочисленность которых говорит о неизменном значении данного вопроса для производства и интереса к нему со стороны отечественных исследователей [2- 6]. В статье «Характер роста кристаллов гидраргиллита в процессе декомпозиции алюминатных растворов» С.И. Кузнецов убедительно показал зависимость кристалломорфологии гиббсита, образующегося в производственных условиях, от состава алюминатного раствора. При этом обращается внимание на механизм вторичного зародышеобразования связанный с дендритным ростом кристаллов, особенно в условиях диффузионного ограничения процесса. Таким образом, уже в этой ранней работе по структуре осадков гидроксида алюминия, анализ форм роста кристаллов неразрывно связывается с механизмом их возникновения и участием в формировании свойств конечного продукта. Отдельные аспекты этого механизма, включающие исследование активных центров роста, влияния состава среды кристаллизации, вторичных явлений и процессов получили развитие в целом ряде последующих работ [7-17]. Одно из наиболее обстоятельных исследований по морфологии гиббсита приведено в работе [18]. Последние десятилетия заметный интерес к механизму кристаллизации гидроксида алюминия связан с изучением процессов агломерации дисперсных частиц, что имеет большое практическое значение для улучшения производственных показателей, и уже нашло применение на ряде глинозёмных предприятий [19-23]. Не менее важен для производства и вопрос кристаллизации гидроксида алюминия при разложении алюминатных растворов способом карбонизации, что находит отражение в отечественных публикациях [24-29].
Необходимо отметить, что заметное место в разработке механизмов разложения алюминатных растворов занимает вопрос участия микрочастиц критического размера. Это положение в полной мере соответствует современной термодинамике процессов кристаллизации, и было использовано С.И. Кузнецовым и В.Н. Тихоновым для объяснения эффекта понижения устойчивости алюминатных растворов при прохождении через него переменного электрического тока [30].
Приведённый краткий анализ вопросов, относящихся к кристаллизации гидроксида алюминия из щелочных алюминатных растворов, не претендует на полноту литературного обзора, тем не менее, позволяет оценить основные проблемы и направления работ в этой области важные для производства глинозёма. Не смотря на высокую степень изученности массовой кристаллизации из растворов, существует известная неопределённость, связанная с научным обоснованием и выбором режима для получения продукции с заданными кристаллофизическими свойствами, в результате сложности и многофакторности процессов, сопровождающих химическое осаждение гидроксида алюминия в реальных технологических условиях. С учётом общности законов кристаллизации, действующих в природных и искусственных системах, часть ответов на поставленные вопросы может быть получена на основе известных закономерностей и принципов ростовой кристаллографии [31-34].
Равновесная форма кристаллического индивида может быть определена из универсального принципа Кюри и условия равновесия Гиббса, отвечающего требованию минимального значения общей свободной энергии. В соответствии с этим условие энергетического минимума для равновесного многогранника записывается в виде:

где σi - удельная свободная поверхностная энергия границы фаз; Si - величина поверхности i-той грани; V - объём кристалла.
Следовательно, из всех возможных кристаллических форм равновесной и наиболее вероятной является та, которая обладает наименьшей свободной или межфазной энергией. По теореме Вульфа, чем выше поверхностная энергия, тем меньше площадь грани. Вследствие этого исчезают неустойчивые грани, а стабильные увеличиваются в размерах, и в конечной стадии роста кристалл огранен гранями с наименьшей скоростью роста. Большинство форм макроскопических кристаллов, проявляющихся в результате кристаллизации, не являются равновесными, и в реальных условиях скорости роста различных граней не пропорциональны поверхностным энергиям. В этом смысле, принцип Гиббса Кюри Вульфа к формам роста не применим, так как помимо полиэдрических реальные кристаллы имеют все возможные иные формы роста, характеризующиеся завышенной поверхностной энергией.
Общее условие термодинамически предпочтительного неравновесного состояния системы, соответствующее экстремальности производства теплоты диссипации и минимуму её изменения во времени может быть записано в следующем виде[35]:
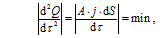
где Q – теплота рассеяния; τ - время; А – химическое сродство; j - удельная скорость роста или растворения (поток); S - поверхность кристаллической фазы.
Отсюда видно, что при росте и растворении кристалл как бы стремится поддержать общее производство теплоты рассеяния (диссипации), приобретая форму, максимально препятствующую его изменению во времени. При этом проявляется внутренняя противоречивость неравновесной системы, стремящейся максимально быстро перейти в состояние равновесия и в то же время сохранить состояние с прежним производством теплоты. Один из наиболее распространённых путей перехода неравновесной системы в такое состояние заключается в реализации механизмов, увеличивающих дисперсность кристаллической фазы и соответственно её поверхность. На рис.1 приведены результаты дисперсионного анализа затравочного гидроксида алюминия и продуктов декомпозиции, выполненной в однотипных условиях. Не трудно заметить, что при использовании затравки различной природы и фракционного состава, в зависимости от кинетической предпочтительности процесса, система переходит в стационарное состояние различными путями, формирующими адекватную структуру осадка.
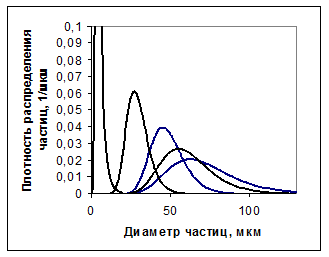
Рис. 1. Плотность распределения по крупности осадков гидроксида алюминия, полученных осаждением на затравке из алюминатных растворов: 1 – затравочный гидрат (узкая фракция); 2 – широкая фракция затравочного (байеровского) гиббсита; 3 – продукт осаждения на байеровской затравке (1); 4 – осадок на карбонизационной затравке (1); 5 – осадок на затравке (2).
Наиболее распространённые примеры перехода твёрдой фазы в дисперсное состояние связаны с преимущественным развитием механизмов гомогенного и гетерогенного зародышеобразо-вания и хорошо известны из практики химического осаждения. При невозможности реализации подобных процессов отклик системы на неравновесные условия связан с развитием механизмов реального кристаллообразования, таких как изменение гранных форм, неполногранный и дендритный рост, расщепление и двойникование, эпитаксиальный и блочный рост, выклинивание и др. Современные методы сканирую-щей электронной микроскопии делают доступными наблюдение и фиксацию конкретных форм роста, возникающих по указанным механизмам. На рис. 2 приведены изображения кристаллов гиббсита, образующихся в различных условиях декомпозиции алюминатных растворов. Похожие процессы сопровождают осаждение гидроксида алюминия и методом карбонизации, который вследствие его динамичности приводит к образованию ещё менее стабильных кристаллических индивидов и агрегатов, рис 3.

Рис. 2. Формы роста кристаллов гиббсита, образующихся при осаждении из алюминатных растворов [18]: a – сложный агрегат, образованный путём расщепления в плоскости симметрии гиббсита пластинчатых дойников по {110}; b – автоэпитаксия двойника гиббсита; c – сложный расщеплённый относительно оси симметрии кристалл гиббсита, образованный при участии процессов двойникования и эпитаксии; d – двойник гиббсита по {100}.
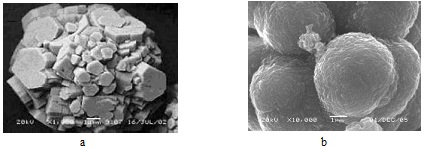
Рис. 3. Формы роста карбонизационного гиббсита: a – сферолит (возможно сферокристалл) гиббсита из расщеплённых двойников с удлинением субиндивидов по оси симметрии [13]; b – сферокристаллы гиббсита малого размера, образованные искривлёнными пластинчатыми субиндивидами расщеплёнными в плоскости симметрии
Оценить вклад каждого из механизмов в формирование структуры конечного продукта можно исходя из принципа независимости параллельных процессов, а, следовательно, и независимости их скорости c учётом распространённого описания кинетики осаждения гидроксида алюминия уравнением вида:
- dC/dτ = K(C – Cр)2 , (1)
где C, Cр – концентрация Al2O3 в пересыщенном и равновесном растворе; τ – время; K – константа скорости реакции, являющаяся в общем случае функцией конкретного механизма процесса.
После интегрирования (1) при начальных условиях τ = 0 и С = С0, получаем уравнение:
(C0 – C) = Kτ(C0 – Cр)(C – Cр). (2)
При осуществлении процесса по ряду параллельных механизмов, подчиняющихся кинетическому уравнению (1), можно записать:
- dC/dτ = - dC1/dτ – dC2/dτ….- dCi/dτ = K1(C – Cр)2 + K2(C – Cр)2 +….+ Ki(C – Cр)2. (3)
Тогда после подстановки С из уравнения (2) в кинетическое уравнение убыли концентрации по первому и последующим параллельным процессам получаем:
6С учётом постоянства множителя в уравнениях (4) справедливы следующие соотношения:
dC1/dС2 = K1/K2; dC1/dС3 = K1/K3;…. dC1/dСi = K1/Ki. (5)
После интегрирования уравнений (5) в пределах от C0 до C1, С2, С3,….Ci получаем:
(C0 – C1)/ (C0 – C2) = K1/K2; (C0 – C1)/ (C0 – C3) = K1/K3;…. (C0 – C1)/ (C0 – Ci) = K1/Ki. (6)
Делением левых частей уравнений (6) на (C0 – Cр) переходим к относительным величинам, выражающим степень протекания процесса по каждому из механизмов. Тогда доля продуктов (αi), образовавшихся по одному из параллельных механизмов составит:
αi = n Ki/( K1 + K2 +…+ Ki), при условии α1 + α2 + ….+ αi = n, (7)
где n – суммарная степень завершения процесса к данному моменту времени.
Подводя итог, можно сделать вывод о закономерном влиянии неравновесных условий кристаллизации гиббсита на его продукционные свойства посредством механизмов, преимущественно реализуемых в данных условиях, а доля участия конкретного механизма определяется его кинетическими характеристиками.
Литература
1. Кузнецов С.И. Характер роста кристаллов гидраргиллита в процессе декомпозиции алюминатных растворов// Цветные металлы, 1956. №11. С.59-63.
2. Чистякова А.А. Исследование превращений гидроокисей алюминия в щёлочно-алюминатных растворах/ А.А. Чистякова, В.А. Кавина // Цветные металлы, 1963. №11. С.46-53.
3. Кавина В.А. Образование и роль байерита при разложении алюминатных растворов/В.А. Кавина,А.Н. Ляпунов, А.А. Чистякова // Цветные металлы, 1966. №4. С.50-55.
4. Аракелян О.И. Влияние микроструктурных особенностей гидроокиси алюминия на качество глинозёма и определение её гранулометрического состава под микроскопом/ О.И. Аракелян, Ю.И. Павлов, М.В. Цветкова и др. // Производство глинозёма. Труды ВАМИ №94.Л.,1976. С. 96-101.
5. Волохов Ю.А. Механизм образования вторичных кристаллов гидроксида алюминия в алюминатных растворах/ Ю.А Волохов, В.Г. Тесля, Г.В. Анисимова и др.// Цветные металлы, 1989. №3. С.63-66.
6. Teslia V.G., Siziakov V.M., Volokhov Y.A. Influence and mechanism of different impurities action on to the process of Al(OH)3 crystallization from the aluminate liquors // Travaux. ICSOBA. Athens, 1999. Vol. 26. №30. Р.157-167.
7. Loh J.S.C. The effect of isotopic substitution of deuterium for hydrogen on the morphology of products precipitated from synthetic Bayer solutions/ J.S.C. Loh, H.R. Watling, G.M. Parkinson// Journal of Crystal Growth, 2002. Vol. 237-239. P. 2178-2182.
8. Sawsan J.F. Direct observation of the growth of gibbsite crystals by atomic force microscopy/ J.F. Sawsan, G.M. Parkinson, M.M. Reyhani// Journal of Crystal Growth, 2003. Vol. 260. P. 232-242.
9. Xie Y. Research on the mechanism and optimum adding of additives in seed precipitation/ Y. Xie, Q. Zhao, S. Bi, Y. Yang// // Light Metals, 2003. Р.87-91.
10. Sawsan J.F. Atomic force microscopy study of the growth mtchanism of gibbsite crystals/ J.F. Sawsan, G.M. Parkinson, M.M. Reyhani// Phys. Chem. Chem. Phys., 2004.№6. P. 1049-1055.