ГИДРОЛИЗ СУЛЬФОХЛОРИДОВ АНИЛИДОВ СУЛЬФОКИСЛОТ В ВОДНОМ ДИОКСАНЕ РАЗЛИЧНОЙ ПОЛЯРНОСТИ
Донецкий национальный технический университет
Известен эффект ускорения реакций нуклеофильного замещения у атома сульфонильного Сульфура в присутствии орто-алкильных групп [1,2,3]. «Положительный» стерический эффект наблюдается в рамках одного механизма замещения SN2, и кинетические закономерности затрудненных субстратов формально не описываются ни одним из количественных соотношений структура-реакционность с использованием известных параметров заместителей [4].
Целью настоящего исследования явилось изучение кинетики нейтрального гидролиза ряда сульфохлоридов анилидов сульфокислот общей формулы 3–[N(XArSO2)–N(Me)]–2,6–Me2–C6H2SO2Cl, где X=4–Me (1), H (2), 4–Cl (3), в 50–80% (объем) водном диоксане (в.д.) и интервале температур 303–323 К (табл.1).
Таблица 1. Эффективные константы скорости нейтрального гидролиза сульфохлоридов анилидов сульфокислот с экранированными сульфониламидными заместителями в водном диоксане

Скорость субстратов возрастает при повышении температуры и полярности водно-органического растворителя. Влияние заместителя X на кинетику процесса проявляется по-разному: при содержании протонного компонента ниже 30% — процесс гидролиза ускоряется электроноакцепторными X, выше 30% — электронодонорными. Вероятно, диапазон диоксано-водных смесей включает изопараметрическую точку по структуре и полярности растворителя. Ранее [3,4] отмечено наличие для этой же серии реально достижимой изокинетической точки по температуре. Таким образом, для затрудненных сульфохлоридов анилидов сульфокислот имеет место редкий факт пересечения в рабочих условиях нескольких изопараметрических областей.
Термодинамические параметры переходного состояния (ПС) удобно представить в виде диаграммы 1.
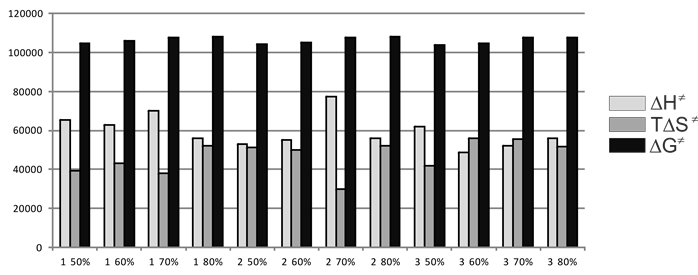
Рисунок 1. Термодинамические параметры ПС для гидролиза сульфохлоридов
анилидов сульфокислот.
Примечание. Процент показывает долю апротонного компонента в смеси.
Нумерация соединений соответствует приведенной в табл. 1
Монотонного изменения параметров активации ПС при движении от 50 до 80% в.д. не наблюдается. Энтальпия ПС колеблется в пределах 52÷78 кДж/моль, достигая максимума для 2, 70% в.д. Энтропийный фактор |TΔS≠| изменяется от 30 до 55 кДж/ моль, являясь максимальным в случае 3, 60 и 70% в.д. Оба параметра имеют максимумы и минимумы при изменении состава растворителя. Обращает на себя внимание факт практического постоянства значений для всех субстратов в случае гидролиза в 80% в.д., т.е. наблюдается компенсационный эффект между энтальпией и энтропией ПС.
- Mikolaiczyk M., Gaje M., Reimschussell W. // Tetrahedron Lett. – 1975. – № 16.– P.1325 – 1326
- Визгерт Р.В., Максименко Н.Н., Рублева Л.И. // Укр.хим.журн.- 1993.-Т.59, № 11.- С.1226-1238.
- Мысык Д.Д., Рублева Л.И., Крутько И.Н., Левандовский В.Ю. // Вопросы химии и химической технологии, 2004. - № 4. - С. 39?42
- Л. И. Рублева, Д. Д. Мысык, В. Ю. Левандовский, Н. А. Языков // Молодежь в науке - 2009: прил. к журн. «Весці Нацыянальнай акадэміі навук Беларусі». В 5 ч. Ч. 1. Серия химических наук. - Минск: Беларус. навука, 2010. – С. 67 – 71