Этанолиз стерически затрудненных аренсульфохлоридов
Донецкий национальный технический университет
Производные ароматических сульфосоединений достаточно хорошо изучены и широко применяются в различных областях народного хозяйства и медицины. Однако вопрос реакционности стерически напряженных субстратов всё ещё остается открытым из–за трудностей синтеза и исследования названных соединений.
Целью представленной работы явилось кинетическое изучение реакции этанолиза двух наборов аренсульфогалогенидов X–ArSO2Cl, отличающихся количеством, положением и природой заместителей (303–323К):
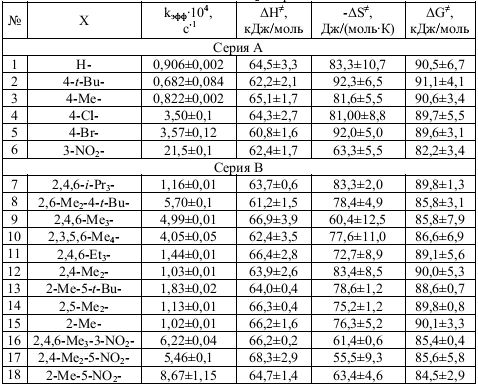
Первую группу (А) представляют субстраты с X=H–, 4–Me–, 4–tBu–, 4–Cl–, 4–Br–, 3–NO2–. Вторая группа (В) включает затрудненные соединения с орто–алкильными заместителями: X=2,4,6–Me3–, 2,4,6–Et3–, 2,4,6–i–Pr3–, 2,4–Me2–, 2,5–Me2–, 2–Me–5–t–Bu–, 2,6–Me2–4–t–Bu–, 2,3,5,6–Me4–, 2–Me–, 2–Me–5–NO2–, 2,4–Me2–5–NO2–, 2,4,6–Me3–3–NO2–. Данные таблицы указывают на ускорение процесса сольволиза со стороны обеих групп заместителей (А) и(В). Подобные реакционные закономерности как правило указывают на различие механизмов сольволиза [1]. Однако в нашем случае соблюдение для всех субстратов зависимости в координатах lg(kT1)–lg(kT2) (r=0,996–0,997; S=0,018–0,022) указывает на реализацию единого механизма нуклеофильного замещения. Этот факт подтверждают и величины термодинамических параметров переходного состояния(ПС).
Характер аррениусовских зависимостей для затрудненных
сульфохлоридов указывает на наличие отдаленной точки пересечения ниже
экспериментального интервала температур, то есть кинетические исследования
проводятся в предполагаемой зоне энтропийного контроля [2]. Действительно,
независимо от Х энтальпия ПС колеблется в пределах 60–67 кДж/моль, то есть
варьируется на уровне 11% от её среднего значения. Возможно, мы имеем дело
с изоэнтальпийной реакционной серией. Изменения энтропийного фактора
|TΔS≠| гораздо существеннее (51% от средней величины) и составляют 17–29 кДж/моль.
Табл – Эффективные константы и термодинамические параметры ПС для этанолиза X–ArSO2Cl при 313 К
Таким образом, реакционность исследуемой системы характеризуется большой вариабельностью энтропийного фактора ПС, что определяет значительную роль стерических взаимодействий в ПС на характер протекания процесса. И причины нестандартного проявления орто–эффекта следует искать не в смене механизма процесса, а в конформационных особенностях структуры переходного состояния SN2–типа [3,4].
- T.W. Bentley, H.C. Harris, I.S. KooJ. Chem. Soc., Perkin Trans. 2, 1988, 783.
- Рублева Л.И., Левандовский В.Ю., Мысык Д.Д., Языков Н.А. // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія. 2007. Вип. 119(9). С. 69–72.
- Mikozajczyk M. Phosphorous und Sulfur. 1986, 27, 31.
- С.І. Оковитий, Л.І. Рубльова, В.Ю. Левандовський, Хімічна термодинаміка і кінетика: збірка доповідей ІІ Міжнародної наукової конференції Донецьк: ДВНЗ "ДонНТУ", 2012. – 94 с.