Аннотация
В.Г. Матвиенко, Л.С. Нифантова, Н.Ю. Траховцов, В.В. Кулик – Флюидные фазовые равновесия в системе диоксид углерода – диэтиленгликоль – γ-бутиролактон при повышенных давлениях В ячейке переменного объема изучено равновесие жидкость – пар, жидкость – жидкость – пар в системе диоксид углерода – диэтиленгликоль – γ-бутиролактон при температурах 0–50°С и давлениях до 9 МПа. Установлены концентрационные границы области расслоения в жидкой фазе.
При подготовке природного газа к транспорту, а также при очистке технологических газов, применяемых в качестве сырья для синтеза разнообразных органических продуктов, в качестве осушителя широкое распространение получил диэтиленгликоль (ДЭГ) [1,2]. Эффективность осушки газа существенно увеличивается при понижении температуры процесса. Однако из-за высокой вязкости и высокой температуры кристаллизации ДЭГ невозможно использовать для этих целей при температурах ниже 10°С. γ-бутиролактон (γ-БЛ) по сравнению с ДЭГ обладает гораздо меньшей вязкостью и более низкой температурой кристаллизации. Смеси ДЭГ с γ-БЛ имеют невысокую вязкость и низкие температуры кристаллизации и могут быть использованы в процессах низкотемпературной осушки газа. Одним из распространенных компонентов природного газа, который необходимо удалять перед подачей газа в магистральные газопроводы, является диоксид углерода [1]. На кафедре физической и органической химии Донецкого национального технического университета ранее была изучена растворимость диоксида углерода в γ-БЛ и ДЭГ [3,4]. При высоком парциальном давлении этого газа растворимость его в ДЭГ настолько велика, что ДЭГ можно использовать и в качестве поглотителя СО2. Растворимость диоксида углерода в ДЭГ носит ограниченный характер, то есть возникает расслоение в жидкой фазе, при этом с понижением температуры область гетерогенности жидкость + жидкость2 сужается. Вторая (легкая) жидкая фаза появляется при давлении, совпадающем (в пределах ошибок определения) с давлением сжижения чистого диоксида углерода [3], что свидетельствует об очень малой концентрации в ней ДЭГ. Растворимость диоксида углерода в γ-БЛ носит неограниченный характер [4], однако при температурах, превышающих критическую температуру летучего компонента – диоксида углерода (+31,04°С), наблюдается расслоение в жидкой фазе в области составов с высоким содержанием диоксида углерода, причем с ростом температуры область расслоения расширяется. Поскольку в литературе отсутствуют данные по фазовым равновесиям в системе СО2 – ДЭГ – γ-БЛ, нами было проведено экспериментальное исследование фазового поведения этой системы при температурах 0–50°С и давлениях до 9 МПа.
Экспериментальное исследование проводилось на установке с ячейкой переменного объема [5]. Установка включала в себя снабженную малогабаритным вентилем ячейку равновесия из прозрачного кварцевого стекла, содержимое которой сжималось ртутным поршнем и перемешивалось с помощью внутренней никелевой мешалки. Движение последней вызывалось осевым перемещением наружного кольцевого магнита.
По навескам компонентов (ДЭГ и γ-БЛ) на аналитических весах готовились двухкомпонентные растворители нужного состава, которые помещались в запаиваемые стеклянные ампулы, откуда они отбирались в требуемом количестве при загрузке ячейки равновесия. Во взвешенную на аналитических весах ячейку равновесия (масса около 60 г) с помощью шприца с длинной иглой загружалось определенное количество двухкомпонентного растворителя и при вакуумировании ячейки проводилось дегазирование жидкости, после чего ячейка вновь взвешивалась для определения массы загруженного растворителя. После этого в ячейку намораживался диоксид углерода при погружении ампулы ячейки в жидкий азот. Перед подачей в ячейку диоксид углерода осушался при пропускании через слой прокаленного хлорида кальция.
Эксперимент проводился в такой последовательности. Ячейка с исследуемой системой с помощью резиновой пробки вставлялась снизу в прозрачный плексигласовый термостат и присоединялась к ртутной линии разделителя масло – ртуть. После термостатирования содержимого ячейки с помощью масляного пресса в разделителе масло – ртуть создавалось давление, превышающее возможное давление внутри ячейки при заданной температуре термостата. При открывании вентиля ячейки равновесия в последнюю поступала ртуть из разделителя, сжимая ее содержимое. Затем после установления равновесия с помощью катетометра измерялись высоты столбов жидкой и газовой фаз в ячейке. По этим данным, используя предварительно проведенную калибровку ампулы ячейки по воде, находили объемы газовой и жидкой фаз. Массу диоксида углерода в газовой фазе определяли по ее объему и литературным значениям коэффициента сжимаемости СО2 при температуре и давлении эксперимента [5]. После этого определялась масса растворенного диоксида углерода и концентрация раствора.
Температура поддерживалась и измерялась нормальным термометром с погрешностью 0,02°С. Измерение давления с помощью образцового манометра МО-100 проводилось с максимальной ошибкой 40 кПа. Высота столбов фаз в ячейке измерялась катетометром В-630 с абсолютной ошибкой 0,015 мм при высотах столбов фаз 30-100 мм. В условиях эксперимента равновесие устанавливалось в течение 2-7 минут, что определялось по постоянству давления в процессе перемешивания.
Диэтиленгликоль квалификации ч
перегонялся при давлении 0,2-0,4 кПа. Отбиралась средняя фракция
дистиллята, запаивалась в стеклянные ампулы и затем использовалась в эксперименте. Показатель преломления полученного
ДЭГ n20=1,4470, содержание воды – 0,036%.
Технический γ-бутиролактон перегоняли при давлении 0,2–0,4 кПа и для проведения эксперимента отбирали среднюю фракцию, которая запаивалась в стеклянные ампулы емкостью 15 мл. Показатель преломления полученного γ-бутиролактона n20=1,4360. Содержание воды в таком реактиве, определенное по методу Фишера, составляло 0,07 масс. %.
Диоксид углерода (углекислота пищевая), выпущенный из стандартного баллона, конденсировался в стальном баллончике емкостью 100 см3 при погружении последнего в жидкий азот. Затем три раза проводился цикл вакуумирование – оттаивание – замораживание для удаления следов неконденсирующихся примесей. Выходящий из баллончика диоксид углерода после осушки над плавленым хлоридом кальция использовался для загрузки ячейки равновесия. Чистота диоксида углерода проверялась по его критическим параметрам: критической температуре и критическому давлению. В наших опытах критическая температура составляла 31,1°С (литературные данные – 31,04-31,1°С); критическое давление 7,38 МПа совпадало с литературным в пределах ошибок эксперимента.
На рис.1 приведены изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ, равной 0,6754, на рис.2 – изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,4920.
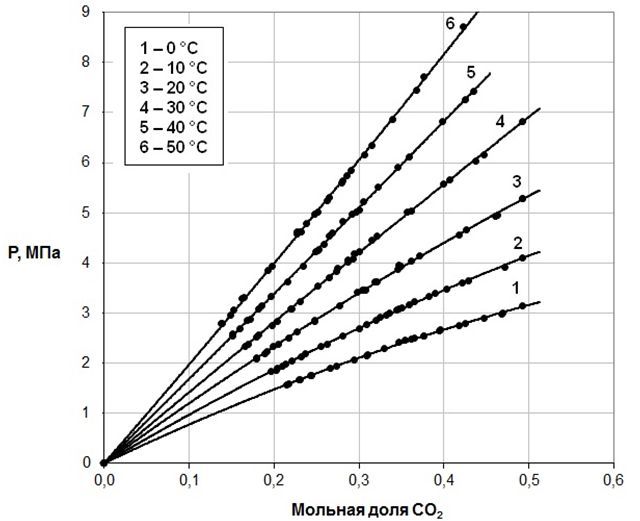
Рисунок 1 – Изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,6754
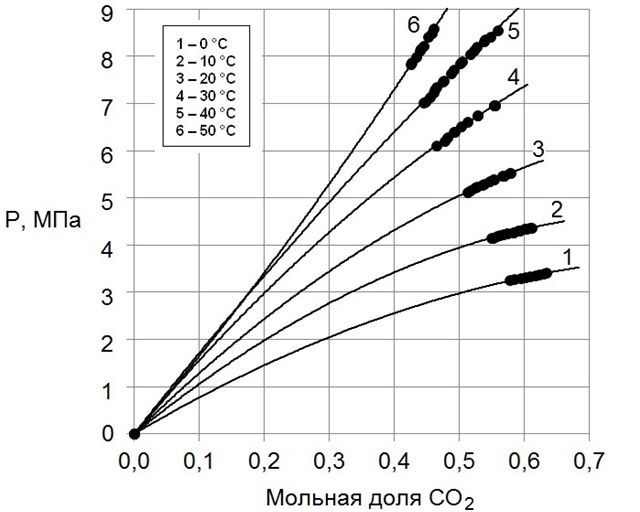
Рисунок 2 – Изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,4920
На рис.3 показаны изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,3633, на рис.4 приведены изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,3008.
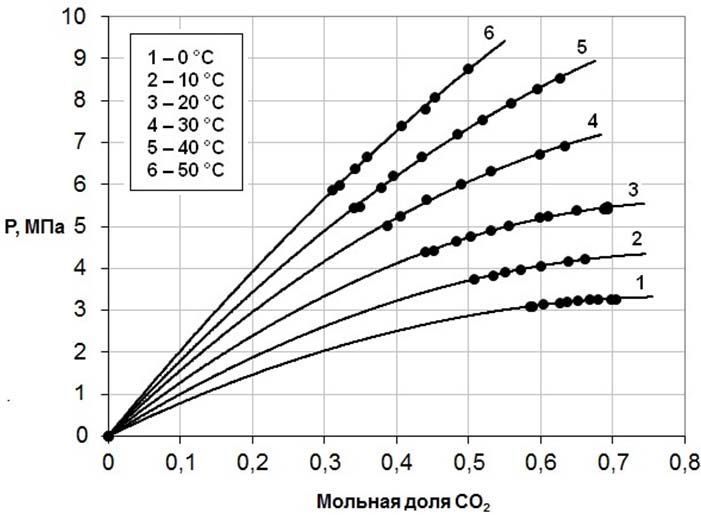
Рисунок 3 – Изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,3633
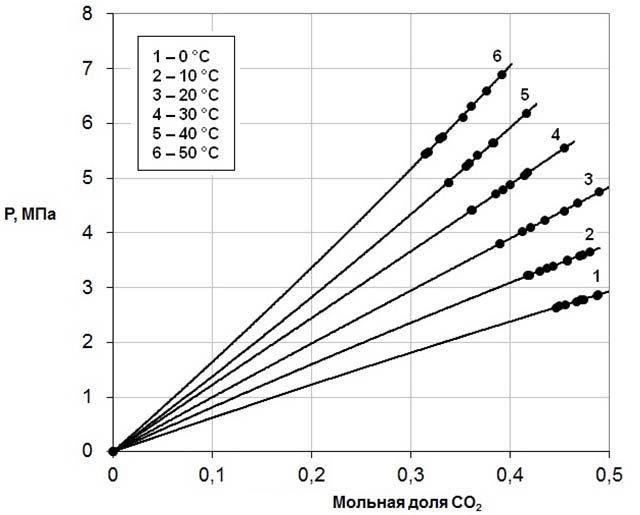
Рисунок 4 – Изотермы зависимости равновесного давления диоксида углерода от концентрации его в растворах в двухкомпонентном растворителе ДЭГ – γ-БЛ с мольной долей ДЭГ 0,3008
На рис.5 даны проекции изотерм зависимости равновесного давления диоксида углерода от концентрации его в ДЭГ, γ-БЛ, смесях ДЭГ – γ-БЛ различного состава при температуре 30°С на грань ДЭГ – СО2 объемной диаграммы состояния системы ДЭГ – γ-БЛ – СО2, на рис.6 показана кривая расслоения в жидкой фазе системы диоксид углерода – ДЭГ – γ-БЛ при температуре 30°С на треугольнике составов.
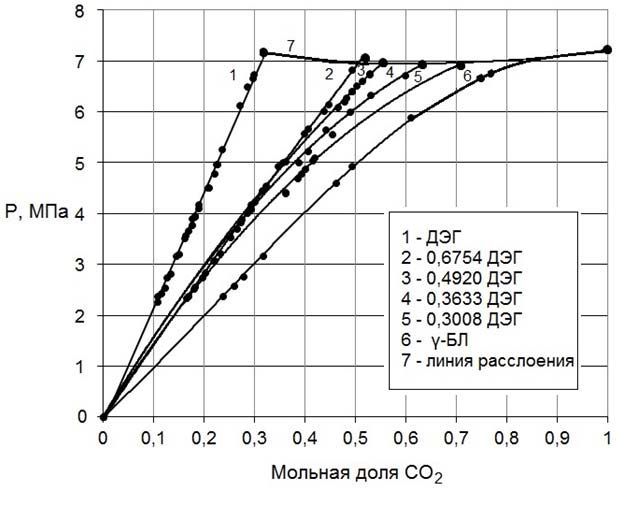
Рисунок 5 – Проекции изотерм зависимости равновесного давления диоксида углерода от концентрации его в ДЭГ, γ-БЛ, смесях ДЭГ – γ-БЛ различного состава при температуре 30°С на грань ДЭГ – СО2
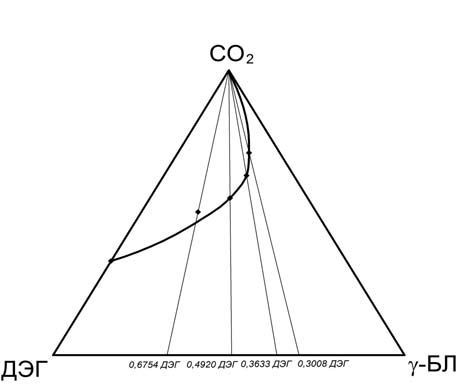
Рисунок 6 – Кривая расслоения в жидкой фазе системы диоксид углерода – ДЭГ – γ-БЛ при температуре 30°С на треугольнике составов
Как и следовало ожидать, в трехкомпонентной системе диоксид углерода – ДЭГ – γ-БЛ наблюдается ограниченная растворимость в жидкой фазе, причем область расслоения сужается при увеличении содержания γ-БЛ в растворителе. Анализ полученных данных приводит к выводу о том, что с повышением температуры область гетерогенности жидкость1 + жидкость2 в трехкомпонентной системе расширяется, критическая точка ее бинодали приближается с стороне СО2 – γ-БЛ и при температуре 34°С касается в нижней критической точке равновесия жжидкость1 + жидкость2 этой двухкомпонентной системы. Начиная с указанной температуры поле гомогеннности трехкомпонентной системы разбивается на две изолированные области, которые сужаются с повышением температуры. При этом точка пересечения двух крайних коннод (на сторонах диоксид углерода – ДЭГ и диоксид углерода – γ-БЛ) – вершина диоксида углерода. Все это говорит о том, что кривая расслоения жидкость1 + жидкость2 в трехкомпонентной системе должна быть резко ассиметричной относительно ее критической точки, то есть вторая (легкая) жидкая фаза в этой системе представляет собой диоксид углерода с очень малым содержанием других компонентов (ДЭГ и γ-БЛ). При движении точки по лучу в сторону вершины диоксида углерода в гетерогенной области жидкость1 + жидкость2 трехкомпонентной системы давление меняется очень слабо, особенно для растворителей, богатых γ-БЛ. Так, например, при температуре 30°С для растворителя с мольной долей γ-БЛ 0,6992 интервал давлений, в котором объем газовой фазы в ячейке равновесия лежал в пределах от 60 до 0% от объема всей системы, составил 69,01–69,25 бар, то есть всего 0,25 бар. Это означает, что движение точки, отвечающей смеси двух жидких фаз, проходит почти по конноде (на самом деле – по лучу), то есть конноды практически располагаются на лучах, исходящих из вершины диоксида углерода.
Полученные экспериментальные данные позволяют определить такие важные термодинамические характеристики диоксида углерода в растворе как дифференциальные молярные теплоты растворения, активности и коэффициенты активности, избыточные энергии Гиббса, энтропии и другие. Эти данные могут быть использованы для расчета и оптимизации процессов осушки и очистки от диоксида углерода природного газа с использованием смесей ДЭГ – γ-БЛ.
Список использованной литературы
- Очистка газа / Коуль А.Л., Ризенфельд Ф.С– М.: Недра, 1968. – 411 с.
- Семенова Т.А. Очистка технологических газов / Т.А. Семенова, И.Л. Лейтес и др. - М.: Химия, 1969. - 392 с.
- Матвиенко В.Г. Равновесие жидкость-пар в системе диоксид углерода – диэтиленгликоль / В.Г. Матвиенко, Л.С. Нифантова // Наукові праці Донецького національного технічного університету. Серія: хімія і хімічна технологія. Випуск 144 (12). - 2009. - С. 67–74.
- Матвиенко В.Г. Равновесие жидкость-пар и объемные свойства жидкой фазы в системе γ-бутиролактон – диоксид углерода при повышенных давлениях / В.Г. Матвиенко, Н.Л. Ярым-Агаев // ЖПХ. - 1999. - Т. 72, № 7. - С. 1085–1089.
- Ярым-Агаев Н.Л. Растворимость аргона в бензоле и гексане при повышенных давлениях / Н.Л. Ярым-Агаев, В.Г. Матвиенко, Ю.Л. Грознер // - ЖПХ. - 1995. - Т.68, № 2. - С. 198-202.
- Алтунин В.В. Теплофизические свойства двуокиси углерода / В.В. Алтунин. - М.: Изд-во стандартов, 1975. - 552 с.