Аннотация
Куковинец Е.В., Афанасенко Л.Д., Матвиенко В.Г., Калиниченко В.П. Физико-химические свойства двухкомпонентных растворов N-метилпирролидон – этиленгликоль Исследованы вязкостные и объемные свойства двухкомпонентной системы N-метилпирролидон – этиленгликоль в широком температурном интервале от +20°С до температур, близких к температурам начала кристаллизации растворов, во всей области составов. Получены уравнения для расчета мольных объемов и плотностей во всем интервале составов при температурах -10°С, 0°С, +10°С, +20°С. Сделаны предположения о наличии неспецифических взаимодействий между компонентами системы.
Настоящая работа посвящена изучению объёмных и вязкостных свойств двухкомпонентной системы N-метилпирролидон(NМП) – этиленгликоль(ЭГ). Данные по изученным свойствам представляют интерес, с одной стороны, для анализа характера взаимодействия между N-метилпирролидоном и этиленгликолем, с другой – необходимы для конструкционных и технологических расчетов, в связи с тем, что смеси, составленные из NМП и ЭГ, имеют важное практическое значение как бифункциональный поглотитель ряда компонентов из газовой фазы [1,2].
Исследования плотности и вязкости в системе NМП – ЭГ проводились в интервале температур от 20°С до температур, близких к температурам начала кристаллизации изучаемых бинарных смесей. Значения температур начала кристаллизации рассматриваемых составов были взяты из работы [3].
Определения плотности жидких смесей проводились политермическим методом с помощью установки, схема которой приведена на рис.1. Основной частью установки являлся дилатометр 1, изготовленный из кварцевого стекла. Поскольку, температурный коэффициент расширения кварцевого стекла очень низкий (при 0°С α=3,9⋅10-7К-1; при -100°С α=1,0⋅10-7К-1), емкость дилатометра оставалась практически постоянной во всем исследуемом температурном интервале. В верхней части дилатометра была нанесена поперечная метка, относительно которой фиксировалось смещение уровня жидкости при изменении температуры опыта. Для уменьшения погрешности при определении объема жидкой фазы нижняя часть дилатометра была изготовлена широкой (внутренний диаметр 1,1 см), а верхняя часть – узкой (диаметр 0,4 см). Объем дилатометра составлял около 13 см3. Сверху дилатометр герметично закрывался конусной фторопластовой пробочкой 2, запрессованной в нижнюю часть шпильки 3 перемещающейся во втулке 4 по резьбе. Перемешивание исследуемой жидкости осуществлялось с помощью согнутой в виде архимедова винта полоски из никелевой фольги 5, которая приводилась во вращение магнитной мешалкой 6. Калибровка дилатометра проводилась по воде. Объем жидкости определялся по величине смещения мениска исследуемого раствора относительно метки. Отклонение мениска от нанесенной метки на 10-3 см соответствовало изменению объема жидкой фазы на 0,01%. Положение уровня жидкой фазы определялось с помощью катетометра с погрешностью 1,5⋅10-4 см.
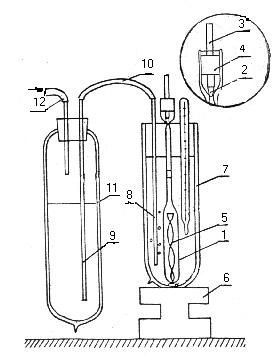
Рисунок 1 – Схема установки для определения плотности растворов при низкой температуре
1 – дилатометр, 2 – пробка, 3 – шпилька, 4 – втулка, 5 – никелевая полоска, 6 – магнитная мешалка,
7,11 – сосуды Дьюара
Дилатометр с навеской исследуемого раствора помещался в сосуд Дьюара 7 с прозрачными стенками, что давало возможность визуально определять уровень жидкой фазы. Для термостатирования при температурах ниже 0°С использовался этиловый спирт, охлаждаемый жидким азотом, который поступал по трубкам 8,9,10 из сосуда Дьюара 11. Подача жидкого азота осуществлялась путем нагнетания воздуха через трубку 12. Это позволяло поддерживать температуру термостатирующей жидкости или регулировать скорость её изменения путем изменения скорости подачи воздуха. При температурах выше 0°С для термостатирования использовалась вода, при 0°С – смесь воды и тающего льда.
Опыты по определению плотности проводились как при понижении температуры, так и при её повышении. Значения плотности, полученные в процессе охлаждения и в процессе нагревания, ложатся на одну кривую, что указывает на достижение равновесия. По описанной методике равновесие устанавливалось в течение 5-10 мин. При отсутствии перемешивания исследуемого раствора равновесие устанавливалось в течение 1-1,5 часов. Это обстоятельство было учтено при изучении смесей богатых этиленгликолем. Из-за высокой вязкости таких растворов при низких температурах перемешивание жидкости происходило менее интенсивно и время, необходимое для установления равновесия достигало 20-30 мин.
Описанная методика измерения плотности при низких температурах позволяла получать надежные данные. Ошибка в определении плотности при низких температурах не превышала 2⋅10-4 см3.
Экспериментальные определения кинематической вязкости проводились с использованием вискозиметров ВПЖ-2. Вискозиметры термостатировались в прозрачных сосудах Дьюара. При 20°С сосуд Дьюара был соединен с ультратермостатом, при 0°С для термостатирования использовалась смесь воды и тающего льда, а ниже 0°С – криогидратные смеси, составленные из льда и солей [4]. Диаметры капилляров вискозиметров подбирались таким образом, чтобы время истечения жидкости находилось в интервале от 0,5 до 3 мин. До начала измерений при низких температурах вискозиметры с исследуемыми растворами выдерживались в термостате не менее 30 мин. Для каждого исследованного состава проводилось 5-10 параллельных опытов, отклонения результатов параллельных измерений от среднего значения вязкости при 0°С не превышали 1%, при температурах ниже 0°С составляли не более 2%. Политермические зависимости плотности, полученные опытным путем, использовались для построения изотерм (рис.2.). Изотермы плотности на рис.2 ограничены пунктирной линией, отвечающей началу области кристаллизации растворов.
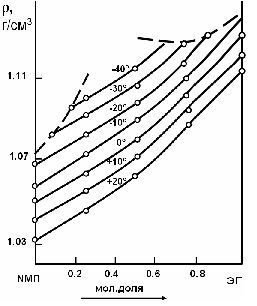
Рисунок 2 – Изотермы плотности системы N-метилпирролидон – этиленгликоль при различных температурах
Результаты определения плотности были использованы для расчета псевдомольных объемов и отклонений псевдомольных объемов от аддитивности, которые вычислялись по известным соотношениям:
V = (x1M1 + x2M2)/ρ
ΔV = V - (x1M1 + x2M2)
где V – псевдомольный объем смеси; ρ – плотность смеси; V1 и V2 – мольные объемы чистых N-МП и ЭГ; x1, x2 – мольные доли N-МП и ЭГ в смеси, соответственно; M1 , M2 – молярные массы N-МП и ЭГ.
Если принять, что для зависимости псевдомольного объема от состава, выраженного в мольных долях, выполняется уравнение регрессии третьей степени, то величина ΔV/x(1-x) должна быть линейной функцией состава.
Тогда выполняется уравнение:
ΔV/x(1-x) = k + l·x
В табл.1 приведены значения коэффициентов k и l в уравнении (3) при температурах от +20°С до -10°С, при этом в качестве переменной величины x выбрана мольная доля этиленгликоля. Для температур ниже -10°С эти значения не могли быть рассчитаны из-за кристаллизации этиленгликоля.
Таблица 1 – Значения коэффициентов k, l для системы N-метилпирролидон – этиленгликоль
| Температура, °C | k, (см3/г) | l, (см3/г) |
| +20 | -0,1298 | 0,8356 |
| +10 | -0,0688 | 0,6897 |
| 0 | 0,0936 | 0,6553 |
| -10 | 0,1856 | 0,4885 |
Данные в табл. 1 позволяют рассчитывать мольные объемы и плотности растворов NМП – ЭГ для любых составов по уравнениям 3→2→1. Среднеквадратичная относительная ошибка при расчетах мольных объемов, соответственно и плотности, составляет 0,05%.
По экспериментально найденным величинам кинематической вязкости и плотности исследованных растворов рассчитаны значения динамической вязкости (табл.2). Эти величины использованы для построения изотерм вязкости (рис.3).
Таблица 2 – Вязкость растворов этиленгликоль – N-метилпирролидон
| Мол.доля N-МП | Температура, °C | Вязкость η·10-3, Па·c | Мол.доля N-МП | Температура, °C | Вязкость η·10-3, Па·c |
| 0,000 | 10,0 | 33,9 | 0,500 | -22,0 | 31,2 |
| 6,5 | 39,9 | -25,0 | 39,0 | ||
| 0,0 | 58,1 | -34,0 | 65,0 | ||
| -10,0 | 116 | -40,0 | 79,9 | ||
| -12,0 | 121 | -48,0 | 202,1 | ||
| 0,249 | 17,0 | 13,3 | 0,752 | 15,0 | 3,65 |
| 10,0 | 17,2 | 10,0 | 4,13 | ||
| 7,0 | 19,9 | 9,0 | 4,20 | ||
| 0,0 | 26,1 | 0,0 | 5,36 | ||
| -5,0 | 32,9 | -2,0 | 5,49 | ||
| -15,0 | 58,9 | -7,0 | 6,59 | ||
| -21,0 | 87,8 | -17,0 | 9,36 | ||
| -30,0 | 209 | -32,0 | 18,2 | ||
| -39,0 | 362 | -37,0 | 21,5 | ||
| 0,500 | 19,0 | 6,35 | 1,000 | 20,0 | 1,86 |
| 0,0 | 11,3 | 0,0 | 2,94 | ||
| -7,0 | 16,3 | -10,0 | 4,13 | ||
| -9,0 | 16,5 | -20,0 | 5,87 |
Как следует из рис.2 и рис.3, при выражении состава в мол. долях изотермы плотности и вязкости смесей N-метилпирролидона и этиленгликоля монотонно выпуклы к оси абсцисс.
Интересно отметить, что добавление даже небольших количеств N-метилпирролидона к этиленгликолю резко понижает вязкость при всех исследованных температурах и в значительно меньшей степени оказывает влияние на плотность системы этиленгликоль – N-метилпирролидон. Так, добавление к ЭГ 25% мас. N-метилпирролидона при температуре -10°С снижает вязкость системы вдвое – до 0,057 Па·с, плотность системы при этом понижается на 2%. Чтобы снизить вязкость до той же величины при температуре -20°С, нужно добавить к ЭГ 42% мас. N-МП; при температуре -30°С необходимо 60% мас. NМП; а при температуре -40°С, соответственно, 67 %мас. N-МП.
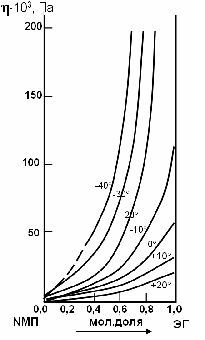
Рисунок 3 – Изотермы вязкости системы N-метилпирролидон – этиленгликоль при различных температурах.
Полученные экспериментальные данные были использованы для анализа характера взаимодействия между компонентами раствора. С этой целью проведено сопоставление экспериментальных величин вязкостей с рассчитанными по способу Фиалкова [5] в предположении отсутствия химического взаимодействия в системе при температурах 20°С, 0°С и ниже. При 20°С и 0°С экспериментальные данные практически совпадают с величинами вязкости, рассчитанными для систем с отсутствием химического взаимодействия. При более низких температурах экспериментальные данные лежат выше расчетных. Изотермы псевдомольных объемов системы ЭГ – N-МП близки к линейным. Максимальное положительное отклонение псевдомольного объема от аддитивности составляет 0,13% при температурах 0°С и -10°С.
Полученные данные говорят в пользу отсутствия химического взаимодействия между N-метилпирролидоном и этиленгликолем.
В то же время, как показано в [3], температуры начала кристаллизации этиленгликоля из растворов богатых этиленгликолем лежат значительно ниже рассчитанных по уравнению Шредера в предположении идеальности системы.
Несмотря на то, что совпадение экспериментальных и вычисленных изотерм рассматривается как признак отсутствия химического взаимодействия между компонентами, нельзя сделать однозначный вывод об отсутствии других видов взаимодействия в системе N-метилпирролидон – этиленгликоль. Оба компонента полярны, и N-МП, как и этиленгликоль, значительно ассоциирован в чистом виде [6,7]. N-метилпирролидон содержит карбонильный атом кислорода, имеющий две неподеленные пары электронов, а этиленгликоль – полярные группы —ОН, способные к образованию водородных связей [8]. Очевидно, при смешении N-метилпирролидона и этиленгликоля может происходить разрушение прoстранственной сетки водородных связей гликоля под действием апротонного растовoрителя, разрушение диполь-дипольных ассоциатов N-метилпирролидона и образование водородных связей между компонентами.
Незначительные отклонения физико-химических свойств системы N-метилпирролидон-этиленгликоль от идеальности могут быть обусловлены суммарным влиянием различных видов неспецифического и специфического взаимодействия, не приводящими к образованию комплексов определенного состава.
Литература
- Грищенко Н.Ф., Рогозкин В.А., Ласточкина И.И., Голубева К.В. Экстракция ароматических углеводородов смешанным растворителем N-метилпирролидон – гликоль // Химия и технология топлив и масел., 1974. - №10. - С. 18-20.
- Sebastianka S. Oczyszczanic gazuzicmnedo od siazkonodory przyuzyciu sorbentow selektywnych // Nafta, 1974. - №8. - С. 357-362.
- Калиниченко В.П., Афанасенко Л.Д., Короткова Е.В. Фазовые равновесия жидкость-пар, жидкость-твердое состояние системе N-метилпирролидон – этиленгликоль. - В редакции «Укр.хим.журн.».
- Справочник химика. - М.-Л.;Химия, 1964. - Т. 2. - 1168 с.
- Фиалков Ю.Я. Двойные жидкие системы. - К.: Технiка, 1969. - 206 с.
- Wagner K., Rudakoff G., Frolich P. Untersuchungen des Assozia tionsverhaltens einiger lactame in unpolaren Losunngsmitteln // Z. Chem., 1975. - Bd. 15. - N 7. - P. 272-275.
- Yonezawa T., Morischima I. Nuclear Magnetic Resonance Studies of the Intermolecular Interaction of Amides and Some Other Related Dipolar Molecules // Bulletin of Chem. Soc. of Japan, 1966. - Vol. 39. - №11. - P. 2346-2351.
- Пиментел Дж., Мак-Киллан О. Водородная связь. - М.: Мир, 1964. - 462 с.