Аннотация
Матвиенко В.Г., Ярым-Агаев Н.Л., Куковинец Е.В., Нифантова Л.С. Определение термодинамических характеристик компонентов в бинарных двухфазных системах с газовой фазой чистого компонента при повышенных давлениях Предложена методика расчета парциальных молярных теплот растворения и смешения компонентов в бинарных системах жидкость – пар с газовой фазой чистого компонента. На примере системы сероводород – диэтиленгликоль с использованием ранее полученных экспериментальных данных рассчитаны парциальные молярные теплоты растворения и смешения сероводорода, его активности и коэффициенты активности, избыточные энергии Гиббса и избыточные энтропии при температурах 0-50°C во всем интервале составов жидкой фазы.
Рассматривается задача определения термодинамических характеристик компонентов в двойных двухфазных системах жидкость-пар, в которых один компонент (компонент 1) летуч, а второй (компонент 2) – нелетуч либо малолетуч (При температурах более низких, чем критическая температура летучего компонента).
При установившемся равновесии (Р = const, Т = const) химический потенциал компонента 1 в газовой фазе (μ′1) и жидкой фазе (μ1) одинаков:
μ′1 = μ1
Если при постоянном составе жидкости и газовой фазы (чистый компонент) изменить давление на dP, то для сохранения равновесия в системе температуру нужно изменить на dT и в новом состоянии равновесия:
μ′1 + dμ′1 = μ1 + dμ1
где dμ′1 и dμ1 – соответственно изменения химических потенциалов первого компонента в газовой и жидких фазах.
Если из (2) вычесть (1), то:
dμ′1 = dμ1
Поскольку dμ′1 = V′1·dP - S′1·dT, a dμ1 = V¯1·dP - S¯1·dT, то
V′1·dP - S′1·dT = V¯1·dP - S¯1·dT
где V′1 и V¯1 – соответственно молярный объем компонента 1 в газовой фазе и парциальный молярный объем его в равновесной жидкой фазе, а S′1 и S¯1 – молярная энтропия газообразного компонента 1 и парциальная молярная энтропия его в жидкой фазе.
Преобразуя (4), получаем:
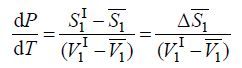
где ΔS¯1 – изменение энтропии при переходе одного моля компонента 1 из жидкой фазы в газовую.
Поскольку:

то
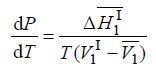
Строго говоря, производная давления по температуре – частная, взятая при постоянном составе жидкой и газовой фаз. Поскольку в рассматриваемой системе мольная доля первого компонента в газовой фазе всегда равна единице (чистый компонент), то
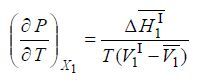
Молярный объем газа можно выразить через его коэффициент сжимаемости Z:
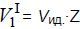
где Vид – молярный объем идеального газа.
Так как

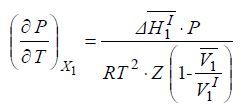
Разделив переменные, получаем:
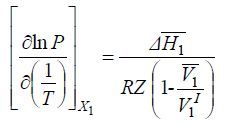
Уравнению можно придать вид:
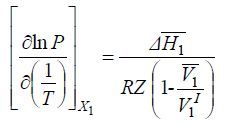
В этом уравнении ΔH¯1 – парциальная (дифференциальная) молярная теплота растворения летучего компонента 1 в растворе с мольной долей его x1 при данных значениях Р и Т. При параметрах, далеких от критических параметров летучего компонента 1 V¯1<<V1 и без заметной ошибки можно принять, что V1 = Vид, а парциальный молярный объем V¯1 = V10, где V10 – молярный объем чистого компонента 1 в жидком состоянии при данной температуре Т и давлении его насыщенного пара. Учитывая это, придаем следующий вид уравнению:
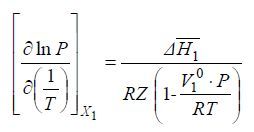
Из этого уравнения можно определить величину ΔH¯1:
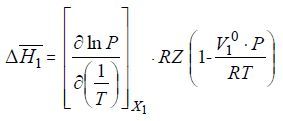
При экспериментальном изучении равновесия жидкость-пар в бинарных системах, содержащих летучий и нелетучий (малолетучий) компоненты определяют равновесные давления над растворами различного состава при разных температурах.
Парциальные (дифференциальные) молярные теплоты растворения летучего компонента определяют в следующем порядке.
На основании экспериментальных измерений строят кривые зависимости равновесного давления от температуры для данной загрузки ячейки равновесия. Эти зависимости можно аппроксимировать эмпирическими уравнениями. В координатах lnP – 1/Т эти зависимости являются линейными.
Затем на основании полученных данных определяют равновесные давления и составы жидкой фазы при выбранных значениях температур (обычно при температурах, кратных 10 К). При температурах, далеких от критической температуры летучего компонента, и при не очень высоких давлениях в системе массу летучего компонента в газовой фазе можно определять как для идеального газа.
Строят изотермы зависимости давления насыщенного пара от состава жидкой фазы. Такие зависимости можно выразить эмпирическими уравнениями.
Определяют зависимости lnP от 1/Т для растворов постоянного состава (обычно с мольной долей x, кратной 0,1). Эти зависимости в температурном интервале в несколько десятков К имеют линейный характер. Для каждого состава раствора находится тангенс угла наклона этой прямой к оси 1/Т:
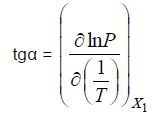
По значениям давления, отвечающим заданному составу раствора при данной температуре, и литературным данным по объемному поведению летучего компонента 1 находят величины его коэффициента сжимаемости Z.
По литературным или собственным данным определяются величины молярного объема чистого жидкого летучего компонента 1 при данной температуре и ортобарическом давлении.
По уравнению (13) определяются парциальные (дифференциальные) молярные теплоты растворения летучего компонента в растворах различного состава.
Найденные значения парциальных (дифференциальных) молярных теплот растворения летучего компонента позволяют рассчитать парциальные молярные теплоты смешения этого компонента с раствором. Парциальная (дифференциальная) молярная теплота смешения летучего компонента – это количество теплоты, сопровождающее процесс растворения одного моля жидкого компонента в растворе данного состава при постоянных Р и Т.
Для установления связи между парциальными молярными теплотами растворения и смешения летучего компонента рассмотрим следующий изотермический цикл (см. рис. 1).
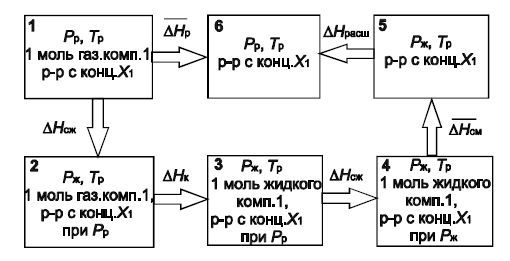
Рисунок 1 – Изотермический цикл, связывающий теплоты растворения и смешения летучего компонента
Система в состоянии 1 представляет собой один моль газообразного летучего компонента и (бесконечно) большое количество раствора при равновесных давлениях Рр и Тр.
При растворении 1 моль летучего газообразного компонента 1 в (бесконечно) большом количестве раствора при постоянных значениях давления и температуры состав раствора не изменяется и выделяется (поглощается) количество теплоты ΔH¯p (парциальная молярная теплота растворения компонента 1), и система переходит в состояние 6. Переход системы из состояния 1 в состояние 6 можно осуществить и другими путями, в частности, по пути 1–2–3–4–5–6.
На стадии 1–2 один моль летучего компонента сжимается от давления Рр до давления Рж, соответствующего давлению насыщенного пара над жидким компонентом 1 при данной температуре Тр. Этот процесс сопровождается изменением энтальпии системы на величину ΔHсж. Затем на стадии 2–3 идет конденсация одного моля летучего компонента при постоянном давлении Рж, что сопровождается изменением энтальпии на величину ΔHк (ΔHк – молярная теплота конденсации летучего компонента при давлении Рж и Тр). На стадии 3–4 происходит сжатие раствора от давления Рр до Рж и энтальпия системы меняется на величину ΔHсж
На стадии 4–5 при смешении одного моля летучего жидкого компонента 1 с (бесконечно) большим количеством раствора при Рж и Тр выделяется (поглощается) теплота ΔHсм (парциальная молярная теплота смешения компонента 1). Наконец, на стадии 5–6 происходит расширение раствора при снижении давления от Рж до Рр, сопровождающееся изменением энтальпии системы на величину ΔHрасш.
Изменение энтальпии на пути 1–6 и 1–2–3–4–5–6 одинаковы, поэтому
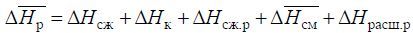
Поскольку ΔHсж.р. = -ΔHрасш.р. то
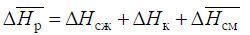
Для определения теплоты смешения необходимо рассчитать величины ΔHсж и ΔHк.
Зависимость энтальпии газообразного компонента 1 от давления при постоянной температуре выражается уравнением [1]:
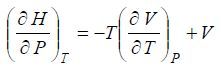
Поскольку объем одного моля газообразного компонента 1 можно выразить через его коэффициент сжимаемости Z, то
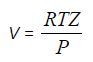
и уравнение (16) принимает вид:
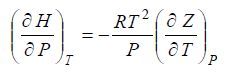
Интегрируя это уравнение, получим:
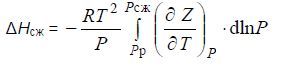
Значение интеграла определяется графически. Теплота конденсации летучего компонента 1 при данной температуре Тр определяется по уравнению (13), когда х1 = 1.
Таким образом, можно из уравнения (15) найти парциальную молярную теплоту смешения летучего компонента 1:
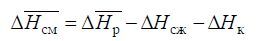
Используя уравнение Гиббса-Дюгема [1–5], можно, зная парциальные молярные теплоты растворения и смешения для летучего компонента, найти соответствующие величины и для нелетучего компонента.
Информация о параметрах равновесия (Р, Т, х) жидкость-пар в двухкомпонентных системах с газовой фазой чистого компонента позволяет определить и другие важные термодинамические характеристики его в растворе (активности и коэффициенты активности, избыточную энергию Гиббса, избыточную энтальпию, избыточную энтропию и т.д.).
На примере системы сероводород-диэтиленгликоль на основании проведенных измерений параметров фазового равновесия жидкость-пар при температурах 0-50°С во всей области концентраций жидкой фазы [7] определены указанные термодинамические характеристики летучего компонента (сероводорода).
В табл. 1 приведены парциальные (дифференциальные) молярные теплоты растворения (ΔHр), теплоты смешения (ΔHсм) и изменение энтальпии при сжатии (ΔHсж) сероводорода для его растворов в диэтиленгликоле (ДЭГ). Как следует из помещенных в таблице данных, парциальные молярные теплоты растворения и смешения сероводорода увеличиваются с ростом концентрации раствора и температуры.
Таблица 1 – Парциальные (дифференциальные) молярные теплоты растворения (ΔHр), теплоты смешения (ΔHсм) и изменение энтальпии при сжатии (ΔHсж) сероводорода для его растворов в диэтиленгликоле (ДЭГ)
| x | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
| 0,0°C | ||||||||||
| -ΔHр | 18,89 | 18,76 | 18,53 | 18,03 | 17,40 | 16,63 | 16,05 | 15,82 | 15,69 | 15,61 |
| -ΔHсж | 0,85 | 0,73 | 0,60 | 0,45 | 0,33 | 0,29 | 0,12 | 0,07 | 0,05 | 0 |
| -ΔHсм | 2,43 | 2,42 | 2,32 | 1,97 | 1,46 | 0,73 | 0,32 | 0,14 | 0,03 | 0 |
| 10,0°C | ||||||||||
| -ΔHр | 18,81 | 18,63 | 18,25 | 17,68 | 16,94 | 16,03 | 15,66 | 15,43 | 15,32 | 15,23 |
| -ΔHсж | 1,08 | 0,91 | 0,71 | 0,53 | 0,36 | 0,24 | 0,17 | 0,08 | 0,05 | 0 |
| -ΔHсм | 2,5 | 2,49 | 2,31 | 1,92 | 1,35 | 0,56 | 0,26 | 0,13 | 0,04 | 0 |
| 20,0°C | ||||||||||
| -ΔHр | 18,74 | 18,40 | 17,96 | 17,35 | 16,62 | 15,80 | 15,24 | 14,95 | 14,78 | 14,48 |
| -ΔHсж | 1,31 | 1,10 | 0,86 | 0,65 | 0,46 | 0,30 | 0,18 | 0,10 | 0,07 | 0 |
| -ΔHсм | 2,95 | 2,82 | 2,62 | 2,22 | 1,78 | 1,02 | 0,59 | 0,37 | 0,23 | 0 |
| 30,0°C | ||||||||||
| -ΔHр | 18,67 | 18,27 | 17,73 | 16,96 | 16,24 | 15,36 | 14,70 | 14,45 | 14,23 | 13,77 |
| -ΔHсж | 1,55 | 1,30 | 1,05 | 0,79 | 0,53 | 0,45 | 0,24 | 0,20 | 0,10 | 0 |
| -ΔHсм | 3,35 | 3,20 | 2,91 | 2,43 | 1,94 | 1,15 | 0,70 | 0,48 | 0,36 | 0 |
| 40,0°C | ||||||||||
| -ΔHр | 18,58 | 18,18 | 17,47 | 16,70 | 15,78 | 14,80 | 14,08 | 13,79 | 13,56 | 13,05 |
| -ΔHсж | 1,80 | 1,53 | 1,25 | 0,98 | 0,72 | 0,56 | 0,33 | 0,23 | 0,16 | 0 |
| -ΔHсм | 3,73 | 3,61 | 3,17 | 2,67 | 2,01 | 1,19 | 0,70 | 0,51 | 0,35 | 0 |
| 50,0°C | ||||||||||
| -ΔHр | 18,47 | 17,95 | 17,22 | 16,31 | 15,31 | 14,27 | 13,52 | 13,19 | 12,80 | 12,30 |
| -ΔHсж | 2,05 | 1,73 | 1,43 | 1,15 | 0,83 | 0,68 | 0,45 | 0,32 | 0,23 | 0 |
| -ΔHсм | 4,12 | 3,93 | 3,49 | 2,86 | 2,19 | 1,30 | 0,77 | 0,67 | 0,37 | 0 |
При термодинамическом описании свойств реальных растворов вместо концентрации, выраженной в мольных долях, используется другая переменная – активность [1–5].
Для расчета активности и коэффициентов активности необходимо определить летучесть сероводорода над раствором. Летучесть сероводорода можно определить по величинам коэффициета сжимаемости [6] или расcчитать, используя величину α – отклонение экспериментального объема реального газа от идеального [1].
Величина α определяется из соотношения:
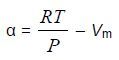
Зависимость летучести сероводорода fH2S от равновесного давления при постоянной температуре Т выражается уравнением:
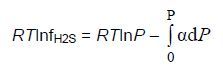
Интеграл уравнения (22) определяется графическим путем. Для этого строят график в координатах α-Р при заданной температуре и определяют площадь под кривой, которая будет равна величине интеграла. Вычисленные значения летучести по уравнению (22) сведены в табл. 2.
Таблица 2 – Летучесть сероводорода над его растворами в диэтиленгликоле
| P·10-5, Па | f·10-5, Па | P·10-5, Па | f·10-5, Па | P·10-5, Па | f·10-5, Па |
| 0,0°C | 10,0°C | 20,0°C | |||
| 1,32 | 1,30 | 1,80 | 1,76 | 2,38 | 2,34 |
| 2,64 | 2,58 | 3,62 | 3,49 | 4,81 | 4,63 |
| 3,95 | 3,79 | 5,45 | 5,18 | 7,19 | 6,76 |
| 5,27 | 5,04 | 7,27 | 6,76 | 9,63 | 8,86 |
| 6,53 | 6,07 | 9,09 | 8,30 | 11,96 | 10,78 |
| 7,78 | 7,09 | 10,77 | 9,66 | 14,03 | 12,44 |
| 8,89 | 8,02 | 11,91 | 10,58 | 15,45 | 13,55 |
| 9,47 | 8,48 | 12,69 | 11,15 | 16,57 | 14,25 |
| 9,78 | 8,74 | 13,07 | 11,46 | 17,07 | 14,64 |
| 10,34 | 9,17 | 13,78 | 11,98 | 17,94 | 15,27 |
| 30,0°C | 40,0°C | 50,0°C | |||
| 3,19 | 3,12 | 3,95 | 3,84 | 4,86 | 4,74 |
| 6,33 | 6,05 | 7,90 | 7,48 | 9,73 | 9,9 |
| 9,47 | 8,62 | 11,96 | 10,91 | 14,59 | 13,42 |
| 12,56 | 11,43 | 15,86 | 14,18 | 19,45 | 17,40 |
| 15,50 | 13,72 | 19,51 | 16,87 | 23,71 | 20,61 |
| 17,93 | 15,54 | 22,49 | 19,09 | 27,56 | 23,34 |
| 19,96 | 17,01 | 25,03 | 20,87 | 30,70 | 25,57 |
| 20,82 | 17,93 | 26,34 | 21,95 | 32,32 | 26,76 |
| 21,68 | 18,38 | 27,0 | 22,47 | 33,34 | 27,38 |
| 22,91 | 19,16 | 28,69 | 23,42 | 35,58 | 28,82 |
Активность сероводорода aH2S связана с его летучестью соотношением:
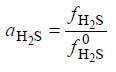
Вычисленные по уравнению (23) значения коэффициентов активности сероводорода в жидкой фазе системы сероводород – ДЭГ приведены в табл. 3.
Таблица 3 – Активность сероводорода в его диэтиленгликолевых растворах
| xH2S | t,°C | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | |
| 0,1 | 0,142 | 0,147 | 0,153 | 0,163 | 0,164 | 0,166 |
| 0,2 | 0,282 | 0,292 | 0,303 | 0,316 | 0,319 | 0,322 |
| 0,3 | 0,414 | 0,432 | 0,443 | 0,450 | 0,466 | 0,470 |
| 0,4 | 0,549 | 0,564 | 0,580 | 0,596 | 0,605 | 0,610 |
| 0,5 | 0,662 | 0,693 | 0,706 | 0,716 | 0,720 | 0,723 |
| 0,6 | 0,774 | 0,806 | 0,815 | 0,811 | 0,815 | 0,818 |
| 0,7 | 0,874 | 0,883 | 0,885 | 0,888 | 0,891 | 0,897 |
| 0,8 | 0,926 | 0,931 | 0,935 | 0,936 | 0,937 | 0,938 |
| 0,9 | 0,954 | 0,957 | 0,958 | 0,959 | 0,960 | 0,960 |
| 1,0 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 |
Как видно из табл. 3, активность сероводорода в растворе слабо зависит от температуры, особенно для растворов с высоким содержанием сероводорода. Это говорит о том, что температура слабо влияет на отклонение свойств жидкого раствора сероводорода в ДЭГ от свойств идеального раствора.
Активность используется для вычисления коэффициента активности сероводорода в растворе. Коэффициент активности γH2S связан с мольной долей сероводорода в растворе соотношением:
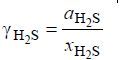
Предложенная методика расчета термодинамических характеристик компонентов бинарных систем с газовой фазой чистого компонента при повышенных давлениях позволяет провести разработку расчетных машинных программ, на входе которых будут экспериментальные данные о параметрах равновесия жидкость-пар (температура, давление, состав жидкой фазы) и объемные характеристики чистого летучего компонента и растворов, а на выходе широкий набор термодинамических характеристик компонентов и растворов.
Литература
- Карапетьянц М.Х. Химическая термодинамика. - М.: Химия, 1975. - 584 с.
- Физическая химия: Учеб. пособие для хим.-тех. спец. вузов/ Под ред. К.С.Краснова. - М.: Высш. Школа, 1982. - 687 с.
- Уэйлес Стенли М. Фазовые равновесия в химической технологии. - М.: Мир, 1989. - Ч. 1. - 304 с., Ч. 2. ? 360 с.
- Хала Э., Пик И., Фрид В., Вилим О. Равновесие между жидкостью и паром. - М: ИЛ, 1962. - 428 с.
- Термодинамика равновесия жидкость-пар / Под ред. Морачевского А.Г. - Л.: Химия, 1989. - 344 с.
- Reamer H.H., Sage B.H., Lacey W.H. Volumetric behavior of hydrogen sulfide // Ind. and Eng. Chem, 1950. - V. 42. - № 1. - Р. 140.
- Матвиенко В.Г. Растворимость и объемное поведение равновесной жидкой фазы в системе сероводород-диэтиленгликоль. ЖПХ, 2000. - Т. 73. - № 10. - С. 1627-1631.