Аннотация
Матвиенко В.Г., Нифантова Л.С. Теплоты растворения диоксида углерода в органических абсорбентах По литературным значениям свойств диоксида углерода рассчитаны его коэффициенты сжимаемости в газообразном состоянии при различных давлениях и температурах, молярные объемы равновесной жидкой фазы и теплоты конденсации. На основе ранее предложенной методики расчета парциальных молярных теплот растворения и смешения летучего компонента в бинарных системах жидкость-пар с газовой фазой чистого компонента рассчитаны дифференциальные молярные теплоты растворения диоксида углерода в толуоле, метилэтилкетоне и этилацетате в широком интервале давлений во всем диапазоне составов жидкой фаз при температурах 228-248 К. При этом использованы литературные данные о растворимости этого газа в указанных органических абсорбентах.
В процессах очистки и переработки природного и технологических газов при высоких парциальных давлениях удаляемых
компонентов широкое применение находят органические абсорбенты (т.н. физические абсорбенты
), которые не
вступают с этими компонентами в химическое взаимодействие, а образуют растворы [1,2].
Важной особенностью таких абсорбентов является то, что их емкость возрастает с ростом давления, а регенерация от
основной массы поглощенного компонента осуществляется путем понижения давления.
Для расчета технологических схем очистки газа необходима обширная информация о растворимости отдельных компонентов газовой смеси в используемом абсорбенте в широком интервале температур и давлений, а также знание термодинамических характеристик компонентов в полученном растворе. Как правило, растворимости компонентов газа в выбранных абсорбентах определяют экспериментальным путем. Для расчета и проектирования установок абсорбции и установок регенерации поглотителя требуются данные по теплотам растворения удаляемого компонента в абсорбенте. Авторы работ, в которых исследуется растворимость индивидуальных газов в абсорбентах, ограничиваются, в лучшем случае, расчетом теплоты растворения их в бесконечно разбавленном растворе. Между тем, весьма ценными являются сведения о теплотах растворения удаляемых летучих компонентов в растворах различных концентраций, т.е. дифференциальные молярные теплоты растворения. Как известно, под дифференциальной молярной теплотой растворения летучего компонента в растворе данной концентрации подразумевают то количество теплоты, которое сопровождает процесс изобарно-изотермного перехода одного моля этого компонента из газовой фазы в раствор без изменения концентрации последнего.
Нами разработан термодинамически строгий метод расчета дифференциальных молярных теплот растворения летучего компонента в малолетучем абсорбенте по данным о его растворимости в широком интервале температур и давлений [3]. При этом необходимо знать коэффициенты сжимаемости летучего компонента и его парциальный молярный объем в равновесном растворе. Рабочее уравнение для расчета дифференциальной молярной теплоты растворения летучего компонента в растворе с мольной долей его x1 при температуре T и равновесном давлении Р имеет вид:
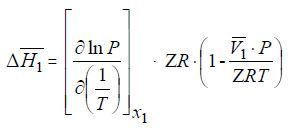
где R – универсальная газовая постоянная.
В этом уравнении произведение

дает теплоту растворения летучего компонента в бесконечно разбавленном растворе (давление над раствором мало, поэтому Z равно 1 и разность в скобках равна 1). Третий множитель Z учитывает отклонение поведения газовой фазы от идеального, а четвертый – объем летучего компонента в жидкой фазе. С ростом концентрации насыщенного раствора растет равновесное давление и влияние произведения

на величину теплоты растворения. Если при малых концентрациях раствора это произведение равно 1, то при более высоких оно может существенно отличаться от этой величины. При параметрах газовой фазы, близких к критическим параметрам летучего компонента, его теплота растворения приближается к нулю.
При температурах, далеких от критической, парциальный молярный объем летучего компонента в жидкой фазе можно заменить молярным объемом жидкого компонента, что существенно упрощает расчет.
Одним из технологически важных газов, присутствующим во многих газовых смесях, является диоксид углерода. Информация о разнообразных свойствах этого вещества приведена в монографии [4]. Уравнение 1 позволяет рассчитать теплоту конденсации диоксида углерода при различных температурах по зависимости равновесного давления его в двухфазной системе жидкость-пар от температуры, его коэффициентам сжимаемости в газообразном виде и молярным объемам в жидком состоянии. Нами рассчитаны коэффициенты сжимаемости СО2 и молярные объемы жидкого СО2 по плотностям, приведенным в [4]. С использованием уравнения 1 рассчитаны теплоты конденсации СО2 в температурном интервале от 218 К до критической температуры (304,2 К).
Зависимость lnP от 1/Т линейная (рис. 1), хорошо описывается уравнением (коэффициент корреляции равен 0,999989):

Рисунок 1 – Зависимость lnP от 1/Т для СО2
При приближении температуры диоксида углерода к критической теплотe его конденсации очень резко уменьшается (рис. 2) и в интервале 1,2 К падает от 2,6 кДж/моль до 0.

Рисунок 2 – Зависимость молярной теплоты конденсации диоксида углерода от температуры
Зависимость теплоты конденсации диоксида углерода от температуры можно аппроксимировать уравнением (коэффициент корреляции равен 0,998899)
ΔH = (4,966 ± 1,501)T5 – (1270 ± 389) T4 + (216200 ± 67070)T3 – (2,363·107 ± 7,42·106) T2 + (1,504·109 ± 4,78·108)T – (4,249·1010 ± 1,369·1010)
Зависимость молярного объема диоксида углерода от температуры описывается уравнением, справедливым в интервале температур 218-303 К (рис. 3):
V = (11 ± 3)·10-7·T2 – (1,757 ± 0,449)·10-4·T + (10,998 ± 2,895) ·10-3
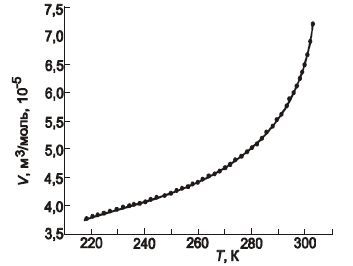
Рисунок 3 – Зависимость мольного объема диоксида углерода от температуры
Изобары коэффициентов сжимаемости диоксида углерода, рассчитанные на основании [4] приведены на рисунке 4.

Рисунок 4 – Изобары коэффициентов сжимаемости диоксида углерода
Исследованию растворимости диоксида углерода в различных органических абсорбентах посвящено много работ [5,6,7,8]. В частности, в статье [5] определена растворимость этого газа в метилэтилкетоне, этилацетате и толуоле при температурах от -25 до -45°С во всем диапазоне составов жидкой фазы. При таких низких температурах летучесть растворителей на много порядков ниже летучести диоксида углерода и их можно считать малолетучими. Например, при температуре -25°С давление насыщенного пара чистого толуола составляет 1,4·10-4 МПа [11].
Поскольку эти температуры лежат далеко от критической температуры диоксида углерода и, как установлено в работе [5], молярные объемы растворов аддитивны относительно молярных объемов чистых компонентов во всех трех системах (СО2 – толуол, СО2 – метилэтилкетон, СО2 – этилацетат) при всех исследованных температурах, то парциальный молярный объем диоксида углерода в растворе равен молярному объему чистого жидкого СО2.
В системе диоксид углерода – толуол наблюдается положительное отклонение от закона Рауля, диоксид углерода – этилацетат – отрицательное, а поведение системы диоксид углерода – метилэтилкетон близко к идеальному [5].
Приводимые данные позволили рассчитать дифференциальные молярные теплоты растворения диоксида углерода в растворах различного состава указанных систем на основании предложенной нами методики.

Рисунок 5 – Зависимость дифференциальной молярной теплоты растворения диоксида углерода от мольной доли его в растворе этилацетат – диоксид углерода

Рисунок 6 – Зависимость дифференциальной молярной теплоты растворения диоксида углерода от мольной доли его в растворе метилэтилкетон – диоксид углерода

Рисунок 7 – Зависимость дифференциальной молярной теплоты растворения диоксида углерода от мольной доли его в растворе толуол – диоксид углерода
Как следует из этих данных, для всех систем наблюдается уменьшение дифференциальной молярной теплоты растворения диоксида углерода при увеличении его мольной доли в растворе. При этом изотермы теплот растворения сходятся в одной точке, соответствующей бесконечно разбавленному раствору, а для Х(СО2) = 1 совпадают с теплотами конденсации этого компонента. Следует отметить, что теплоты растворения диоксида углерода в бесконечно разбавленном растворе для всех трех растворителей одинаковы и равны -16,5 кДж/моль, что согласуется с приведенными в работе [5] теплотами для этилацетата и метилэтилкетона, рассчитанными на основе температурной зависимости констант Генри. Для теплоты растворения диоксида углерода в толуоле в [5] приведено, по нашему мнению, несколько заниженное значение, вызванное, очевидно, недостаточной надежностью части экспериментальных данных.
Полученные значения дифференциальных молярных теплот растворения диоксида углерода могут быть использованы при расчете процесса абсорбции этого летучего компонента из газовых смесей, а также для расчета теплот смешения жидкого диоксида углерода с толуолом, этилацетатом, метилэтилкетоном.
Литература
- Коуль А.Л., Ризенфельд Ф.С. Очистка газа. - М.: Недра, 1968. - 411 с.
- Справочник азотчика. – М.: Химия, 1976. - 476 с.
- Матвиенко В.Г., Ярым-Агаев Н.Л., Куковинец Е.В., Нифантова Л.С. Определение термодинамических характеристик компонентов в бинарных двуфазных системах с газовой фазой чистого компонента при повышенных давлениях // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія, 2007. - Вип. 119 (9). - С. 44 - 54.
- Алтунин В.В. Теплофизические свойства двуокиси углерода. - М.: Из-во стандартов, 1975. - 552 с.
- Шендерей Е.Р., Зельвенский Я.Д., Ивановский Ф.П. Растворимость двуокиси углерода в метилэтилкетоне, этилацетате и толуоле под давлением при низкой температуре // Хим. пром., 1960. - № 5. - С. 370-374.
- Зубченко Ю.П., Шахова С.Ф., Ладыгина О.П. Растворимость двуокиси углерода в N-метилпирролидоне под давлением // Хим. пром., 1985. - № 9. - С. 535-536.
- Зубченко Ю.П., Шахова С.Ф., Дин Вэй, Тительман Л.И., Каплан Л.К. Фазовые равновесия и объемные соотношения в системе пропиленкарбонат – двуокись углерода // Хим. пром., 1971. - № 9. - С. 2044-2047.
- Бездель Л.С., Теодорович В.П. Растворимость углекислоты, сероводорода, метана и этилена в метаноле при низких температурах // Газовая промышленность, 1958. - №8. - С. 38.
- Ярым-Агаев Н.Л., Матвиенко В.Г. Активности компонентов в системах при повышенных давлениях. Система γ-бутиролактон – диоксид углерода // Наукові праці ДонНТУ. Серія: Хімія і хімічна технологія, 2001. - Вип. 33. - С. 3-7.
- Матвиенко В.Г., Ярым-Агаев Н.Л. Равновесие жидкость - пар и объемные свойства жидкой фазы в системе γ-бутиролактон - диоксид углерода при повышенных давлениях // ЖПХ, 1999. - Т. 72. - № 7. - С. 1085-1089.
- Справочник химика. - Л.-М.: ГХИ, 1962. - Т. 1. - 1071 с.