Дослідження оксигенованих комплексів в системі кобальт(ІІ)-аланіланін-дипіридил-кисень
Автор: Богоявленська Г.Є., Ганнова Ю.М.
Источник: Охорона навколишнього середовища та раціональне використання природних ресурсів — 2014 / Матерiали ХХIV Всеукраїнської наукової конференцiї
аспiрантiв і студентів. — Донецьк, ДонНТУ — 2014, Том 2, с. 104–105.
Анотація
Богоявленська Г.Є., Ганнова Ю.М. Дослідження оксигенованих комплексів в системі кобальт(ІІ)-аланіланін-дипіридил-кисень В данній доповіді йдеться про взаємодію молекулярного кисню з координаційними з'єднаннями перехідних металів. Це надає можливість використання комплексних з'єднань, а саме з'єднань кобальту, як синтетичних переносників кисню, що грає дуже важливу роль у розвитку сучасної медицини.
Серед різноманітних координаційних з'єднань особливо цікаві комплексні з'єднання перехідних металів з молекулярним киснем, і проблема оборотної взаємодії О2 з комплексами металів надзвичайно важлива. Це, передусім, пов'язано з тим, що на основі якого типу координаційних з'єднань можна створювати каталізатори високої ефективності для окислення ряду органічних сполук.
Разом з цим, вивчення процесів оксигенації координаційних з'єднань d-елементів важливо і з точки зору дослідження будови і властивостей переносників молекулярного кисню в живому організмі. Здатністю координувати молекулярний кисень володіють комплексні з'єднання певної будови більшості елементів першого перехідного ряду, а також d-елементів VIII групи в нижчих мірах окислення. Ефективність взаємодії комплексів цих металів з молекулярним киснем визначається геометричною будовою комплексів, складом найближчої координаційної сфери, природою і донорними властивостями ліганда, що займає транс-положення.
Синтетична доступність і практично невичерпні можливості координаційних з'єднань біогенних 3d-металлів з фізіологічно активними органічними компонентами відкрили широкі перспективи в створенні прогнозованих з'єднань для вирішення конкретних завдань медицини, оскільки комплексоутворення металів з фізіологічно активними лігандами у багатьох випадках, як правило, призводить до зменшення токсичності і зростання біоактивності іонів металів, надає сумарні і специфічні біологічні якості, не властиві початковим компонентам.
Переносниками кисню зазвичай бувають комплекси металів, здатні оборотно приєднувати кисень. Оборотність приєднання і відщеплення молекулярного кисню комплексом повинна забезпечуватися легкістю зміщення електронів усередині комплексу і невеликою різницею в стійкості обох його станів.
Штучні переносники кисню — це хімічні сполуки, що використовуються для збільшення об'єму кисню в крові, а також можуть служити моделями активних центрів в складних біологічних з'єднаннях(гемоглобіні, міоглобіні, гемеритрині, гемоціанині, хлорокруорині, гемованадині). Активні центри зв'язування кисню вказаних природних з'єднань містять іони заліза, міді, ванадію. Найближче оточення центрального іона металу природних переносників О2 є гемом, як в міоглобіні або гемоглобіні, або амінокислотні залишки, як в гемеритрині.
З'ясування закономірностей, що визначають механізми поглинання молекулярного кисню його природними переносниками і його утилізації, дуже ускладнено із-за високої молекулярної маси білкової частини багатьох природних молекул. Рішення проблем геометричної і електронної будови цих з'єднань і механізму їх дії значно полегшується при використанні простих модельних систем — комплексів перехідних металів з О2.
Близькими до природних переносників О2 виявилися комплекси металів першого перехідного ряду в низьких мірах окислення (Мn(II), Fe(II), Сo(II), Ni(II), Сu(I)). Вони (особливо з'єднання Сo(II)) здатні оборотнооксигенуватися у водних розчинах і мають склад внутрішньої координаційної сфери, аналогічний природним активним центрам. Прикладами таких переносників можуть бути перфторкарбонати (PFCs), переносники на основі гемоглобіну (LEHs).
Оксигеновані комплекси металів другого і третього перехідних рядів менш цікаві моделі природних переносників молекулярного кисню. Вони утворюються в неводних середовищах і, як правило, містять метал в ступені окислення 0 або +1, що не знаходить аналогії в живій природі.
Штучні переносники кисню можуть бути використані, коли справжня кров недоступна, є ризик зараження якою-небудь інфекцією або ж немає часу на те, щоб перевірити сумісність крові донора і реципієнта. Проте, ці продукти використовуються мало, вони постійно удосконалюються, вимагають проводити більше наукових досліджень і клінічних випробувань.
Кисневі з'єднання металів, що оборотно приєднують кисень можуть служити моделями природних носіїв молекулярного кисню: гемоглобіну, гемэритрину, гемоціанину.
Синтетичні носії молекулярного кисню представляють і поза сумнівом технічний інтерес: є потенційною робочою речовиною для отримання кисню з атмосфери в м'яких умовах; можуть служить каталізаторами в гомогенно-каталітичних окислювально-відновних реакціях(оскільки при координації молекулярного кисню відбувається його активація); використовуватися для підвищення ефективності роботи позитивного електроду в паливних елементах; для глибокого очищення рідин і газів від кисню, служити антиоксидантами. З відомих нині комплексів, що оборотно зв'язують молекулярний кисень, велику частину складають комплексні з'єднання кобальту з різними лігандами: амінами, амінокислотами, порфіринами.
Молекула кисню при взаємодії з комплексами перехідних металів є в основному акцептором електронів, про що свідчать результати досліджень з використанням різних методів.
Синтетичні переносники кисню можуть бути застосовані при створенні нових лікарських препаратів, застосовуватися в киснетерапії. Також, вони мають широке застосування в сфері промисловості. Вони можуть служити джерелами чистого кисню для різних технологічних цілей. Чистий кисень або повітря, що збагачене киснем, використовується при отриманні багатьох металів.
Усе вищезгадане робить актуальними дослідження, пов'язані з вивченням взаємодії молекулярного кисню з координаційними з'єднаннями перехідних металів.
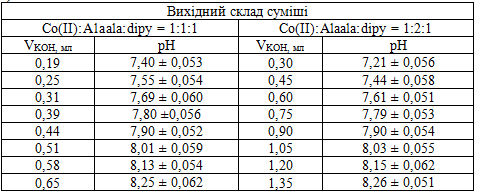
На першому етапі експериментальних досліджень нами вивчалося комплексоутворення у системі кобальт(ІІ) – дипіридил – аланілаланін в інертній атмосфері [3]. У таблиці 1 приведені дані рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), аланілаланіну та дипіридилу (мольне співвідношення 1:1:1 та 1:2:1).
Таблиця 1 — Дані рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), аланіланіну та дипіридилу в інертній атмосфері при t = 25°С, μ = 0,1 (KNO3)
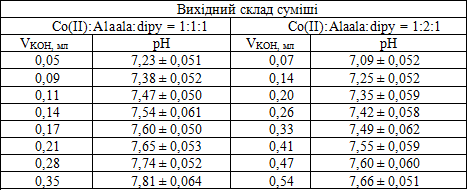
На другому етапі досліджень вивчалося комплексоутворення та оксигенація у системі кобальт(ІІ)-аланілаланін-дипіридил в атмосфері повітря. В таблиці 2 наведені данні рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), аланілаланіну та дипіридилу (мольне співвідношення 1:1:1 та 1:2:1) в атмосфері кисню.
Таблиця 2 — Дані рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), гліцилаланіну та дипіридилу (мольне співвідношення 1:1:1 та 1:2:1) в атмосфері кисню, при t = 25°С, μ = 0,1 (KNO3), [O2] = =2,5×10-4 моль/дм3
Загальна схема рівноваг процесу комплексоутворення та оксигенації в змішанолігандній системі кобальт(ІІ) – аланілаланін – дипіридил – кисень в атмосфері повітря включає 32 реакції.
На третьєму етапі планується розрахунок констант рівноваги та крівих розподілу усіх стадій процесу.
Перелік посилань
1. Братушко, Ю.И. Координационные соединения 3d-переходных металлов с молекулярным кислородом / Ю.И. Братушко. — К.: Наукова Думка, 1987. — 168 с.
2. Гринберг, А.А. Введение в химию комплексних соединений / А.А. Гринберг. — М.: Химия, 1971. — 371 с.
3. Катишева, В.В. Виявлення умов утворення оксигенованих комплексів в системі кобальт(ІІ)-гліцілаланін-кисень / В.В. Катишева, Ю.М. Ганнова // Тези доповідей XXII Всеукраїнської конференції студентів та аспірантів Охорона навколишнього середовища та раціональне використання природних ресурсів
, Т-2-Донецьк: ДонНТУ,2012, c. 98