Використання синтетичних переносників кисню у сучасній медицині
Автор: Богоявленська Г.Є., Ганнова Ю.М.
Источник: Екологічні проблеми промислових регіонів / Матерiали ІІ Всеукраїнської молодіжної науково-практичної конференції. — Рубіжне, СНУ — 2014.
Анотація
Богоявленська Г.Є., Ганнова Ю.М. Використання синтетичних переносників кисню у сучасній медицині Розглянуті властивості та особливості використання синтетичних переносників кисню.
На сьогоднішній день важливою світовою проблемою є процес одержання синтетичних переносників кисню.
Переносниками кисню зазвичай бувають комплекси металів, здатні оборотно приєднувати кисень. Дослідження хімічної природи і будови цих з'єднань дозволяє формально розглядати їх як з'єднання, в яких молекулярний кисень відновлений до пероксо- або супероксо- аниона, а іон металу відповідно підвищив свою міру окислення [1].
Комплексоутворення молекулярного кисню може мати місце у ряді процесів гетерогенного каталітичного окислення, автоокислення комплексних з'єднань, а також у біохімічних процесах. Механізм дії і функції носіїв кисню в таких процесах зазвичай з'ясовують за допомогою гомогенних моделей. Як модельні об'єкти найчастіше використовуються комплекси перехідних металів, які здатні зв'язувати молекулярний кисень.
Здатністю координувати молекулярний кисень володіють комплексні з'єднання певної будови більшості елементів першого перехідного ряду в низьких мірах окислення (Мn(II), Fe(II), Сo(II), Ni(II), Сu(I)), а також d-елементів VIII групи в нижчих мірах окислення. Ефективність взаємодії комплексів цих металів з молекулярним киснем визначається геометричною будовою комплексів, складом найближчої координаційної сфери, природою і донорними властивостями ліганда, що займає транс-положення [1].
Синтетична доступність і практично невичерпні можливості координаційних з'єднань біогенних 3d-металлів з фізіологічно активними органічними компонентами відкрили широкі перспективи в створенні прогнозованих з'єднань для вирішення конкретних завдань медицини, оскільки комплексоутворення металів з фізіологічно активними лігандами у багатьох випадках, як правило, призводить до зменшення токсичності і зростання біоактивності іонів металів, надає сумарні і специфічні біологічні якості, не властиві початковим компонентам.
Штучні переносники кисню — це хімічні сполуки, що використовуються для збільшення об'єму кисню в крові.
Прикладами таких переносників можуть бути перфторкарбонати (PFCs), переносники на основі гемоглобіну (LEHs). Штучні переносники кисню можуть бути використані, коли справжня кров недоступна, є ризик зараження якою-небудь інфекцією або ж немає часу на те, щоб перевірити сумісність крові донора і реципієнта. Проте, ці продукти використовуються мало, вони постійно удосконалюються, вимагають проводити більше наукових досліджень і клінічних випробувань [2].
Кисневі з'єднання металів, що оборотно приєднують кисень можуть служити моделями природних носіїв молекулярного кисню: гемоглобіну, гемэритрина, гемоціанину та ін.
Найбільший інтерес представляють змішанолігандні дикисневі комплекси, що містять у внутрішній сфері разом з акцепторними лігандами типу 1,10-фенантролін, фрагменти білків амінокислоти або пептиди. Такі комплекси за типом організації аналогічні природним переносникам О2, як відомо, мають високу ефективність.
Одна з основних, найважливіших функцій крові — транспорт кисню і забезпечення їм усіх життєво важливих систем організму включаючи його доставку до органів і тканин, з одночасним виведенням двоокису кисню. Порушення нормального дихання і кровообігу призводить до гіпоксії і, як наслідок, до великої поразки тканин.
Переливання гомологічної крові допомагає успішно підтримувати транспорт кисню. Але наявність таких побічних ефектів, як реакції і ускладнення гемотрансфузій, імуносупресія і гемотрансмасивні інфекції, визначила напрям і пошук штучних замінників транспорту кисню.
Особливе положення серед металів першого перехідного ряду по здатності утворювати координаційні з'єднання з О2 займає кобальт. Більшість відомих нині координаційних з'єднань 3d-перехідних металів з О2 складають з'єднання кобальту із співвідношенням Со:О2 = 2:1 і 1:1 [1].
Відомі декілька різновидів лігандів, які, координуючись у Со(II), створюють умови для оборотного утворення комплексів з О2: підстави Шиффа, порфірини, аміни, макроциклічні аміни, поліаміни, амінокислоти, комплексони, пептиди, поліпептиди.
Розгляд основних типів координаційних з'єднань кобальту з О2 показує, що у більшості з них координаційне число рівне шести. Іон кобальту в оксигенованих комплексах пов'язаний з лігандами головним чином через атоми азоту (як правило, не менше трьох) і кисню.
Координаційні з'єднання Со(II) з підставами Шиффа є першими синтетичними переносниками кисню. Значна частина робіт по координаційних з'єднаннях кобальту з О2 присвячена комплексам з лігандами цього типу.
Підстави Шиффа в оксигенованих комплексах є тетра- (хромофор N, N, 0, 0) або пентадентатні (хромофор N, N, N, 0, 0) ліганди, отримані конденсацією відповідного кетону з амінами. Оксигеновані комплекси кобальту з лігандами вказаного типу є парамагнітними одноядерними з'єднаннями Со:О2 = 1:1 [1].
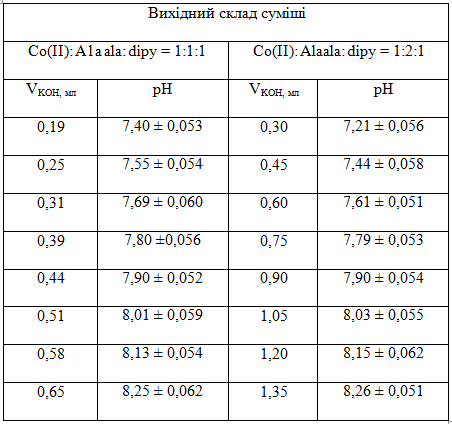
У ході експериментальних досліджень вивчалось комплексоутворення у системі кобальт(ІІ)-дипіридил-аланілаланін в інертній атмосфері [3].
У таблиці 1 приведені дані рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), аланілаланіну та дипіридилу (мольне співвідношення 1:1:1 та 1:2:1).
Необхідне подальше вивчення властивостей отриманих у системі оксигенованих біядерних комплексів кобальту, з метою визначення оптимальних умов їхнього утворення для подальшого застосування як синтетичних переносників кисню, у перспективі з використанням отриманих препаратів для відновлення кисневої ємності крові при комбінованих термічних травмах.
Тому далі планується вивчення комлексоутворення в системі в атмосферному повітрі та розрахунок констант рівноваги та крівих розподілу усіх стадій процесу.
Таблиця 1 — Дані рН-метричного титрування лугом розчину суміші солі кобальту(ІІ), аланіланіну та дипіридилу в інертній атмосфері при t = 25°С, μ = 0,1 (KNO3)
Перелік посилань
1. Братушко Ю.И., Координационные соединения 3d-переходных металлов с молекулярным кислородом / Ю.И. Братушко. — К.: Наукова Думка, 1987. — 168 с.
2. Эйхгорн Г., Неорганическая биохимия / Г.Эйхгорн. — М.: Мир, 1978. — 737 с.
3. Катишева, В.В. Виявлення умов утворення оксигенованих комплексів в системі кобальт(ІІ)-гліцілаланін-кисень / В.В. Катишева, Ю.М. Ганнова // Тези доповідей XXII Всеукраїнської конференції студентів та аспірантів Охорона навколишнього середовища та раціональне використання природних ресурсів
, Т — 2 — Донецьк: ДонНТУ,2012. — 120с.