Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность, цель и задачи исследования и запланированные результаты
- 2. Полигоны Донецка
- 3. Фильтрат полигонов ТБО
- 4. Очистка фильтрата полигонов ТБО
- 5. Физико-химические основы процесса адсорбции
- 6. Активация минеральных сорбентов
- 7. Активация минеральных сорбентов
- 7.1 Сорбционная способность активированного глауконита относительно иона аммония
- 7.2 Сорбционная способность активированного глауконита относительно фенола
- Выводы
- Список источников
Введение
Одной из наиболее острых экологических проблем в Донецкой области является проблема обращения с отходами. Накопленные в области в больших количествах отходы отрицательно влияют на окружающую среду. Площадь земель, отведенная под отходы, приближается к 2% общей территории области [1].
Из-за отсутствия заводов по переработке отходов, используемых в качестве вторсырья, и обезвреживания токсичных отходов, опасные отходы хранятся под открытым небом на специальных полигонах, что не всегда соответствует экологическим требованиям. Интенсивное образование и складирования опасных отходов отрицательно влияет на окружающую среду, способствует активизации экзогенных геологических процессов, изменению физико-механических свойств и состава почв [1].
1. Актуальность, цель и задачи исследования и запланированные результаты
В настоящее время есть необходимость разработки и внедрения экологически и экономически безопасных технологий и оборудования для обезвреживания и переработки огромного количества бытовых и промышленных отходов, а также их производных — фильтрата и биогаза, образующихся в результате разложения отходов.
Цель: поиск метода, обеспечивающего эффективность очистки с учетом различных сопутствующих факторов, а именно: мощности полигона и требований к показателям очищенного фильтрата.
Влияние фильтрата на поверхностные и в, большей степени, на подземные воды являются основным фактором негативного влияния полигона.
Для исследования возможности применения природного сорбента при очистке фильтрата поставлены следующие задачи:
1 — рассмотреть образование фильтрата на полигонах ТБО, описать наиболее оптимальный способ очистки;
2 — исследовать экспериментально сорбционную активность химически модифицированного глауконита по стандартным методикам и определить сорбционные свойства.
2. Полигоны Донецка
Полигоны (точнее, свалки — в нынешнем их виде) твердых бытовых отходов (ТБО) значительно ухудшают окружающую среду [2].
Полигон является специальным сооружением, предназначенным для централизованного складирования (изоляции) ТБО. Условия его функционирования призваны обеспечить надежность в вопросах охраны окружающей среды и санитарно-эпидемиологической безопасности для населения [2]. В таблице 2.1 приведены характеристики полигонов ТБО г. Донецк.
Таблица 2.1. — Характеристики полигонов ТБО г. Донецк [3]
| Полигон | Год открытия | Среднегод. прием ТБО (т) | Площадь рабочего тела, га | Глубина, м (ср.) |
| Ларинский | c 1993 г. | 135000 | 20 | 15 |
| Чулковский | с 1979 г. | 40000 | 3,1 | 6 |
| Петровский | с 1972 г. | 44000 | 3,5 | 10 |
Эксплуатация полигонов ведется без учета экологических требований, таких как наличие дренажной системы для отвода фильтрата и изолирующего экрана. К тому же существующие полигоны или давно уже выработали свой нормативный срок и ТБО свозят на них из-за отсутствия какой-либо альтернативы, или ресурс полигонов практически исчерпан [3].
В таблице 2.2 приведено содержание неорганических и органических соединений в подземных водах в районе полигонов ТБО г. Донецк.
Таблица 2.2 — Содержание неорганических и органических соединений в подземных водах в районе полигонов ТБО г. Донецк, мг/дм3 [4]
| Компоненты (вещества и ионы) | NH4 | Феноли | Нафтопродукти |
| ПДК | 2,0 | 0,1 | 0,3 |
| Петровский | 1,8 | 0,01 | 0,1 |
| Ларинский | 1,9 | 0,01 | 0,1 |
| Чулковский | 2,6 | 0,01 | 0,15 |
Закон Украины Об отходах
регламентируя полномочия местной государственной администрации, обязывает в ст. 20 Организовывать сбор и удаление бытовых и других отходов, создавать полигоны для их захоронения, осуществлять раздельный сбор полезных компонентов...
[5]. Если проанализировать количество ТБО ежегодно вывозящегося из разных городов, в млн. м3, то лидером здесь является Донецкая (4,9), Днепропетровская (3,56) области, и г. Киев (4,3). Всего же показатель вывезенных за год отходов по Украине составляет 49,79 млн. м3 при населении 46,9 млн. [3].
В Украине по самым смелым подсчетам полигонами можно считать не более 10% свалок [3,5]. Как известно свалка это тяжелое испытание для окружающей среды и населения прилегающих районов, она отравляет своим существованием почву, поверхностные и подземные источники, воздух, убивает флору и фауну. Также являеться источником тяжелых инфекционных заболеваний, переносимых мухами, комарами, грызунами. В течении эксплуатации полигонов выделяется так называемый фильтрат — жидкая коричнево-бурая составляющая ТБО с резко выраженным гнилостным запахом [6].
3. Фильтрат полигонов ТБО
Ефективних технологий очистки и утилизации фильтрата в данное время не существует. Основными источниками образования фильтрата в теле полигона [3]:
а) исходная влажность отдельных компонентов;
б) атмосферная влага;
в) влага, образуется в результате биохимических процессов в теле полигонов ТБО.
Фильтрационные воды отличаются неравномерностью накопления в течение года за счет сезонности атмосферных осадков. На практике принято различать так называемый молодой
и старый
фильтрат. Молодой
образуется на первых этапах разложения отходов который продолжается до 5–10 лет, характеризуется средним значением рН и высоким значением БПК, иногда до 40000 мгО2/дм3. Старый фильтрат образуется в основном на постэксплуатационном этапе жизнедеятельности полигона и характеризуется БПК около 200–400 мгО2/дм3 [5,7]. Основными источниками образования фильтрата являются продукты анаэробного разложения ТБО, проникновения атмосферных осадков. Поэтому целесообразно, чтобы избежать последнего фактора и распространения болезнетворных микроорганизмов с помощью различных представителей фауны использовать на пунктах сбора мусора закрыте пластиковые разноцветные контейнеры с надписями на каждом из них стекло
, бумага
, и т.п. [5,7] .
4. Очистка фильтрата полигонов ТБО
Химический состав фильтрата в основном зависит от морфологического состава ТБО и времени пребывания в теле полигона. Анализ фильтрата свидетельствует о широком многообразии химических элементов и их концентрации [5]. При исследовании химического состава фильтратов полигонов твердых бытовых отходов определяются только обычные, предусмотренные нормативными документами, компоненты сточных вод [8].
Таким образом, состав фильтрата является определяющим фактором при выборе схемы очистки, как правило, выделяют физико-химическую, биологическую очистку или их комбинирование [5].
Использование сорбционной очистки эффективно при очистке низкоконцентрованих фильтрационных вод и как доочистка на любом этапе жизнедеятельности полигона ТБО [9].
Итак, существует много методов, среди которых эффективнее сорбционный метод. В качестве сорбента обычно используют активированный уголь, но стоимость очистки очень велика. Последнее время все больше распространяются не углеродные природные сорбенты, среди которых значительное место занимает глауконит. Эффективность практического использования глауконита в качестве сорбционного материала зависит от его пористой структуры, удельной поверхности, формы и размера зерен, а также других структурно-геометрических характеристик, совокупность которых называют текстурой сорбента [10].
С каждым годом расширяется круг научно-технических задач, связанных с использованием адсорбционных процессов [11].
Адсорбционное разделения и очистка веществ достаточно давно применяется в различных отраслях химической, нефтехимической, газовой, фармацевтической и пищевой промышленности [12]. На территории Украины расположены одни из крупнейших в мире залежей нерудных ископаемых. Важное место в их структуре занимают природные адсорбенты и катализаторы — алюмосиликатные соединения, которые сосредоточены в более сорока месторождениях. Эти вещества в естественном состоянии или после простой обработки (измельчения, сушка и т.д.) пригодны для очистки, разделения многокомпонентных смесей, изменения ионного состава жидкостей [13].
К сорбционным материалам существует ряд требований, а именно [14]:
а) высокая сорбционная способность;
б) высокая скорость извлечения вещества;
в) высокая устойчивость в водных средах (химическая, механическая, радиационная);
г) доступность, простота синтеза, оптимальная стоимость.
В частности, перспективным является применение как адсорбентов природных дисперсных сорбентов, обосновывается рядом преимуществ, а именно [15,16]:
- Природные сорбенты широко распространены в Украине.
- Природные сорбенты доступные, недорогие материалы.
- Адсорбционные технологии с использованием природных дисперсных сорбентов обеспечивают высокую степень очистки.
- Отработанный природный адсорбент не требует регенерации.
Вместе с тем природные дисперсные сорбенты имеют ценные свойства, среди которых — развитая удельная поверхность, высокие адсорбционные и ионообменные свойства, что обусловливает их широкое применение в промышленности и в сельском хозяйстве [16].
Исследования показали, что для всех типов сорбентов адсорбция проходит как по механизму физической сорбции молекул, так и по механизму ионного обмена [15,17].
Поскольку растворители сорбируются на природных дисперсных сорбентах преимущественно по механизму физической сорбции, целесообразно применять природные дисперсные сорбенты с большими входными окнами
адсорбционного пространства, способными адсорбировать большие молекулы растворителей [15]. В последнее время значительное внимание исследователей привлекают адсорбционные методы очистки газовых и жидких сред от загрязнителей, в том числе с применением природных дисперсных сорбентов — цеолитов, бентонитов, палигорскитив, глауконитов [16]. Применение глауконита позволяет удалить из загрязненных вод радиоактивные изотопы (на 65–98%), тяжелые металлы Cu2+, Ni2+, Fe3+, Pb3+, Sb3+ (94,8–100%), Cr3+, As3+ (33,6–33,8%), эффективно очищать промышленные стоки также от взвешенных веществ, поверхностно-активных веществ, гербицидов, пестицидов, фенолов, текстильных красителей т.п.. Еще одной особенностью применения глауконита является его пролонгированное действие и максимально низкий процент десорбции (2–8%), то есть отпадает необходимость в утилизации продукта очистки [18].
5. Физико-химические основы процесса адсорбции
Термодинамическая система, состоящая из двух и более фаз, называется гетерогенной. В гетерогенной системе фазы отделены друг от друга поверхностями раздела. Вблизи поверхности физико–химические свойства фазы отличаются от свойств в объеме фазы. Так энергия молекул на поверхности отличается от энергии молекул в глубине фазы. Это связано с тем, что связи молекул, находящихся в поверхностном слое ненасыщенные. Характер движения молекул на поверхности будет другим, чем в середине твердого тела. Вследствие этого концентрация растворенного вещества на поверхности фазы отличаться от концентрации растворенного вещества в глубине фазы. Такое явление получило название поверхностного сгущения компонента [19].
Поверхностное сгущения компонента, приходящихся на единицу площади поверхности фазы, называется адсорбцией:
nповik = Гik
где nповik — поверхностное сгущение i-го компонента на k-й поверхности;
Гik — адсорбция i-го компонента на k-й поверхности.
Твердое тело, на поверхности которого происходит адсорбция, т.е. концентрирования газа или пара, называется адсорбентом, а вещество, поглощается из объемной фазы — адсорбатом [19,20].
Зависимость равновесной величины индивидуальной адсорбции вещества (целевого компонента) при постоянной температуре от его содержания в объемной фазе называют изотермой адсорбции. Поддержание постоянной температуры обеспечивается легче, чем поддержание постоянного состава в любой из фаз. Поэтому экспериментальный материал по адсорбции обычно получают в виде изотерм. Они часто является первичным объектом теоретического анализа. На рисунке 5.1 приведены типичные изотермы адсорбции. Из рисунка видно, что величина адсорбции (Х) возрастает по мере увеличения концентрации (С) (парциального давления, Р) адсорбата и убывает с ростом температуры (Т) [21] .
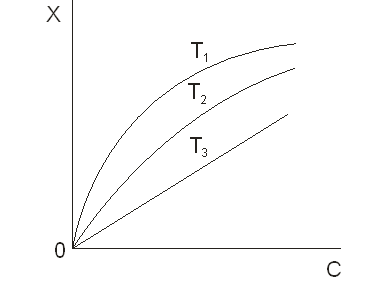
Рисунок 5.1 — Изотермы адсорбции при условии T1 <T2 <T3
Теоретическая интерпретация изотерм, приведенных на рисунке 5.1, для адсорбции на плоской поверхности адсорбента впервые была выполнена американским физиком Ленгмюром и по его имени изотермы такого типа, которые показаны на рисунке, стали называть ленгмюровскими. Уравнение Ленгмюра записывается так [21]:
X = XmbC/(1 + bC),
где Xm — предельная величина адсорбции;
b — коэффициент, имеющий смысл константы равновесия.
6. Активация минеральных сорбентов
С точки зрения экологии природные сорбенты рассматриваются не только как очень доступные и дешевые материалы, способные эффективно связывать и нейтрализовать различные загрязнители, но и как экологически чистое, не загрязняемое окружающую среду сырье [22].
Важным свойством пород является возможность улучшения их качества путем применения различных методов активации и модифицирования. Это дает возможность создавать новые материалы с заданными физико-химическими и технологическими свойствами применительно к решению конкретных задач.
Активация и модифицирование неорганических природных сорбентов проводится с целью направленного изменения их свойств. Существует ряд эффективных методов химического и физического модифицирования поверхности и регулирования пористости сорбентов.
Физические способы активации сорбентов сводятся к обработке образцов в мельницах, воздействию вакуума (вакуумная сушка), высокого давления и температуры (гидротермальная обработка), ультразвуковых колебаний, радиации и тока высокой частоты. Химические способы активации сорбентов заключаются в воздействии на образцы химических реагентов. В зависимости от химического реагента различают кислотную, щелочную, солевую и комбинированную активацию. В качестве реагентов используются [22]:
- Минеральные кислоты — серная, соляная, фосфорная.
- Органические кислоты — щавелевая, уксусная.
- Щелочи — едкий натрий, едкий калий, углекислый натрий, гидрат окиси кальция и другие.
- Легко растворимые в воде соли. В этом случае, как правило, происходит обменная реакция между катионами растворимой в воде соли и катионами, входящими в состав поглощающего комплекса природного сорбента, в результате чего образуются монокатионзамещенные формы сорбента.
- Трудно растворимые в воде соли, например углекислый кальций. В данном случае после обработки образец прокаливают при заданной температуре.
- Органические вещества — амины, амиды. При этом получают специфические формы органофильных сорбентов.
- Водорастворимые полимерные вещества.
Известные эффективные методы химического и физического модифицирования поверхности природных минеральных сорбентов проводят с целью регулирования их адсорбционной и катионообменной способности. Однако многие из этих методов зачастую приводят к получению противоречивых и несопоставимых результатов.
Поэтому в данной работе были экспериментально использованы традиционные методы химической активации неорганических природных минеральных сорбентов (глауконита), — кислотный и щелочной в режиме кипения и в режиме пропитки.
Обработка природных сорбентов минеральными кислотами — один из важнейших способов получения высококачественных активированных адсорбентов, применяемых в различных отраслях народного хозяйства [22].
Согласно существующим представлениям, при декатионировании глинистых минералов, которое начинается с получения водородной формы, происходит разрыв связи Si–O–Al в смежных тетраэдрах, в результате чего образуются группы ОН, связанные с атомом кремния, и трехкоординированные атомы алюминия, а также бренстедовский центр[22]. Схема кислотной активации представлена на рисунке 6.1.
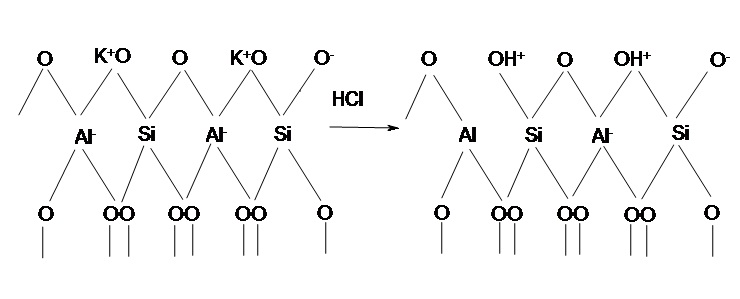
Рисунок 6.1 — Схема кислотной активации глауконита
На поверхности ультрамикрочастиц находятся силанольные группы в виде частично катионной и протонированной формы. Итак, механизм кислотной активации можно представлен на рисунке 6.2
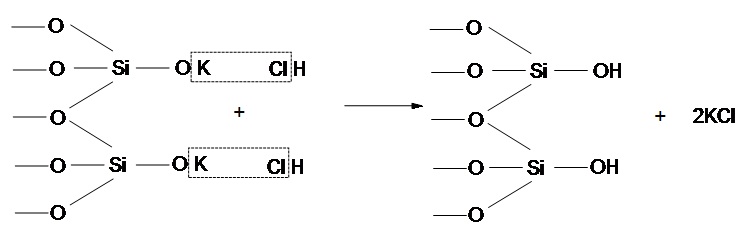
Рисунок 6.2 — Механизм кислотной активации
При активации кремнистых соединений щелочью задействованы силанольные группы, находящиеся в водородной форме, и место водородного протона занимает ион Na+. Механизм щелочной активации предстален на рисунке 6.3.
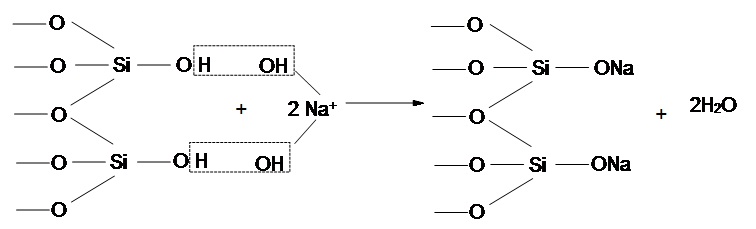
Рисунок 6.3 — Механизм щелочной активации
7. Методика эксперимента
Активация в режиме кипения проведена по следующей методике:
- опытный образец очищали от посторонних включений (механических примесей), образец измельчали до однородного фракционного состава;
- добавляли соляную кислоту и раствор гидроксида натрия в объемном соотношении 1:10 (твердая фаза : раствор), тщательно перемешивали;
- активацию проводили в течении 1 ч (30 мин), для части образцов проводили промывку дистиллированной водой в объемном соотношении 1:5 (суспензия : дистиллят);
Активация методом пропитки проводиться согласно [23].
Активированные сорбенты высушивались в нормальных условиях
7.1 Сорбционная способность активированного глауконита относительно иона аммония
Определение содержания ионов аммония в воде проводили колориметрическим методом [24], основанным на реакции взаимодействия ионов NH4+ с щелочным раствором иодомеркуриата калия K2[HgI2], так называемым реактивом Неслера. В результате этого взаимодействия образуется иодистый меркурамоний. Схема реакции изображена на рисунке 7.1
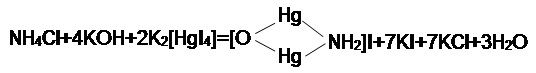
Рисунок 7.1 — Схема реакци
Определение проводили в присутствии двойной калиево-натриевой соли винной кислоты для предотвращения побочных реакций между ионами Са2+ и Мg2+, присутствующими в воде, с ионами ОН-, вносимые реактивом Неслера. Оптическую плотность полученных растворов определяли с помощью фотоколориметрического метода (при длине волны — 440 нм, толщина кюветы — 30 мм). Выходной модельной раствор NH4Cl с концентрацией ионов NH4+ 0,1 г/дм3.
Определение проводят методом сравнения: находятся оптические плотности стандартного раствора с известной концентрацией ионов аммония и исследуемого раствора с неизвестной концентрацией ионов NH4+.
Время контакта адсорбента с модельным раствором — 20 минут, масса навески сорбента — 0,5 г.
Таблица 7.1 — Влияние параметров химической активации на сорбционную способность глауконита Амвросиевского месторождения
| № образца | Ведомости про способ активации | Исходная концентрация, NH4+, мг / дм3 | Остаточная концентрация, NH4+, мг / дм3 | Степень очистки, % |
| Образец 1 | не поддавался активации | 0,1 | 0,0152 | 84,84 |
| Образец 2 | 0,1 Н NaOH пропитка / активация 30 мин. / промытый | 0,1 | 0,0130 | 87,02 |
| Образец 3 | 0,1 Н NaOH пропитка / активация 30 мин. / не промытый | 0,1 | 0,0150 | 85,02 |
| Образец 4 | 0,1 Н NaOH пропитка / активация 60 мин. / промытый | 0,1 | 0,0130 | 87,05 |
| Образец 5 | 0,1 Н NaOH пропитка / активация 60 мин. / не промытый | 0,1 | 0,0111 | 88,88 |
| Образец 6 | 0,1 Н NaOH кипение / активация 60 мин. / промытый | 0,1 | 0,0082 | 91,84 |
| Образец 7 | 0,1 Н NaOH кипение / активация 60 мин. / не промытый | 0,1 | 0,0046 | 95,44 |
| Образец 8 | HClконц пропитка / активация 60 мин. / промытый | 0,1 | 0,0020 | 98,02 |
| Образец 9 | HClконц кипение / активация 60 мин. / промытый | 0,1 | 0,0019 | 98,11 |
| Образец 10 | HClконц кипение / активация 30 мин. / промытый | 0,1 | 0,0020 | 98,02 |
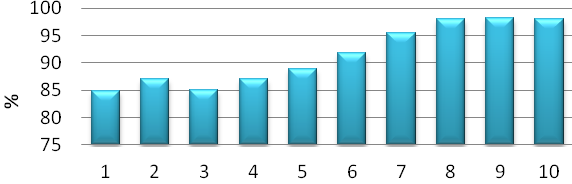
1 — глауконит природный, 2 — глауконит активированный 0,1 Н NaOH (пропитка — 30 мин., промытый), 3 — глауконит активированный 0,1 Н NaOH (пропитка — 30 мин., не промытый), 4 — глауконит активированный 0,1 Н NaOH (пропитка — 60 мин., промытый), 5 — глауконит активированный 0,1 Н NaOH (пропитка — 60 мин., не промытый), 6 — глауконит активированный 0,1 Н NaOH (кипение — 60 мин., промытый), 7 — глауконит активированный 0,1 Н NaOH (кипение — 60 мин., не промытый), 8 — глауконит активированный HClконц (пропитка —60 мин., промытый), 9 — глауконит активированный HClконц (кипение — 60 мин., промытый), 10 — глауконит автивованний HClконц (кипение — 30 мин., не промытый)
Рисунок 7.2 — Гистограмма степени очистки от ионов аммония
Стоит отметить, что все химически модифицированные образцы проявили увеличение адсорбционной способности к ионам аммония, относительно не активированного глауконита того же месторождения.
Результаты модификации природного сорбента глауконита свидетельствуют о том, что модификация глауконита двумя наиболее распространенными средствами — щелочная и кислотная активация по разным способами проведения приводит к изменению адсорбционной способности ионов аммония, анализ показал, что лучшими адсорбционными свойствами в отношении ионов аммония обладает химически модифицированный образец, который активирован с помощью концентрированной соляной кислоты, подвергался кипению со временем активации 60 мин. и промывался (образец № 9) относительно не активированного глауконита степень очистки выросла на 13,3%. Среди образцов, подвергавшихся щелочной активации лучшую сорбционную способность показал образец активирован с помощью 0,1 Н NaOH, подвергавшегося кипению со временем активации 60 мин., не промытым. Степень очистки при сопоставлении с не активированный глауконитом вырос на 10,6%.
Таблица 7.2 — Экспериментальные данные определения сорбции NH4+ образца № 8
| Маса навески глауконита, г | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Время контакта адсорбента с раствором, мин | 10 | 10 | 10 | 10 | 10 | 10 |
| Исходная концентрация NH4+, C1, мг/л | 1 | 2 | 5 | 10 | 20 | 30 |
| Остаточная концентрация NH4+, C2, мг/л | 0,2959 | 0,6939 | 0,9847 | 1,5969 | 2,3010 | 2,8214 |
| Адсорбционная емкость сорбента Г, мг / г | 0,14 | 0,26 | 0,80 | 1,68 | 3,54 | 5,43 |
| Lg Г | – 0,53 | – 0,16 | – 0,01 | 0,20 | 0,36 | 0,45 |
| Lg Сзал | – 0,85 | – 0,58 | – 0,01 | 0,23 | 0,55 | 0,74 |
Можно предположить, что даже если при выдержке минерала при низких pH происходит выход некоторого количества катионов из алюмосиликатного слоя, сорбированнные катионы NH4+ способны замещать их, при этом устанавливаются более прочные связи между слоями.
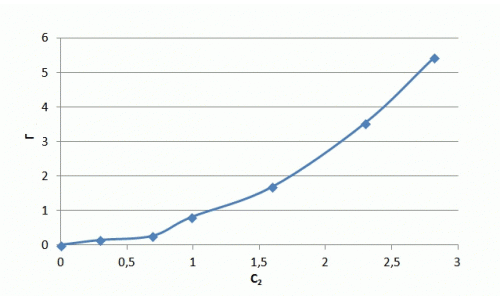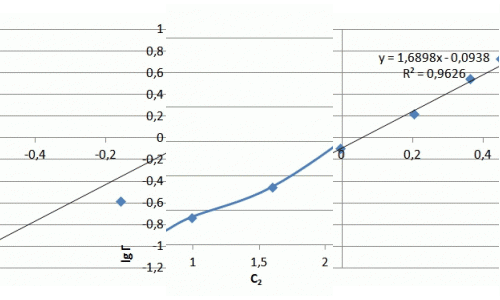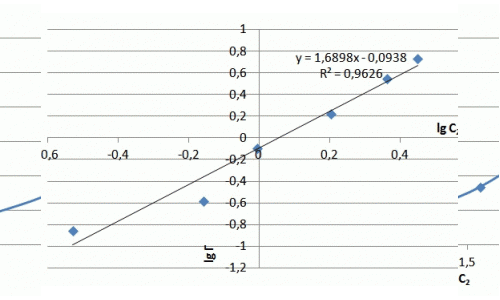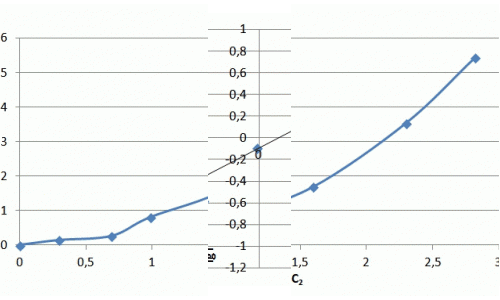
Рисунок 7.3 — Изотерма адсорбции ионов аммиака в натуральных координатах и в логорифмических координатах
(12 кадров, 7 циклов продолжительностью по 6 секунд, 207 Кб)
Ход изотермы на начальном участке соответствует изотерме Ленгмюра, однако насыщения образца не происходит и изотерма сорбции принимает линейный характер. Значения сорбции значительно превосходят показатели насыщения для катионов металлов и составляют, в данном случае максимальное значение — 5 мг/г. В литературе отмечается избирательная способность слоистых силикатов к катионам крупных размеров, что можно объяснить ситовым эффектом.
Таблица 7.3 — Экспериментальные данные определения сорбции NH4+ образца № 8, № 9, № 10
| Номер образца | Масса навески, г | Время контакта адсорбента и раствора, мин | Исходная концентрация, NH4+, мг / дм3 | Остаточная концентрация NH4+, мг / дм3 | Степень очистки, % |
| Образец № 8 | 0,5 | 30 | 100 | 6,21 | 93,7 |
| Образец № 9 | 0,5 | 30 | 100 | 5,09 | 94,9 |
| Образец № 10 | 0,5 | 30 | 100 | 5,57 | 94,4 |
Из полученных результатов следует, что сорбция аммония происходит не только на поверхности глауконита, но и в его поровых пространствах, где расположены менее доступные обменные центры, из-за чего повышается степень очистки растворов от NH4+. Уравнение Фрейндлиха имеет вид: Г = 0,74·С0,53. Полученный коэффициент α = 0,74 свидетельствует о высоких сорбционных свойства.
7.2 Сорбционная способность активированного глауконита относительно фенола
Определение концентрации фенола в растворе [25]: остаточную концентрацию фенола определяли бромид-броматним методом, который заключается в бромировании фенола с последующим определением избыточного брома.
5КВr + КВrО3 + 3Н2SO4 = ЗВr2 +2К2SO4 + ЗН2O.
Избыточный бром, который не пошел на бромированиe, определяли йодометрическим методом.
Время контакта адсорбента с модельным раствором — 20 минут, масса навески сорбента — 1г.
Таблица 7.4 — Результаты эксперимента по активации
| № образца | Сорбент | Сведения о способе активации | Исходная концентрация, ммоль/дм3 | Остаточная концентрация, ммоль/дм3 | Степень очистки, % |
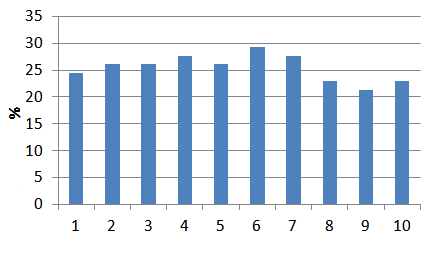
| Образец 1 | Глауконит | не поддавался активации | 1,06 | 0,80 | 24,53 |
| Образец 2 | Глауконит | 0,1 Н NaOH пропитка / активация 30 мин. / промытый | 1,06 | 0,78 | 26,10 |
| Образец 3 | Глауконит | 0,1 Н NaOH пропитка / активация 30 мин. / не промытый | 1,06 | 0,78 | 26,10 |
| Образец 4 | Глауконит | 0,1 Н NaOH пропитка / активация 60 мин. / промытый | 1,06 | 0,77 | 27,67 |
| Образец 5 | Глауконит | 0,1 Н NaOH пропитка / активация 60 мин. / не промытый | 1,06 | 0,78 | 26,10 |
| Образец 6 | Глауконит | 0,1 Н NaOH кипение / активация 60 мин. / промытый | 1,06 | 0,75 | 29,25 |
| Образец 7 | Глауконит | 0,1 Н NaOH кипение / активация 60 мин. / не промытый | 1,06 | 0,77 | 27,67 |
| Образец 8 | Глауконит | HClконц пропитка / активация 60 мин. / промытый | 1,06 | 0,82 | 22,96 |
| Образец 9 | Глауконит | HClконц кипение / активация 60 мин. / промытый | 1,06 | 0,83 | 21,38 |
| Образец 10 | Глауконит | HClконц кипение / активация 30 мин. / промытый | 1,06 | 0,82 | 22,96 |
Попытка увеличить сорбцийную способность глауконита с помощью химической активации показала лучший результат для образца № 4 — активация 0,1 Н NaOH, кипине в течение 60 мин. промытого, позволила значительно (на 4,72%) снизить остаточную концентрацию фенола в воде, однако химическая активация соляной кислотой достаточно серьезно повлияла на сорбционную способность минерала — сорбция фенола, по отношению к которому глауконит не обладает выборочной сорбционной активностью, снизилась на 3, 15 и 1,57%.
1 — глауконит природный, 2 — глауконит активированный 0,1 Н NaOH (пропитка — 30 мин., промытый), 3 — глауконит активированный 0,1 Н NaOH (пропитка — 30 мин., не промытый), 4 — глауконит активированный 0,1 Н NaOH (пропитка — 60 мин., промытый), 5 — глауконит активированный 0,1 Н NaOH (пропитка — 60 мин., не промытый), 6 — глауконит активированный 0,1 Н NaOH (кипение — 60 мин., промытый), 7 — глауконит активированный 0,1 Н NaOH (кипение — 60 мин., не промытый), 8 — глауконит активированный HClконц (пропитка —60 мин., промытый), 9 — глауконит активированный HClконц (кипение — 60 мин., промытый), 10 — глауконит автивованний HClконц (кипение — 30 мин., не промытый)
Рисунок 7.4 — Гистограмма степени очистки от фенола
Не эффективность кислотной активации можно объяснить тем, что глауконит в значительной степени неустойчив в кислых и даже слабокислых средах, это сопровождается вымыванием некоторых катионов из структуры и диспергированием минерала [26].
Таблица 7.5 — Экспериментальные данные определения сорбции фенола образцу № 4
| Исходная концентрация фенола Свих, ммоль/дм3 | 1,06 | 2,12 | 4,25 | 6,38 | 8,51 | 10,63 |
| Остаточная концентрация фенола Сзал, ммоль/дм3 | 0,97 | 1,83 | 3,73 | 5,53 | 7,50 | 9,50 |
| Адсорбционная емкость сорбента Г, ммоль/г | 0,04 | 0,12 | 0,21 | 0,34 | 0,4 | 0,45 |
| Объем фильтрата, см3 | 100 | 50 | 25 | 25 | 10 | 10 |
| Lg Г | – 0,01 | 0,26 | 0,57 | 0,74 | 0,88 | 0,98> |
| Lg Сзал | – 1,43 | – 0,93 | – 0,68 | – 0,47 | – 0,39 | – 0,34 |
Уравнение Фрейндлиха для фенола имеет вид: Г = 0,097·С1,11. Полученная изотерма адсорбции свидетельствует о наличии макропор и микропор и о сильном межмолекулярном взаимодействии. Полученный коэффициент α = 0,097 свидетельствует о низких сорбционных свойствах.
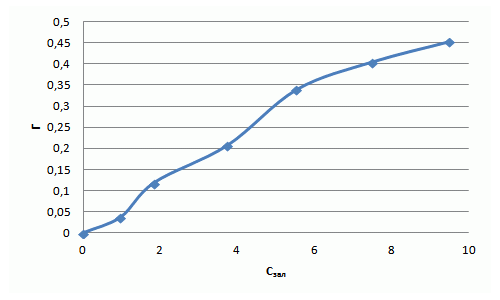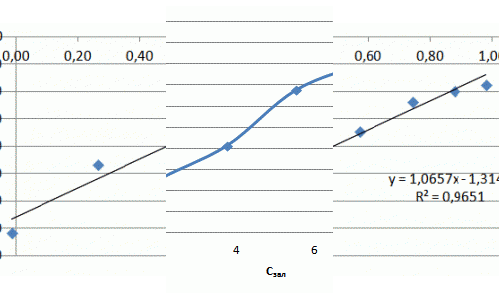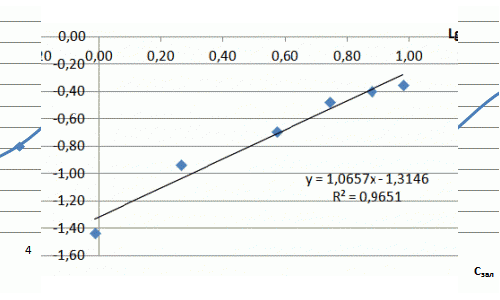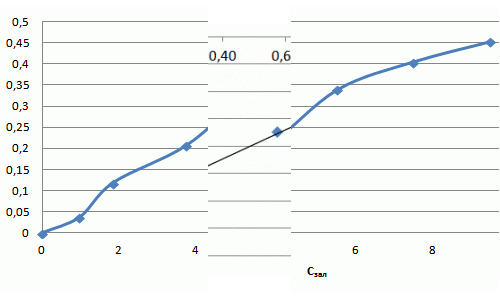
Рисунок 7.5 — Изотерма адсорбции фенола в натуральных координатах и в логорифмичних координатах
(12 кадров, 7 циклов продолжительностью по 6 секунд, 114 Кб)
Выводы
По результатам выполненной работы сделаны следующие выводы:
1 — рассмотрены образования фильтрата на полигонах ТБО, описан способ сорбционной очистки как наиболее оптимальный;
2 — доказана перспективность и эффективность использования активированных природных сорбентов, в частности активированного глауконита, для очистки фильтрата полигонов ТБО. Его преимуществами являются: доступность, возможность многоразового использования без регенерации.
В дальнейшем планируется изучить сорбционную активность модифицированного глауконита по отношению к тяжелым металлам и красителям.
Список источников
- Величко Н.В. Оценка состояния почвогрунтов в зоне влияния ларинского полигона промышленно-строительных отходов / Н.В. Величко, О.О. Гладкова, Ю.А. Проскурня// Актуальні проблеми геології. Збірник матеріалів Міжвузівської наукової конференції студентів геологічних, екологічних і гірничих спеціальностей 26 квітня 2013 року. — Донецьк: ДонНТУ, 2013. — С. 23–26
- Андоленко С.С. Нормативно-правовое регулирование сферы обращения с отходами в Украине /С.С. Андоленко, И.Н. Ющенко, О.Н. Андрейчук// Наукові праці Донецького національного технічного університету. Серія: Гірничо-геологічна. — Донецьк :ДонНТУ, 2010. —Вип.№12 (173). — С. 184–192
- Солодовник М.В. Особенности очистки сточных вод полигонов твердых бытовых отходов / М.В.Солодовник //Программа и тезисы докладов. Часть I. Строительство, архитектура, экология — Х.: ХНАГХ, 2008. — С. 221–223
- Краснянский, М.Е. Исследование влияния свалок ТБО г. Донецка и г. Макеевки на природную среду/ М.Е. Краснянский, А. Бельгасем // Экология и науч.-техн. прогресс: Матер. 3 междунар. науч.-практ. конф. студ., аспирантов и мол. ученых / — Пермь: Перм. ГТУ, 2005. — С. 247–255.
- Сатин И. В. Сравнительный анализ методов очистки фильтрата / И. В. Сатин, А. С. Трякина// Донбасская национальная академия строительства и архитектуры Сер. Технологія, організація, механізація та геодезичне забезпечення будівництва. Міське будівництво і господарство, 2010. — Вип 3(83). —С. 270–275
- Вилсон Д. Утилизация твердых отходов. Т. 1: Пер. с англ. — М.: Стройиздат, 1985. — 336 с.
- Гриценко А.В. Технологические основы промышленной переработки отходов мегаполиса/ А.В. Гриценко, Н.П. Горох. — Х.: ХНАДУ, 2005. —340 с.
- Щербина Г.П Исследование фильтрационных стоков полигона ТБО для установления возможности утилизации его с использованием фермента класса оксигедаз / Г.П. Щербина// Інформаційно-аналітичний збірник «Санітарна очистка міст та комунальний автотранспорт» К.: Концерн ;Видавничий Дім ;Ін Юре” , 2002. — Вип. 4 . — С. 51–56
- Солодовник М.В. Реагентный метод очистки сточных вод полигоновтвердых бытовых отходов / М.В. Солодовник // Материалы III Международной научно-практической конференции «Вода, экология,общество». — Х.: ХНАГХ, 2010. — С. 176–177
- Литвин Т. С. Визначення сорбційних властивостей глауконіту / Охорона навколишнього середовища та раціональне використання природних ресурсів — 2012 / Т. С. Литвин, Я. М. Зуб, О.А. Трошина Матерiали ХХII Всеукраїнської наукової конференцiї аспiрантiв і студентів. — Донецьк, ДонНТУ, 2012. —Том 1, — С.104–105
- Стеценко, Н. О. Дослідження адсорбції барвних речовин цукрового виробництва природними дисперсними мінералами України / Н. О. Стеценко, О. В. Подобій, О. М. Мірошников, О. В.Грабовська // Магістеріум. Хімічні науки, 2010. — Випуск 40. — С. 37–40.
- Лыгин В.И. Адсорбция из растворов на поверхностях твердых тел /В.И. Лыгин. — М.: Мир, 1986. — 488 с.
- Орлов Л. О. Ефективність використання антиадгезійного покриття форм для виробництва м’ясних хлібів / Л. О. Орлов, В. Л. Яровий, М. Г. Янковий // Матеріали V всеукраїнської науково-практичної конференції «Теорія і практика сучасного природознавства». Секція «Хімічні та біохімічні науки і технології», 24–25 листопала 2011 р, — С 61–64
- Корнілович Б. Еколого-хімічні проблеми видобутку та перероблення уранової сировини / Б. Корнілович, В. Стрелко, Ю. Кошик, В. Павленко //Вісн. НАН України. — 2010. — № 10. — С. 8–14
- Петрушка, І. М. Очищення стічних вод від двокомпонентних органічних забрудників методом рідинної хроматографії. / І. М.Петрушка, О. В.Стокалюк, М. С.Мальований, Я. М.Захарко // Хімія, технологія речовин та їх застосування: [збірник наукових праць]/ — Л.: Видавництво Національного університету «Львівська політехніка», 2007. — С. 250–255
- Доскач Т. М. Дослідження адсорбційної здатності сумішей на основі мінеральних сорбентів / Т. М. Доскач, М. С. Мальований, З. С. Одноріг, А. О. Мараховська, О. М. Піх //Хімія, технологія речовин та їх застосування: [збірник наукових праць] — Львів: Видавництво Національного університету "Львівська політехніка", 2011. — С.266–269.
- Мальований М. Очищення питної води від іонів амонію адсорбцію на природних сорбентах / М. Мальований, Г. Сакалова, А. Мараховська, Н. Чорномаз. // Захист навколишнього середовища. Енергоощадність. Збалансоване природокористування : збірник матеріалів I міжнародного конгресу, Львів, 28–29 червня 2009 р. —Л.: Видавництво Національного університету "Львівська політехніка" 2009, — C. 55
- Василінич Т. М. Очищення стічних вод шкіряного виробництва від іонів хрому / Т. М. Василінич // Вісник Хмельницького національного університу. Серія: Технічні науки — № 1. — С. 228–231.
- Воюцкий С. С. Курс коллоидной химии / С. С. Воюцкий. — М.: Химия,1976. — 512 с.
- Фридрихсберг Д. А. Курс коллоидной химии / Д. А. Фридрихсберг. — Л.: Химия, 1995. — 400 с
- Шумяцкий, Ю.И. Адсорбционные процессы. Учебное пособие / Ю.И. Шумяцкий. — М.: РХТУ им. Д.И.Менделеева, 2005. —164 с.
- Лыгина Т.З. Технологии химической активации неорганических природных минеральных сорбентов: монография/ Т.З.Лыгина, О.А. Михайлова, А.И. Хацринов, Т.П. Конюхова, Казань: Изд-во Казан. гос. технол. ун-та, 2009. —120 с.
- Бовсуновський Є.О. Вплив параметрів кислотної активації суглинку темно-бурого на його сорбційні властивості щодо іонів хрому (ІІІ)/ Є.О. Бовсуновський, О.В. Рябчевський, Ю.Я. Годовська, О.Г. Личманенко// Вісник НАУ. — Х:НАУ —2012. № 4 — С. 123–125
- Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Метод определения ионов аммония : ГОСТ 23268. 10–78 [действующий от 01.01.74 ]. — М. : ИПК Издательство стандартов, 2010. — 6 с. — (Межгосударственный стандарт).
- Вигдорович В.И. Извлечение фенола из водных растворов глауконитом / В.И. Вигдорович, Л.Е. Цыганкова, Д.В. Николенко, А.И. Акулов //Сорбционные и хроматографические процессы. — 2010. — Т. 10. —№ 4. — С. 505–511
- Ю.И. Особенности структуры и сорбционно-обменные свойства глауконита Багарякского месторождени / Ю.И. Сухарев, А.Е. Черногорова, Е.А. Кувыкинаи//Известия Челябинского Научного Центра. Серия химия и химическая технология —Челябинск, 1999. —№4. —С. 64–69
