Реферат
Реакционная способность ароматических и алифатических сложных эфиров в присутствии метилированого реагентов в онлайн термохимолизе изучали с помощью модельных соединений. Пальмитаты были синтезированы, представляющие сложноэфирные ароматические и алифатические связи. Эти соединений были проанализированы с использованием онлайн термохимолиза в присутствии тетраметиламмония ацетат (TMAAc) и гидроксид тетраметиламмония (ТМАН), чтобы можно было отличать от свободных кислот и этерифицированных кислот. Освобожденные пальмитиновые кислоты с ТМАН для обеих соединений были близки к теоретическому содержанию пальмитиновой кислоты модельных соединений, даже если часть алифатического эфира не реагирует с ТМАН. Содержание свободной пальмитиновой кислоты с TMAAc, была одной третью от теоретического значения для ароматических эфиров, и только несколько процентов для алифатического эфира. Результат показал, что чем меньше основной реагент способен гидролизовать сложноэфирную ароматическую связь в некоторой степени, тогда алифатический эфир остается неизменным. Таким образом, дифференциация свободных кислот TMAAc из этерифицированных кислот не может быть надежно выполнена из матриц, содержащих сложные ароматические эфиры. Было обнаружено, что переэтерификации в связи с использованием метанола в качестве растворителя с TMAAc, является незначительная реакция онлайн термохимолиза.
Ключевые слова: Термохимолиз, тетраметиламмонийгидрохлорид, тетраметиламмоний ацетат, эфирная связь, свободные кислоты.
1. Введение
Способ онлайн дериватизации в присутствии реагента гидроксида тетраметиламмония (TMAH) было разработано Чалланером [1]. Метод, называемый также термохимолиз, широко используется для характеристики различных природных материалов и синтетических полимеров рассматривает Чалланер [2] и Шадками [3]. ТМАН является сильным основанием, которое расщепляет сложные и простые эфирные связи, образуя более летучий метиловый эфир и эфирные производные [4]. ТМАН реагирует также со свободными кислотами, присутствующих в образце. Таким образом, он может быть использован для определения общего содержания жирных кислот в образце [5–7]. Другой реагент термохимолиза, тетраметиламмония ацетат (TMAA), является более селективным. Он реагирует только со свободной кислотой и ОН группами. Он был использован вместе с ТМАН для различия свободных и этерифицированных жирных кислот в древесных экстрагируемых веществ [6]. Тетраэтиламмония ацетат (TEAAc) является еще одним реагентом, который также был применен, чтобы дать информацию о свободных кислот, присутствующих в образце. Преимущество TEAAc, в том, что он может быть использован для обнаружения метиловых эфиров первоначально присутствующих в образцах отдельно от свободных кислот [8] TMAAc и TEAAc главным образом использовались с основными реагентами термохимолиза, такие как ТМАН и гидроксида тетрабутиламмония (TBAH) для анализ липидов из природных материалов, включая гуминовые и гуминовые вещества [9, 10], а также ранее упомянутых древесных экстрактов [6, 11]. Кроме того, водное природное органическое вещество, которое содержит в основном фенольные структуры, было изучено различными реагентами термохимолиза [12]. В этом исследовании реакции метилирования с TMAAc (в метаноле), происходила частичная переэтерификация. В дополнение к свободным функциональным группам, часть эфирных связей, присутствующих в природном органическом веществе должена была реагировать с метоксид-иона с образованием метиловых эфиров. Было предложено ионный метоксид вывести из метанола, с использование TMAAc растворителя.
Измеренная содержание свободной кислоты, таким образом, была выше, чем фактическое содержание кислоты в образце. Измерение осуществляется с помощью оффлайн термохимолиза. Ожидалось, что переэтерификации не происходит в режиме онлайн термохимолиза. Триглицериды были проанализированы также TMAAc и другими основными реагентами [7]. Довольно высокая доля кислот обнаружена в свободной форме. Таким образом, был сделан вывод о том, что часть сложноэфирной связи может быть расщеплена при высокой температуре термохимолиза TMAAc. Хотя TMAAc и TEAAc используются для определения свободной кислоты в различных типов природных полимеров, содержащих сложноэфирных связей и ароматических и алифатических, TMAAc и TEAAc по-разному реагируют с двумя типами эфиров. Перед использованием реагентов с различной щелочностю были синтезированы два соединения, пальмитат и 2-нонил пальмитат. Также проанализированы модифицированные биополимеры, содержащие как алифатические и ароматические сложноэфирные связи. Эти модельные соединения были проанализированы с использованием ТМАН и TMAAc, чтобы понять поведение реагентов в анализе эфирных связей и свободных кислот. Утверждалось, что переэтерификации, вероятно, не состоит в онлайн термохимолизе, это было изучено в настоящем исследовании.
2. Материал и методы
2.1. Общий порядок модельного соединения
Все материалы, используемые для синтеза были коммерческой тайной. 1H и 13C ЯМР-спектры регистрировали на 500 МГц ЯМР-спектрометре Bruker Avance III, их химические сдвиги были откалиброваны в дейтерированном растворителе. Пальмитат: пальмитиновой кислоты (7,43 г, 29,0 ммоль), гликоль (3,42 г, 27,6 ммоль) и 4-диметиламинопиридин (0,67 г, 5,52 ммоль) растворяли в дихлорметане (100 мл) и охлаждли до 0 °С с последующим добавлением из дициклогексанакарбомида (6,83 г, 33,1 ммоль) порциями в растворе дихлорметана. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи и затем фильтровали для удаления твердых веществ. Фильтрат выпаривают и неочищенный продукт очищают флэш-хроматографией с гептаном увеличением полярности до EtOAc: гептан 5:95 с получением продукта в виде белого твердого вещества. Выход был 8,32 г (83 %), 2-нонил-пальмитат: пальмитиновая кислота (7,04 г, 27,4 ммоль), 2-нонанол (3,77 г, 26,1 ммоль) и 4-диметиламинопиридин (0,64 г, 5,23 ммоль) растворяли в дихлорметане (100 мл) и охлаждают до 0 °С. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи и затем фильтровали для удаления твердых веществ. Фильтрат выпаривают и неочищенный продукт очищают флэш-хроматографией с гептаном увеличением пол рности до EtOAc: гептан 2:98 с получением продукта в виде прозрачного масла. Выход 7,17 г (71,7 %). Выход продукта был 7,17 г (72 %).
2.2. Термохимолиз
Термохимолиз с ТМАН (10 % в водном растворе) и TMAAc (15 % в водном растворе) проводили с использованием платиновой фольги импульса пиролизера (Pyrolab, Швеция), соединенный с газовым хроматографом масс-спектрометра (Varian 3800 GC – Вариан Сатурн 2000 MS). Капиллярная колонка (J&W, DB-1701, толщина пленки 1 мкм) плавленый кварц был использован для разделения соединения. От 2 до 4 образцов разбавляют до метанола или дихлорметана при концентрации примерно 0,5 мг/мл. Смесь помещена в пиролизер, при этом поддерживается температура около 175 °С. Нить нагревают до температуры от 280 до 600 °С, в зависимости от используемого реагента. Время пиролиза составило 2 секунды. После пиролиза, продукты разложения ввели в капиллярную колонку для разделения с использованием гелия в качестве газа-носителя при расходе 1,0 мл/мин−1. Температура колонки была запрограммирована от 80 °C (2 мин) до 160 °С со скоростью 8 °С мин−1 и росла от 160 °С до 280 °С со скоростью 5 °С мин−1. Масс-спектрометр работает в режиме EI (70 эВ) с помощью масс-спектров. Кислотность была рассчитана с использованием стандартной внутренней калибровки.
3. Результаты и обсуждение
3.1. Условия термохимолиза
Два исследуемых соединений были синтезированы – пальмитат и 2-нонил пальмитат, который содержат сложноэфирные, ароматические и алифатические связи (рис. 1).
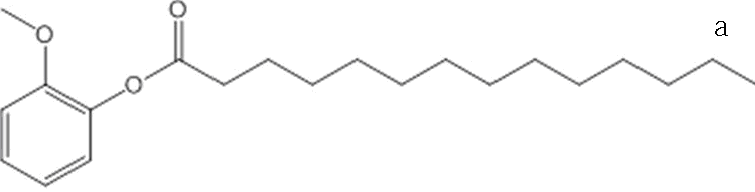
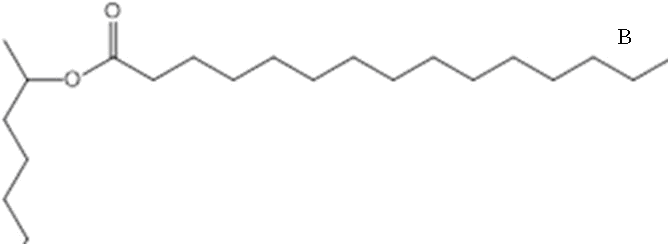
Рисунок 1 – Структурные модели (а) – пальмитат, (б) – 2-нонил пальмитат)
Эти соединения были проанализированы с использованием онлайн термохимолиза с двумя реагентами метилирования ТМАН и TMAAc. Онлайн термохимолиз проводили в блоке пиролиза. Таким образом, время реакции составило 2 секунды. Оба метилирующие реагенты были использованы в виде водных растворов. На основании литературы, термохимолиз при температуре 600 °С дал высокое восстановление для жирных кислот [7]. Проведении опыта при температуре 400 °C и 600 °C дал в основном один и тот же выход жирной кислоты. Однако при высоких температурах, таких как 600 °С, лучший выход составил для ароматических соединений. Таким образом, термохимолиз TMAH проводили при 600 °С, когда температура ниже был использовано термохимолиз TMAAc, что позволяет избежать термическое разложения сложноэфирной связи. Обе модели соединения, а в качестве внутреннего стандарта разводили до метанола и дихлорметана. Причина использовать два растворителя с различной структурой это возможность понять, как будет влиять растворителей на реакцию метилирования т.е. переэтерификации. Если переэтерификация сложноэфирных групп в образце проходить через образование ионов метоксида, то высокая доля метилированных продуктов будет сформирована, когда используют метанол в качестве растворителя. Было предложено, чтобы переэтерификации не происходила можно использавать дихлорметан в качестве растворителя. Растворы готовили для того, чтобы иметь возможность передавать соответствующее количество образца на нити и избежать перегрузки детектора. В TMAAc термохимолизе, реагент смешивают с образцом, двумя различными способами: до или после добавления образца на нить. Концентрация TMAAc в смеси составляет 3 %. Там не было никакого различия в результатах в зависимости от того, как реагент смешивают с образцом. Таким образом, результаты представлены в виде среднего. ТМАН всегда добавляют после добавления образца непосредственно на нить. Все измерения были сделаны, по крайней мере, трижды. Содержание пальмитиновой кислоты было рассчитано для модельных соединений с использованием стандартной внутренний калибровки.
3.2. Термохимолиз ТМАН и TMAAc
Ожидаемые реакции, происходящие в термохимолизе TMAH (рис. 2). Ожидалось, что TMAAc не реагирует с эфирными связями. В присутствии ТМАН, гидролизуют пальмитат и пальмитиновые кислоты, метиловый эфир и диметоксибензол были сформированы как продукты метилирования.
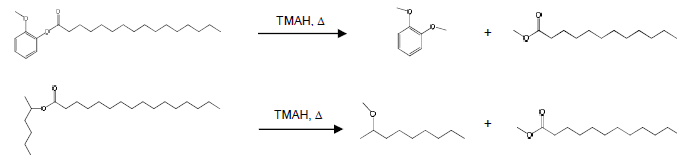
Рисунок 2 – Ожидаемые продукты, образованные термохимолиза TMAH пальмитата и 2-нонил пальмитат
Проанализированы на хроматографе, в результате чего сделаны хроматограммы продуктов (рис. 3), (рис. 4). Интенсивности пиков диметоксибензола и метилового эфира пальмитиновой кислоты были удивительно высокими по сравнению с внутренним стандартом интенсивности, когда TMAAc не допускается для гидролиза сложных эфиров [6]. Результат показывает, что часть ароматического эфира подвергали гидролизу в термохимолизе по TMAAc. Пальмитиновая кислота не была обнаружена, вероятно, потому что вымывание жирных кислот без дериватизацией оставляет желать лучшего. Метил пальмитат был единственным метилированным продуктом из 2-нонил пальмитата в присутствии ТМАН. Небольшой пик 2-нонанола был обнаружен, но не 2-нонил-метиловый эфир (рис. 3).
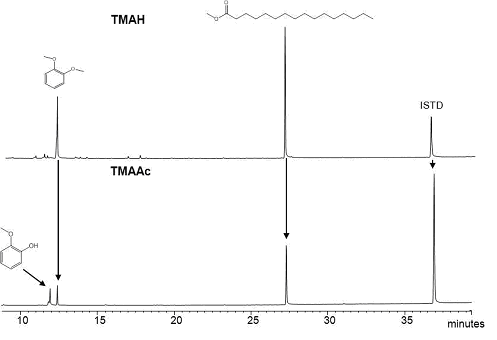
Рисунок 3 – Продукты, полученные из пальмитат термохимолиом TMAH и термохимолизом TMAAc
Ранее было сообщено, что все группы спирта не полностью метилированный [1]. Также было найдено небольшое количество исходного эфира 2-нонил пальмитата, что указывает на неполное протекание реакции алифатических эфиров в присутствии ТМАН. Как и ожидалось, 2-нонил пальмитат с TMAAc, был найден небольшой пик метил пальмитата, что указывает на свободную кислоту, которая подвергалась взаимодействию с TMAAc (рис. 4). Пик с самым высоким обилием указывал на не прореагировавший эфир. Наши результаты, касающиеся термохимолиза алифатических эфиров по TMAAc соответствовали его результаты представлены в литературе [6].
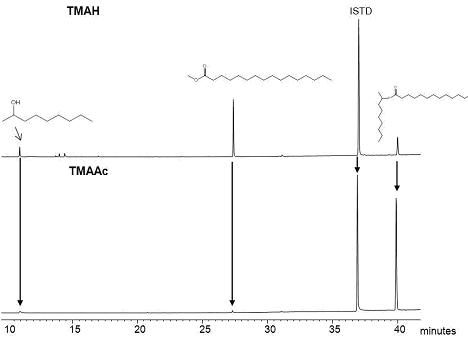
Рисунок 4 – Продукты, полученные из 2-нонил пальмитат термохимолиом TMAH и термохимолизом TMAAc
Количество высвобожденной пальмитиновой кислоты была рассчитана для экспериментов термохимолиза ТМАН и TMAAc (рис. 5), (рис. 6). Содержание пальмитиновой кислоты определяется ТМАН по сравнению с теоретическим содержанием. Результаты показали, что общее содержание пальмитиновой кислоты было близко к теоретическому значению (рис. 5). Когда используется в качестве растворителя метанол, среднее содержание пальмитиновой кислоты была ближе к теоретическому значению, чем в качестве растворителя дихлорметан. Тем не менее, стандартное отклонение выше при использовании метанола. Содержание пальмитиновой кислоты из пальмитата с TMAAc была приблизительно одна треть от теоретического общего содержания. Содержание пальмитиновой кислоты измеряли в метаноле, который используется в качестве растворителя по сравнению с дихлорметаном. Тем не менее, метилирование пальмитиновой кислоты не может быть объяснено, поскольку содержимое пальмитиновой кислоты была равна в обоих растворителях. Измеренное содержание свободной пальмитиновой кислоты было удивительно высокое, как и любая не прореагировавшая пальмитиновая кислота, после синтез должена была быть удалена. Пальмитиновая кислота дополнительно проверена с помощью ЯМР-анализа продукта.
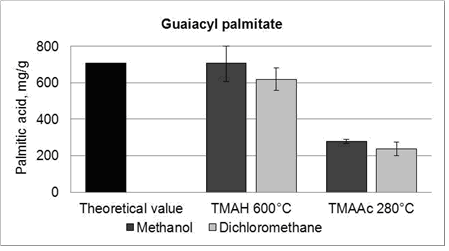
Рисунок 5 – Пальмитиновые кислоты освобождается от пальмитата, ТМАН и TMAAc
Содержание пальмитиновой кислоты определяется с ТМАН, был несколько ниже, чем теоретическое значение, так как часть 2-нонил пальмитатов не реагирует с ТМАН. Небольшой пик эфира видно в общее ионный газа-хроматограмме. Небольшое количество пальмитиновой кислоты измеряли в присутствии TMAAc от 2-нонил пальмитата (рис. 6). Содержание пальмитиновой кислоты измеряется от 2-нонил пальмитат, было значительно ниже по сравнению с содержанием пальмитиновой кислоты. В случае 2-нонил пальмитат, TMAAc по-видимому, реагируют только с группой свободной кислоты, а не с эфирной группой, как ожидалось. В результате оказалось, что эфирная алифатическая связь является более стабильной. Также в этом случае, содержание пальмитиновой кислоты было несколько выше, когда образцы были разбавлены в метаноле, а не дихлорметана. Тем не менее, стандартное отклонение при использовании метанола было большим. В связи с аналогичными величинами, полученными из растворителей, было предложено, переэтерификацию метанола провести с использованием TMAAc, что обусловило незначительную реакцию в режиме онлайн термохимолиз.
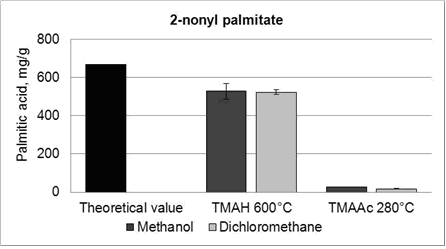
Рисунок 6 – Пальмитиновые кислоты освобождается от 2-нонил пальмитата, ТМАН и TMAAc
Влияние температуры пиролиза на выход пальмитиновой кислоты был изучен в случае 2-нонил пальмитат, так как часть сложного эфира не подвергали гидролизу и метилированию в присутствии ТМАН. Тем не менее, не было никаких различий в содержании пальмитиновой кислоты при температурах 600, 700 и 800 °С, что указывает на гидролиз и метилирование (рис. 7). Влияния времени реакции до пиролиза и после на выход пальмитиновой кислоты не изучались.
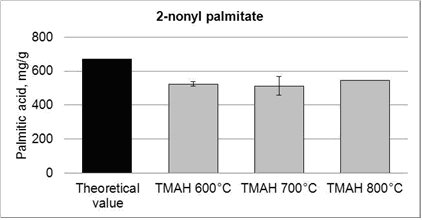
Рисунок 7 – Влияние температуры на выход пальмитиновой кислоты из 2-нонильных пальмитатов
4. Выводы
В этом исследовании, ТМАН был использован для определения общего содержания пальмитиновой кислоты от модельных соединений, которые представляли как алифатические и ароматические эфирные связи между спиртами и жирными кислотами. Пальмитиновую кислоту гидролизуют и метилируют полностью из ароматического эфира, в то время как часть алифатического эфира оставалось стабильным. TMAAc ранее был использован для дифференциации свободных и этерифицированных кислот. Результаты, полученные в этом исследовании показали, что эфирно-ароматическая связь частично гидролизованна и метилированна в присутствии TMAAc, тогда как алифатическая связь устойчива к TMAAc. Это означает, что TMAAc можно использовать для различения свободных кислот и алифатических эфиров в матрицах, таких как дерево экстрактивных веществ, содержащий только алифатические спирты. Однако она не может использоваться для определения свободных кислот из образцов, содержащих либо ароматических и алифатических сложноэфирных связи, или только ароматических связей. Переэтерификацией в термохимолизе в присутствии метанола было предложено повысить выход метилированных продуктов. Однако было показано, что в настоящее время в режиме онлайн термохимолиза, реакция переэтерификации является незначительной.
Список источников
- J. M. Challinor. A Pyrolysis-derivatisation-gas chromatography technique for the structural elucidation of some synthetic polymers, J. Anal. Appl. Pyrol. 16 (1989), pp. 323–333.
- J. M. Challinor, Review: The development and applications of thermally assisted hydrolysis and methylation reactions, J. Anal. Appl. Pyrol. 61 (2001), pp. 30–34.
- F. Shadkami, R. Hellure, Review: Recent applications in analytical thermochemolysis, J. Anal. Appl. Pyrol. 89 (2010), pp. 2–16.
- J. M. Challinor, On the mechanism of high temperature reactions of quaternary ammonium hydroxides with polymers, J. Anal. Appl. Pyrol. 29 (1994), pp. 223–224.
- J. M. Challinor, Characterisation of wood extractives by pyrolysis-gas chromatography-mass spectrometry of quaternary ammonium hydroxide extracts, J. Anal. Appl. Pyrol. 37 (1996), pp. 1–13.
- H. L. Hardell, N. O. Nilvebrant, A rapid method to discriminate between free and esterified fatty acids by pyrolytic methylation using tetramethylammonium acetate or hydroxide, J. Anal. Appl. Pyrolysis 49 (1999), pp. 1–14.
- D. Drechsel, K. Dettmer, W. Engewald, Studies of thermally assisted hydrolysis and methylation - GC-MS of fatty acids and triglycerides using different reagents and injection systems, Chromatographia Supplement 57 (2003), pp. 283–289.
- L. Grasset, C. Guignard, A. Ambles, Free and esterified aliphatic carboxylic acids in humin and humic acids from a peat sample as revealed by pyrolysis with tetramethylammonium hydroxide or tetramethylammonium acetate, Organic Geochemistry 33 (2002), pp. 181–188.
- C. Guignard, L. Lemee, A. Ambles, Lipid constituents of peat humic acids and humin. Distinction from directly extractable bitumen components using TMAH and TEAAc thermochemolysis, Organic Geochemistry 36 (2005), pp. 287–297.
- D. Valkova, L. Grasset, A. Ambles, Molecular compounds generated by ruthenium tetroxide oxidation and preparative off line thermochemolysis of lignite humic acids from South Moravia: Implications for molecular structure, Fuel 88 (2009), pp. 2113–2121.
- M. Mizumoto, E. Shimokita, T. Ona, T. Seino, Y. Ishida, H. Ohtani, Rapid and direct characterization of total fatty acids in wood by thermochemolysis-gas chromatography-flame ionization detector/mass spectrometry with tetrabutylammonium hydroxide, J. Anal. Appl. Pyrolysis 87 (2010), pp. 163–167.
- C. A. Joll, D. Couton, A. Heitz, R. I. Kagi, Comparison of reagents for off-line thermochemolysis of natural organic matter, Organic Geochemistry 32 (2004), pp. 47–59.