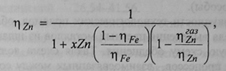
Авторы: Троянский A.A., Ростовский В.И., Скрябин В.Г., Раджи О.И.
Источник: Троянский A.A., Ростовский В.И., Скрябин В.Г., Раджи О.И. Перспективы комплексной утилизации цинксодержащих шламов по «Xимволокно» и черной металлургии. — Донецк: ДонНТУ, 2004. — 7 с.
В настоящее время в промышленном производстве черных металлов и вискозно-штапельного волокна образуется значительное количество отходов, комплексное использование которых позволяет расширить сырьевую базу, а также сократить расходы первичного сырья, материалов и топливно-энергетических ресурсов на производство соответствующей продукции. Актуальные вопросы ресурсосбережения при комплексном использовании вторичных материальных ресурсов очень важны для народного хозяйства Украины, для которого в различных отраслях и промышленных регионах разработаны и разрабатываются соответствующие программы. Реализация мероприятий этих программ позволит существенно уменьшить ущерб окружающей среде и повысить экономическую эффективность общественного производства.
На ПО «Xимволокно» Украины (Черкасское, Киевское, Сокальское) при производстве вискозно-штапельного волокна образуется значительное количество шламов, в которых содержание цинка соответственно составляет, %: 5,42–5,64; 9,53–12,37 и 38,8. Общие ресурсы цинка на этих предприятиях составляют более 10 тыс.т. Кроме цинка в этих шламах содержатся, %: Fе — 1,42–4,91; Рb — 0,3–0,62; Сu — 0,04–0,08; Sn — 0,012–0,047; СаО — 13,5–27,0; MgO — 0,84–1,58; SiO2 — 2,3–5,46; сульфатов — 6,78–9,58 и органических соединений — 26,54–41,56.
Существующие способы [1–3] регенерации этих шламов в технологических потоках сложные и дорогостоящие, поэтому они, в основном, складируются в соответствующих шламонакопителях. При этом теряются ценные компоненты этих шламов и происходит отрицательное влияние на состояние окружающей среды.
Б черной металлургии проблема утилизации железосодержащих шламов в последнее время обострилась в связи с повышением содержания цинка и других цветных металлов в доменных и сталеплавильных шламах. Переработка цинксодержащих шламов в агломерационном производстве способствует повышению содержания цинка в агломерате, что приводит к превышению предельно допустимого количества цинка, поступающего с шихтой в доменную печь. Наличие цинка в шихтовых материалах доменных печей служит причиной снижения прочности кокса и железорудного сырья печи, преждевременного разрушения огнеупорной кладки и разрывов кожухов печей, изменения свойств шлака, резкого ухудшения газодинамических условий доменного процесса и увеличения расхода кокса [4].
Шламы ПО «Химволокно» гидрофильные, влагоемкие и сильно обводнены. Влажность шламов после очистных сооружений составляет 60–90%, а после длительной выдержки в шламонакопителе влажность верхних слоев достигает 30%. По нашим исследованиям транспортабельность шламов сохраняется до влажности 60%. Для пирометаллургической переработки этих шламов с извлечением цинка целесообразно их после соответствующей подготовки отгружать на близлежащие металлургические предприятия, где будет организована переработка цинксодержащих металлургических шламов, с которыми заскладировано более 50 тыс.т цинка. Указанные шламы могут быть ценным сырьем для производства в Украине дефицитного цинка, потребности в
котором ежегодно увеличиваются.
Для извлечения цветных металлов из пылей и шламов, в основном, используются высокотемпературные способы их переработки, которые можно подразделить следующими образом [5]:
Выбор способа переработки зависит от содержания полезных и вредных примесей, дисперсного состава и целей, поставленных перед производством. Сейчас наиболее распространены пирометаллургические способы, основанные на термообработке отходов в восстановительной атмосфере с получением металлизованного продукта и улавливанием пыли, обогащенной цветными металлами [6].
Большое число способов извлечения цинка из цинксодержащих отходов находится в разных стадиях исследования и разработки. Кроме этого, в указанных шламах содержатся другие цветные, легирующие и редкие металлы и их оксиды, поведение которых в пировосстановительных процессах недостаточно изучено и требует соответствующих обоснований. Поэтому цель данной работы состояла в определении недостающих температур начала их восстановленния и дальнейщего поведения в соответствующих процессах.
В работах [7,81 отмечаются две тенденции усовершенствования пирометаллургического передела:
Первая группа включает новые разновидности процессов, использующих электротермические методы (карбидотермический процесс, обеднение цинковых шлаков в электропечах коксовой проводимости, восстановительную электроплавку сплавов, цементационные методы обеднения цинковых шлаков с помощью ферросилиция и другие восстановительные способы).
Выявление совокупности технологических приемов, обязательных для пиромсталургического передела выделения цветных металлов из шлаков, позволило бы сформулировать обобщенную схему обеднения. Такая схема должна содержать цепочку элементарных звеньев процессов, взаимосвязанных между собой. Обобщенная схема позволит объективно оценивать конкретные способы, выявлять причины их недостатков, а также облегчить математическое описание обеднительного процесса в целом.
Общие закономерности восстановительного обеднения цинкосодержащих материалов можно описать с учетом того, что шлаки цветной металлургии содержат, в основном, соединения цветных металлов. Восстановители действуют на многокомпонентные системы избирательно. Обычно не восстанавливаются CaO, MgO, А1203. Для процессов восстановительного обеднения важно оценить возможность восстановления соединений железа и цветных металлов. Обычно, в качестве восстановителя используется углерод [9].
Последовательность восстановления выявляется термодинамически при сравнении парциальных давлений продуктов реакции Ррили кислородных потенциалов оксидов Пп Восстановление протекает, если
Рp > Р гф
По(МеО) ≥ По(гф)
где индекс гф указывает на принадлежность к газовой фазе печи.
Термодинамический анализ простых систем показывает, что свободные оксиды железа, пинка, кобальта, никеля, свинца и др. могут восстанавливаться параллельно или совместно Условия восстановления оксида из раствора (шлака) из-за меньшей активности ухудшаются, и для выполнения условия (1) нужно увеличить температуру процесса При постоянной температуре восстановление оксида, концентрация которого становится малой, прекращается. Полное восстановление любого из растворенных в шлаке соединений практически невозможно.
Наибольшие скорости восстановления получают при использовании газовых
восстановителей, наименьшие — при использовании твердых. Во многих случаях эта
различия стираются, так как восстановление углеродистыми материалами часто
протекает через газовую фазу, так называемому косвенному механизму. При этом
оксиды реагируют непосредственно не с твердым углеродом, а с оксидом углерода,
образующимся при газификации твердого углерода по реакции
С + СО2 = 2 СО.
Преобладание косвенного восстановления типично для процессов в твердой фазе, а в расплавах оба механизма играют существенную роль. При восстановлении жидких свинцовистых (35–40% РbO), цинковистых (10–18% ZnO) шлаков также преобладает косвенное восстановление.
В работе [8] описана технология обеднительной элсктроплавки цинковистых шлаков. Плавки ведут с ограниченным расходом углеродистого восстановителя, обеспечивающие образование только металлического железа в верхнем слое шлака. Капли железа проходят через шлак, восстанавливая из него ZпО. Такой способ плавки отличается высокой интенсивностью и энергоемкостью. Извлечение цинка достигает 85–90% . Железо и цинк восстанавливаются углеродом параллельно. В цинковистых шлаках содержится до 26–35% 2пО, поэтому внутренняя металлотермия возможна только в богатых (более 27% /ч?0) шлаках. Из бедных по FеО шлаков оксид цинка восстанавливается только углеродом. Эта технология может оказаться эффективной и для других процессов восстановительного обеднения.
Извлечение цинка можно описать уравнением [8]:
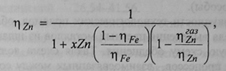
где: ηZn ndash; суммарное извлечение цинка в сплав и паровую фазу; ηZnгаз – извлечение цинка в паровую фазу; xZn — концентрационная функция распределения цинка в сплаве; г\Гр – суммарное извлечение железа в сплав.
С целью оценки температурного режима проведения
процесса восстановления цинксодсржащих отходов твердым углеродом, а также
качественного состава продуктов нами рассчитаны термодинамические температуры
начала восстановления оксидов твердым углеродом по следующей схеме:

Эта система имеет четыре фазы (оксид, углерод, металл, газ) с тремя компонентами (металл, углерод, кислород). Согласно правилу фаз она моновариантна.
С=k+2+4=3+2–4=1. (6)
Поэтому давление в системе однозначно определяет температуру начала восстановления. Газовая фаза состоит из СО и СО2, сумма парциальных давленний которых равна давлению в системе.
Аналитическое выражение можно записать через температурные зависимости констант равновесия реакций (3) и (4):
К1 = Рсо 2 / Рсо
К2 = Р2со/ Рсо 2
Р = Рсо + РСО 2
где К1 и K2 — константы равновесия реакций; Р — давление в системе; Рсо и Рсо2 — парциальные давления СО и СО2.
Константы равновесия реакций можно выразить через свободные энергии образования соединений:
lnК = –ΔG0 / RT = –(А + BT)/(RT),
где: ΔG° — свободная энергия; R — универсальная газовая постоянная; Т — абсолютная температура; А и В — коэффициенты уравнения.
Величины AG° реакций (3) и (4), выраженные через стандартные энергии образования оксидов, соответственно будут равны:
ΔG° = ΔG°co2 – ЛG°co – 1/y ∙ ΔG°MexOy;
ΔG20 = 2ΔG°co — ΔG°co2 .
Подставив в уравнения (7) и (8) Рсо2 из уравнения (9) и соответствующие температурные зависимости для и AG2, получим систему уравнений:
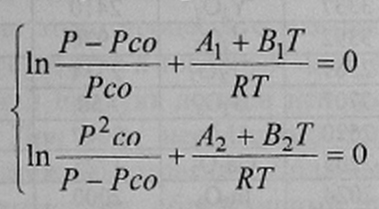
Стандартные энергии образования оксидов углерода приняли следующие [7]:
c+1/2О2=co ΔG °со = –111713 — 87.65Т Дж/моль;
С + 02 = С02 ΔG°co2 = –394133 — 0.84Т Дж/моль.
Преобразовав уравнения (13) и (14) с учетом (11), (12), (15) и (16), получим расчетное выражение:
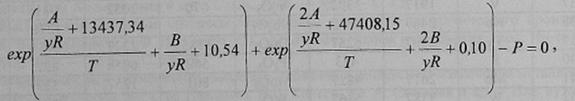
где А и В — коэффициенты температурной зависимости свободной энергии образования оксида ΔG°MexOy ; y — число атомов кислорода в молекуле оксида; R — универсальная газовая постоянная; Р — давление в системе, атм.
Для определения термодинамической температуры начала
восстановления оксида твердым углеродом при задаваемом давлении в системе (1
ат) уравнение (17) решали поисковым методом дихотомии. После вычисления
температуры определяли значение равновесного парциального давления Рсо
по полученному из системы (13) и (14) уравнению:
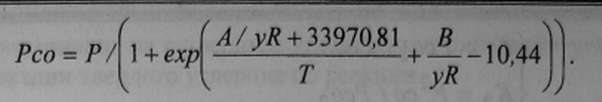
Табл. 1. Температуры плавления (tп), кипения (tк) [12,13], начала восстановления оксидов (/«) и парциальное равновесное давление Рсо при te
| № п/п | Металл | tп°С | tk°С | Оксид | tп°С | tk°С | tв | PCOатм |
| 1 | Na | 98 | 879 | Na20 | 920 | 1350 | ||
| 2 | К | 63 | 759 | K20 | 707p | |||
| 3 | Be | 1287 | 2471 | BeO | 2520 | 3900 | 2338 | 0,999 |
| 4 | Mg | 650 | 1103 | MgO | 2800 | 3600 | 1852 | 0,999 |
| 5 | Са | 850 | 1483 | CaO | 2587 | 3500 | 2144 | 0,999 |
| 6 | Sr | 770 | 1357 | SrO | 2430 | 3000 | 2005 | 0,999 |
| 7 | Ва | 710 | 1634 | BaO | 1920b | 2700 | 2021 | 0,999 |
| 8 | Zn | 419,6 | 906 | ZnO | 1975 | 1036 | 0,995 | |
| 9 | Cd | 321 | 766 | CdO | 826b | 436 | 0,018 | |
| 10 | Mn | 1244 | 2119 | MnO | 1785b | 3127 | 1406 | 0,999 |
| 11 | Fe | 1539 | 2872 | FeO | 1371 | 2512 | 701 | 0,603 |
| 12 | Co | 1494 | 2957 | CoO | 1810 | 2627 | 275 | 0,0003 |
| 13 | Ni | 1455 | 2897 | NiO | 1957p | 192 | 9∙10–6 | |
| 14 | Cu | 1084 | 2543 | CuO | 1336p | 150 | ||
| 15 | In | 156 | 2024 | InO | 1052 | 1727 | 479 | 0,041 |
| 16 | Sn | 232 | 2623 | SnO | 1042p | 1527 | 583 | 0,200 |
| 17 | Pb | 327 | 1745 | PbO | 886 | 1472 | –50 | |
| 18 | Se | 217 | 657 | SeO | 1102 | 1802 | ||
| 19 | Sc | 1530 | 2832 | Se2O3 | 2405 | 2086 | 0,999 | |
| 20 | Y | 1500 | 3337 | Y2O3 | 2410 | 4300 | 2394 | 0,999 |
| 21 | V | 1917 | 3392 | V2O3 | 1970 | 3027 | 1509 | 0,999 |
| 22 | Cr | 1903 | 2567 | Cr2 O3 | 2334 | 3000 | 1260 | 0,999 |
| 23 | В | 2075 | 3707 | B2o3 | 450 | 2124 | 1607 | 0,999 |
| 24 | A1 | 660 | 2520 | A1203 | 2047 | 2980 | 2026 | 0,999 |
| 25 | Ga | 29,8 | 2205 | Ga203 | 1725 | 1013 | 0,994 | |
| 26 | In | 157 | 2024 | ln203 | 2000 | 3327 | 758 | 0,788 |
| 27 | As | 612 | As203 | 278 | 457 | –46 | 8.10*16 | |
| 28 | Sb | 631 | 1625 | Sb203 | 665 | 1425b | 128 | 3.10*v |
| 29 | Bi | 272 | 1557 | Bi203 | 825 | 1890 | ||
| 30 | Ті | 1668 | 3169 | Ti02 | 1870 | 2927 | 1764 | 0,999 |
| 31 | Zr | 1855 | 4325 | Zr02 | 2700 | 4300 | 2173 | 0,999 |
| 32 | Mo | 2617 | 4827 | Mo02 | 1927 | 758 | 0,787 | |
| 33 | W | 3387 | 5367 | WO2 | 1570 | 1852p | 757 | 0,784 |
| 34 | Si | 1415 | 3249 | Si02 | 1720 | 2950 | 1667 | 0,999 |
| 35 | Ge | 937 | 2847 | Ge02 | 1116 | 2352 | 468 | 0,034 |
| 36 | Sn | 232 | 2623 | Sn02 | 624 | 0,319 | ||
| 37 | V | 1917 | 3392 | v2o5 | 670 | 2052 | 911 | 0,975 |
| 38 | Nb | 2469 | 4842 | Nb205 | 1276 | 0,999 | ||
| 39 | Та | 2997 | 5287 | Ta205 | 1785 | 2227 | 1451 | 0,999 |
| 40 | P | 423 | P2O5 | 562 | 605в | 827 | 0,907 | |
| 41 | Mo | 2617 | 4827 | Mo03 | 801 | 1257 | 333 | 0,0016 |
| 42 | W | 3387 | 5367 | wo3 | 686 | 0,545 | ||
| р — разлагается; в — возгоняется. Примечание: Не определены температуры начала восстановления оксидов, для которых не имели данных по величинам свободной энергии в нужном интервале температур | ||||||||
Таким образом, при давлении в системе 105 Па по уравнению (17) определяли термодинамические температуры начала восстановления оксидов твердым углеродом с задаваемой точностью расчета 0,1 °С и по уравнению (18) равновесное парциальное давление СО, пользуясь данными [10,11] по температурным зависимостям свободной энергии образования оксидов. Эти расчетные величины, а также справочные данные [12,13] по температурам плавления и кипения для 42 металлов и их оксидов представлены в таблице 1, из которой видно, что температура начала восстановления оксида цинка составляет 1036 С. В расчете не учитывали, что цинк при этой температуре находится в парообразном состоянии и несколько разбавляет отходящие газы, уменьшая парциальное давление СО. Это приведет к некоторому снижению температуры начала восстановления. По литературным данным [14] оксид цинка может начинать восстанавливаться при температуре примерно 950 °C. Для проведения производственного процесса температурный режим возгонки цинка можно оценить в интервале от 1100 °C до температуры расплавления шихты. Ниже этих значений оказываются температуры начала восстановления следующих элементов: Zn, Cd, Fe, Со, Ni, Си, In, Sn, Mn, Pb, Ga, As, Sb, Mo, W, Ge, V, P. Они будут восстанавливаться ниже температур их кипения, кроме цинка и элементов: Cd, As, P.
Таким образом, возгоны будут содержать Cd, Zn, Р, As. Так как восстанавливаемые элементы Си, Zn, Sn, Pb, Ga, Sb, Ge будут в жидком состоянии, то их пары частично могут попадать в возгоны. В шихте будут оставаться восстанавливаемые элементы Fe, Со, Ni, Mn, Mo, W, V и частично Си, Zn, Sn, Pb, Ga, Sb, Ge.
Приведенные данные можно использовать при комплексной переработке пылей и шламов ПО «Химволокно» и черной металлургии, так как они содержат значительное количество цветных, легирующих и редких металлов [15]. Процесс переработки отходов будет тем более экономичным чем выше содержание в них извлекаемых металлов.
Для организации извлечения цинка из цинксодержащих отходов различных отраслей необходимо решать комплекс сложных специальных вопросов. Например, для извлечения цинка из шламов черной мстатлургии необходимо разрабатывать и решать вопросы их обезвоживания, подготовки для восстановительного пирометаллургического процесса, осуществление этого процесса с возгонкой цинка, улавливание возгонов цинка и дальнейшая их переработка в товарный цинк в цветной металлургии. Метализованный железосодержащий продукт должен использоваться в сталеплавильном или доменном производствах. При этом необходимо организовать экологически чистые безотходные процессы в смежных отраслях. Должны также решаться экономические взаимоотношения между отраслями, образующими цинксодержащие отходы и производящими из них товарный цинк.