Реферат за темою випускної роботи
Зміст
- Вступ
- 1. Опис предметної області
- 2. Постановка завдання
- 3. Рішення завдання
- Висновки
- Перелік посилань
Вступ
Лікування ран, виразок і опіків, які важко загоюються – одна з галузей медицини, де досить давно і широко застосовуються і продовжують розвиватися методи клітинної терапії.
У 1975 році було запропоновано застосування культивованих клітин шкіри (кератиноцитів) при лікуванні опіків. Кератиноцити – клітини, з яких складається самий верхній, що постійно оновлюється шар шкіри – епідерміс. Найчастіше використовується аутотрансплантація – тобто у пацієнта беруть маленький шматочок шкіри, з нього виділяють кератиноцити, вирощують їх в культурі і закривають отриманим пластом ранову поверхню. Трансплантація вирощених епідермальних пластів є одним з найбільш складних і відповідальних етапів технології лікування, від правильного виконання якої часто залежать результати лікування.
Нижче наведені основні причини невдалих трансплантацій епітеліальних пластів [3]:
- Недостатня готовність пластів до пластики. Оптимальним є пласт, що складається з 8–12 шарів клітин. Передчасна або пізня пересадка малоефективні.
- Пересадка незрілого (молодого) пласта. Як правило, поверхня культурального флакона заростає клітинами нерівномірно. Обробка діспазой такої культури призводить до нерівномірного зняттю пласта, з дірками. Ефективність такої трансплантації невисока.
- Трансплантація перезрілого клітинного пласта. При наявності великої кількості шарів клітин порушується живлення кератиноцитів базального шару.
Однією з умов успішного приживлення багатошарового пласта кератиноцитів є їх своєчасна трансплантація на рани. Регулярний контроль життєздатності культивованого пласта, допоможе своєчасно помітити можливі відхилення і прийняти рішення про збереження якісного фрагмента пласта або засіванні матраца новою культурою. Проблема полягає в тому, що несвоєчасне звільнення матраців від свідомо неякісних культур веде до втрати значних фінансових коштів, а головне часу, який часто є вирішальним фактором при лікуванні хворих з великими пошкодженнями шкірного покриву. Кількість обладнання для вирощування кератиноцитів, як правило, обмежена, а матеріал для пересадки, який не можна зробити про запас, часто необхідний у великій кількості і в стислі терміни, наприклад під час техногенних катастроф, які поширені в нашій країні.
1. Опис предметної області
Кількісний вихід клітин з шкірних клаптів і ефективність їх культивування залежать від:
- Тривалості зберігання клаптів шкіри від моменту зрізання до початку виділення клітин.
- Температури, при якій містяться шкірні біоптати в процесі транспортування з клініки в лабораторію, де здійснюється культивування клітин.
- Складу середовища, в якій знаходяться проби шкіри.
Температурний режим. У разі зберігання при кімнатній температурі шкірних клаптів, взятих від обпалених або донорів шкіри, виділити з них достатню кількість життєздатних клітин не вдається, проліферація кератиноцитів в культурі відбувається мляво. При зберіганні шматочків шкіри в охолодженому стані (при t = + 4 °С) вітальні властивості клітин зберігаються протягом тривалого часу (протягом декількох діб). Було встановлено, що при виділенні клітин у строки в межах до 48 годин після зрізання шкіри життєздатність кератиноцитів знижується незначно і забезпечується достатній вихід життєздатних клітин.
Таким чином, клапті шкіри слід зберігати при зниженій температурі (від 0 °С до + 4 °С), слід прагнути до того, щоб проміжок часу між відбором проб до початку виділення клітин був більш коротким.
Вибір транспортної середовища. Крім температурного режиму на життєздатність клітин впливає і склад середовища, в якій транспортують зрізані шкірні клапті. У дослідженнях перед початком зберігання зразки шкіри ретельно промивали в розчині Хенкса з антибіотиками, а саме зберігання здійснювали при t = + 4 °С в середовищі Ігла або середовищі 199 з додаванням 10% сироватки великої рогатої худоби [4]. У Великобританії для цієї мети використовують середу DMEM з додаванням 5% фетальної бичачої сироватки та антибіотиків.
У значно меншій мірі для зберігання і транспортування клаптів шкіри підходять сольові розчини (зокрема, розчин Хенкса). Використання більш простих розчинів (глюкози, 0,9% NaCl тощо) не дозволяє здійснювати тривалу за часом транспортування.
Таким чином, в якості транспортного середовища слід використовувати склади, застосовувані для культивування клітин і мають повний набір необхідних поживних речовин.
Кількість виділених зі шкіри клітин та їх життєздатність в чому залежать від температурного режиму зберігання і від складу використовуваної транспортної середовища.
Виділення кератиноцитів. Відомо, що не всі клітини епідермісу мають здатність до проліферації. Для культивування має сенс виділяти, насамперед, клітини базального шару.
Культивування кератиноцитів. Ефективність культивування кератиноцитів і формування багатошарового пласта залежить від ряду факторів:
- Стану клітин (їх життєздатності та здатності до проліферації).
- Складу ростовой середовища, використовуваних добавок і ростових факторів.
- Виду субстрату, на який висіваються клітини.
- Конкретного варіанту технології культивування.
Технологія культивування кератиноцитів надзвичайно складна і може бути реалізована тільки в спеціалізованих біотехнологічних центрах. В даний час відомо досить багато варіантів цієї технології, що відрізняються один від одного складом середовища, наявністю тих чи інших добавок і ростових факторів.
Культивування клітин проводять у присутності фидерного шару трансформованих фібробластів лінії ЗТЗ, попередньо оброблених мітоміцином С або опромінених в сублетальлними дозах для того, щоб зупинити їх проліферацію. У такому стані ці клітини кондиціонують ростову середу біологічно активними речовинами, стимулюючими зростання кератиноцитів.
Культивують кератиноцити в чашках Петрі або в спеціальних флаконах. Інкубацію клітин проводять в термостатах при температурі 37 °С в атмосфері, що містить 5% СO2. У разі правильного виділення клітин базального шару вже через 48 годин спостерігається утворення колоній кератиноцитів. Ростову середу міняють кожні 3–4 дні. При необхідності здійснюють пересівання клітинної культури.
Формування багатошарових пластів кератиноцитів. Після посіву отриманої клітинної суспензії в культуральні флакони кератиноцити прикріплюються і розпластуються на поверхні підкладки, після чого починають активно ділитися і формують колонії. Останні поступово зливаються один з одним і формують суцільний пласт кератиноцитів. Швидкість формування пласта залежить від багатьох факторів:
- Від кількості інокуліруемих клітин і від їх функціонального стану.
- Від складу культурального середовища і використовуваних ростових добавок.
- Від способу підготовки підкладки, тобто від обробки дна культурального флакона.
Формування багатошарового пласта кератиноцитів при культивуванні за методом Гріна зазвичай займає 3–4 тижні. Освіта клітинного пласта відбувається в наступній послідовності: прикріплення і распластиваніе клітин, посилене ділення, формування колоній і злиття колоній між собою на поверхні культурального флакона.
Після прикріплення агрегату клітин досить швидко формується колонія. поодинокі клітини також можуть прикріплятися до поверхні підкладки. У цьому випадку утворюється відносно рівний моношар клітин. Колонії за рахунок поділу клітин збільшуються в розмірах і поступово зливаються. Центральна частина колоній в результаті диференціювання стає багатошаровою, відбувається стратифікація колонії. Через певний час утворюється суцільний багатошаровий (стратифікований) пласт.
Визначення ступеня готовності багатошарового пласта кератиноцитів до трансплантації на рани. Однією з умов успішного приживлення багатошарового пласта є їх своєчасна трансплантація на рани. Для цього необхідно визначити ступінь готовності багатошарового пласта кератиноцитів до пересадки.
Молодий чи недозрілий пласт більш тонкий, має більш слабкі міжклітинні звʼязки і в процесі ферментативної обробки діспазой може зруйнуватися. У міру стратифікації клітинного пласта погіршуються умови вбирання базального шару кератиноцитів. З цієї причини многомлойни пласт не можна перетримувати, необхідно своєчасно оцінити ступінь його зрілості і здійснити трансплантацію.
Про зрілість клітинної культури судять, головним чином, по картині, що спостерігається в інвертований мікроскоп.
2. Постановка завдання
Важливим етапом для проведення успішної операції, є визначення життєздатності матеріалу.
Визначення життєздатності може проводитися різними методами. Найбільш простим є додавання спеціальних барвників, які проникають всередину клітини тільки при пошкодженні її оболонки. Таким чином, пофарбовані клітини визнаються не життєздатними. Звичайно, барвник додається не в весь отриманий матеріал, а тільки в його зразок з подальшим розрахунком рівня життєздатності всіх забраних клітин.
Більш складні методики оцінки життєздатності зводяться до визначення можливості клітин здійснювати свої функції [1]. Для цього в первинній культурі обчислюють рівень вмісту специфічних речовин, які виробляються клітинами в нормальному стані. зниження концентрації цих речовин вказує на те, що зовні неушкоджена клітина може виявитися функціонально неповноцінною, тобто не придатною для подальшого використання. До недоліків цих методів зараховують часові витрати і субʼєктивність одержуваних результатів.
Проаналізувавши існуючі методи визначення життєздатності вирощуваних кератиноцитів, можна прийти до висновку, що вони чинять фізичний вплив на клітини [8]. Для цього необхідно регулярно виділяти частину (хай і невелику) вирощуваної культури. Таким чином, зʼявляється задача розробки методу, що не завдає фізичного впливу на клітини.
3. Рішення завдання
Для вирішення завдання оцінки життєздатності кератиноцитів була обрана методика обробки їх зображень, так як використання цієї методики не вимагає фізичного впливу на клітини.
Вхідними даними в системі, що розробляється будуть знімки матраців з клітинами розміром 512×512 пікселів, отримані за допомогою камери, встановленої на мікроскопі. Приклади знімків представлені на рис. 1.
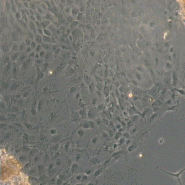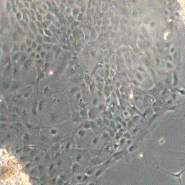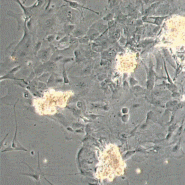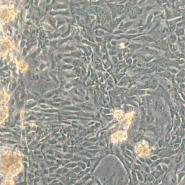
Рисунок 1 – Приклади вхідних знімків
(анімація: 5 кадрів, 6 циклів повторення, 127 Кб)
Далі повинні бути отримані його характерні ознаки, які можна буде використовувати для класифікації. Зображення шару кератиноцитів має складну текстуру. Також існує вплив оператора при отриманні знімків, так як мікроскоп можна налаштувати на різний масштаб і повернути його під різним кутом. Тому існує потреба зробити зображення нахил‑ і масштаб‑ інваріантним. Подібні завдання розглядалися в роботі [2], при дослідженні фібробластів. Для вирішення цієї проблеми планується вихідне зображення піддати лог‑полярному перетворенню.
Алгоритм лог‑полярного перетворення зображень кератиноцитів розділений на 2 основних етапи. На першому етапі радіус найбільшого кола (r) усередині даного зображення використовується як сканирующая лінія вибірки (семплювання) S раз від 0° до 360° для отримання еквівалентної S×[N/2] полярної форми (див. рис. 2a) [5]. Так, формально, полярна форма p(a, r) даного зображення f(x, y) розміром N×N може бути обчислена як:
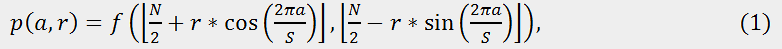
для a = 0, …, S – 1, і r = 0, …, [N/2] – 1.
На другому етапі логарифмічна функція застосовується до всіх значень радіуса в полярній формі, і їх вихідні величини квантуються на R станів. Отримуємо лог‑полярне зображення розміром S×R для заданого N×N зображення, як показано на рис. 2b.
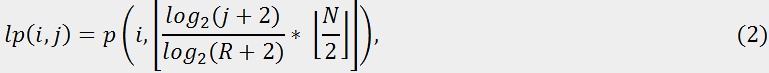
для i = 0, …, S – 1, і j = 0, …, R – 1.
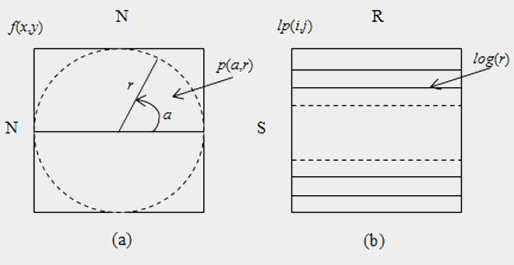
Рисунок 2 – Схематичне представлення отримання параметрів для лог‑полярного перетворення: (а) – одержання параметрів полярної форми p(a, r), (b) – одержання параметрів лог‑полярного зображення
Далі з отриманого лог‑полярного зображення планується витягти інформативні ознаки: питому енергію і питому ентропію. Для цього планується використовувати вейвлет перетворення [6, 7].
Висновки
Був проведений аналіз існуючих методів оцінки життєздатності кератиноцитів і обгрунтовано метод обробки зображень. За результатами проведених досліджень був розроблений алгоритм обробки зображень і визначення інформативних ознак з метою оцінки життєздатності вирощуваних кератиноцитів. Надалі планується проведення машинних експериментів з еталонними знімками кератиноцитів, з метою перевірки ефективності обраного методу.
Перелік посилань
- Смирнов С. В., Киселев И. В., Васильев А. В., Терских В. В. Современные методы клеточной терапии при лечении ожогов. [Текст]/ Смирнов С. В., Киселев И. В., Васильев А. В., Терских В. В. // Хирургия. Журнал им. Пирогова Н. И. – С. 25.
- Меркулова Е. В. Создание модели процесса определения жизнеспособности культивируемых фибробластов для автоматизированной системы. [Текст]/ Меркулова Е. В. // Вестник Херсонского Государственного технического университета. – Херсон: ХГТУ. – 2004 р. – № 1 (19).
- Клеточные технологии в лечении ран, язв и ожогов/ [Интернет‑ресурс] – Режим доступа: http://www.cmbt.su.
- Хранение и траспортировка лоскутов кожи/ [Интернет‑ресурс] – Режим доступа: http://www.rusmedserver.ru.
- Пан Ч. М., Ли М. Ч. Лог‑полярные вейвлет сигнатуры для классификации текстур/ [Интернет‑ресурс] – Режим доступа: http://masters.donntu.ru.
- Яковлев А. Н. Примеры вейвлет‑преобразований.[Текст]/ Яковлев А. Н. // Введение в вейвлет‑преобразования – Новосибирск – 2003 г.
- Адамов В. Г., Каира В. В. Компьютерная система прогнозирования сроков созревания кератиноцитов [Текст]/ Адамов В. Г., Каира В. В.// Моделювання та керування станом екологоекономічних систем регіону. – Київ: Міжнародний науково‑навчальний центр інформаційних технологій та систем НАН України та МОН України, 3 вип., 2006. – С. 234.
- Адамов В. Г., Киселев К. И., Меркулова Е. В. Определение функционального состояния кератиноцитов с помощью компьютерной обработки изображений клеток/ [Интернет‑ресурс] – Режим доступа: http://ea.donntu.ru:8080.
