Аннотация
М. Ч. Вакили, М. Хагченас Фард. Химическая переработка полиэтилентерефталата. В данном исследовании изучена химическая переработка полиэтилентерефталата. Целью данной работы является восстановление терефталевой кислоты этиленгликоля из ПЭТ — отходов. Этот процесс подразделяется на два этапа. На первой стадии происходит реакция между ПЭТ и гидроксидом натрия для производства этиленгликоля и раствора терефталата натрия, проводится при смешивании в реакторе из нержавеющей стали. На второй стадии реакция между произведенным терефталатом натрия и соляной кислоты приводит к получению терефталевой кислоты. Были изучены такие важные характеристики, как температура, давление и количество потребляемых гидроксида натрия и соляной кислоты. Оптимальное количество гидроксида натрия и соляной кислоты было взято 50 грамм и 166 грамм на 1 кг отходов ПЭТ, соответственно рабочая температура и давление на первом этапе 180 °C и 1,5 бара.
Введение
Из-за возросшего применения пластика и полимерных материалов, особенно для одноразового использования, ежедневно производятся выбросы этих продуктов в большом объеме. Пластиковые материалы разлагаются очень долго, что приводит к загрязнению окружающей среды, поэтому необходимо переработать эти материалы и возвратить в цикл использования.
Пластмасса — это полиэтилен, полистирол, полиэтилентерефталат, полипропилен и поливинилхлорид, которые используются в упаковочной промышленности, и мы заинтересованы в том, чтобы его перерабатывать.
Один из самых важных термопластичных полиэфиров, который широко используется в производствах пленки, текстильных волокнах и в упаковочных отраслях, является полиэтилентерефталат (ПЭТ). За счет таких свойств, как высокая прозрачность, высокая механическая прочность, за счет минимальной толщины стенок, незначительной проницаемости для СО2 и относительно низкой цены, применение ПЭТ является очень важным для бытовых и коммунальных нужд. Поэтому стоит уделить больше внимания переработке отходов ПЭТ из-за их влияния на экологию и для получения ценных продуктов.
Есть два глобальных метода для переработки ПЭТ отходов: механический и химический методы. В механическом методе, как правило, использованные бутылки могут быть возвращены в цикл использования измельчением их на мелкие кусочки, нагреванием и переплавлением в новые продукты. Часто в механических методах переплавляют лом ПЭТ и смешивают с первичным ПЭТ.
Frounchi и его соавторы (1997) изучали механическую переработку ПЭТ бутылки. Они смешали вторичный ПЭТ с неиспользованным ПЭТ для того чтобы улучшить механические свойства. Они обнаружили, что механическое смешивание может быть применено для утилизации без убытка первоночального ПЭТ и сокращения материальных затрат на изготовление бутылки [1]. Verney с соавтороми (2005) смешали отходы ПЭТ с поликарбонатом (ПК) для улучшения физических свойств механически переработанного ПЭТ [2].
Navarro с соавторами (2007) изучали влияние полиэтиленовой бутылочной крышки на механическую переработку ПЭТ. Они обнаружили, что не стоит полностью отделять компоненты полиэтилена, потому что маленькие проценты ПЭ могут облегчить последующую обработку материала с помощью инъекций [3].
Химическая переработка отходов ПЭТ состоит из деполимеризации путем гидролиза, метанолиза, гликолиза и аминолиза для получения различных мономеров. Гидролиз ПЭТ в присутствии кислоты и основания, используя подходящие растворители [4].
Нейтральный гидролиз отходов ПЭТ с различным количеством воды и различными катализаторами, в присутствии ксилола, изучена Guclu и соавторами (2003) [5].
Термический гидролиз и деполимеризация ПЭТ были изучены по САО и Клойд [6]. Метанолиз ПЭТ — отходов применяется в виде мономеров, диметилтерефталата (ДМТ) и этиленгликоля (ЭГ). Kurokawa и соавторы (2003) изучали метанолиз ПЭТ в присутствии алюминия и катализатора с образованием мономеров. Они обнаружили, что используя толуол в смеси растворителей (20 об. % толуола) вместо чистого метанола позволяет добиться получения максимального выхода мономеров, 88 % для ДМТ и 87 % для (ЭГ) [7].
Genta и соавторы (2006) использовали сверхкритический метанол для ПЭТ деполимеризации вместо паров метанола. Они обнаружили, что скорость деполимеризации ПЭТ в сверхкритическом метаноле происходит быстрее, чем ПЭТ деполимеризация в парах метанола [8]. Yang с соавторами (2002) изучили влияние некоторых параметров метанолиза на ПЭТ отходы в сверхкритическом метаноле. Они обнаружили, что выход ДМТ и степень деполимеризации ПЭТ серьезно зависят от температуры, в то время как давление не оказывает никакого существенного влияния в критической точки метанола [9]. Ghaemy M. и Mossaddegh K. (2005) изучали гликолиз ПЭТ отходов, используя этиленгликоль. Они изучили некоторые параметры, такие как: время реакции, объем Е.Г., катализаторы и их концентрации в выходе гликолиза [10]. Karayannidis и соавторы (2004) использовали гликолиз ПЭТ отходов для производства алкидных смол. Они обнаружили, что механические свойства добываемой смолы сопоставимы с обычными смолами [11]. Dullius и соавторы (2006) также применили химическую переработку ПЭТ отходов в синтезе алкидных смол [12]. Shukla с соавторами (2006) использовали метод гликолиза для переработки ПЭТ отходов в полезные вспомогательные вещества. Преимущество этого метода в том, что химические вещества, используемые во время деполимеризации ПЭТ дешевы и сравнительно менее вредны для окружающей среды [13]. Аминолиз это еще один из способов химической переработки отходов ПЭТ, который был мало изучен по сравнению с другими техниками. Shukla с соавторами (2006) изучил способ для производства бис (2-окси этилена) терефталат (BHETA) по аминолизу ПЭТ — отходов. Они использовали избыток этаноламина в присутствии различных простых химических веществ, а именно, уксусной кислоты, ацетата натрия и сульфата калия в качестве катализатора. Они получили хороший выход BHETA 91 % [14]. Parra и соавторы (2004) получили высокосодержащий углеродный материал пиролизом отходов ПЭТ и последующей активацией ПЭТ [15]. Barriocanal и соавторы (2004) также изучили производства углеродных материалов из переработки ПЭТ [16].
В настоящее время гидролиз гидроксидом натрия используется для переработки ПЭТ отходов. Были изучены такие важные параметры, как, рабочая температура, давление и объем потребляемых гидроксида натрия и соляной кислоты.
Экспериментальные работы, проводились в два этапа. На первой стадии реакция между ПЭТ и гидроксидом натрия привела к следующей реакции:
PET + 2nNaOH = nNa2C8H4O4 + nC2H6O2
Этиленгликоль и терефталат натрия являются продуктами первой стадии. Терефталат натрия реагирует с соляной кислотой на второй стадии процесса согласно следующей реакции:
Na2C8H4O4 + HCl = C8H6O4 + 2NaCl
Материалы и методы
ПЭТ — используется во всех экспериментах. Перед зарядкой ПЭТ в реактор, бутылки были измельчены на куски размером, 1 мм * 1 мм до 6 мм * 6 мм. Гидроксид натрия 85 % и соляная кислота 1 моляр, были использованиы в качестве растворителя.
Десятилитровая опытная установка стального реактора высокого давления была использована для всех экспериментов. На рисунке 1 показана опытная установка. Реактор был оборудован якорным рабочим колесом для обеспечения надлежащего смешивания. Он также был оборудован рубашкой для циркуляции горячего масла вокруг, которое использовалось для нагрева содержимого реактора. Масло для передачи тепла может рециркулировать через всю систему отопления при помощи насоса.
Также реактор был оснащен конденсатором в верхней части сосуда. Паровые продукты собираются в небольшой стальной сосуд и уходят через клапан, как конечный жидкий продукт. Флегмовое число может быть изменено для достижения оптимальных условий.
Первый этап: 1 кг ПЭТ и 4 литра воды загружают в реактор. Потом 20 грамм гидроксида натрия добавляют в реактор. Вода используется в качестве растворителя для реагентов. Температура реактора была установлена на уровне 110 °C. эта температура подается циркулирующим горячим маслом в рубашке вокруг реактора. При достижении температуры до заданного значения, в интервалах 5 минут, измеряли рН раствора реактора.
Реакция будет завершена, когда рН становится постоянной величиной в базовом диапазоне.


Рисунок 1 — Экспериментальная установка для химической переработки ПЭТ
Для определения оптимальной температуры реакции, мы можем провести пересчет процентов при различных температурах.
Произведенный этиленгликоль пошел к конденсатору во время процесса и был собран в стальном резервуаре. В конце реакции, терефталат натрия выгружают из реактора, промывают и сушат.
Второй этап: на этом этапе терефталатовые соли, полученные на предыдущей стадии, реагирует с соляной кислотой, давая терефталевую кислоту. На этом шаге терефталат натрия промывают водой для удаления остатков гидроксида натрия, а затем высушивают. 453 грамм терефталата натрия, полученных на первом этапе, 166 грамм соляной кислоты и 2 литра воды загружаются в реактор. Температура устанавливается на 40 °С. рН раствора измеряли в интервалах 5 минут.
Полученная терефталевая кислота нерастворима в воде и остается в нижней части реактора. Затем промывают водой и высушивают.
Результаты и их обсуждения
На рисунке 2 показано изменение течения первой реакции от температуры. Видно, что максимальная конверсия 92 % произошла при 180 °C и повышение температуры влияет на конверсию. При этой температуре давление реакции составляет 1,5 бар. На рисунке 3 показано изменение необходимого количества гидроксида натрия в первой реакции. Из 500 грамм гидроксида натрия нужно на 1 кг ПЭТ для преобразования 92 %.
На рисунке 4 показано изменение конверсии второй реакции от температуры. Видно, что максимальная конверсия составляет около 88 % при 90 °С.На рисунке 5 показано изменение времени реакции в двух реакциях от конверсии. Из этого рисунка наглядно видно, что время реакции для преобразования 92 % составляет около 180 мин для первой реакции и 90 мин для второй реакции в 88 % конверсии.
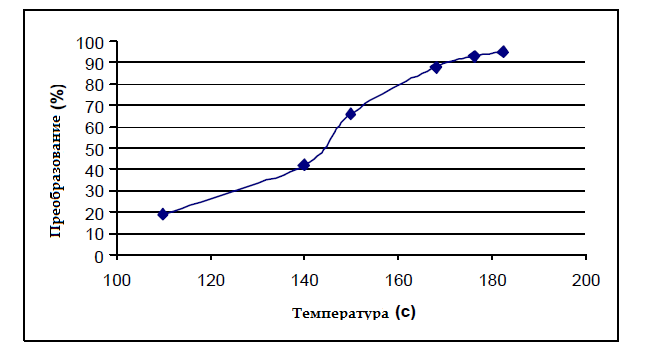
Рисунок 2 — Первая реакция с температурой изменение конверсии
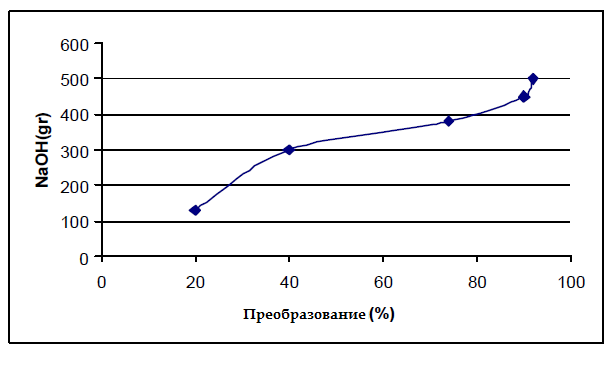
Рисунок 3 — Отклонение количества NaOH с преобразования в первой реакции
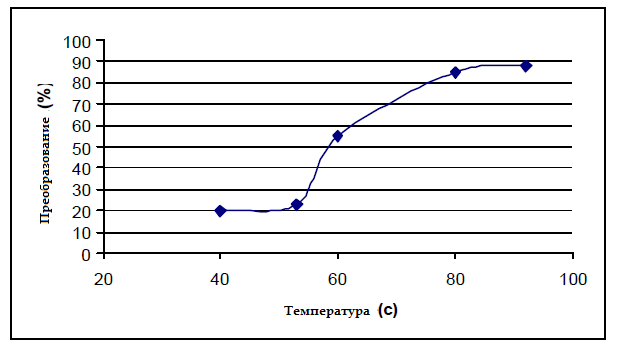
Рисунок 4 — Изменение конверсии по второй реакции с температурой
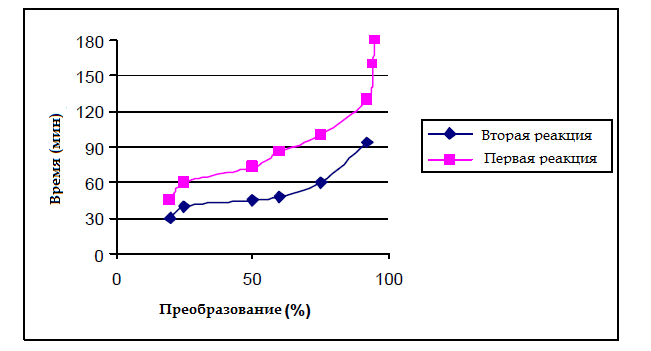
Рисунок 5 — Изменение времени реакции двух реакций
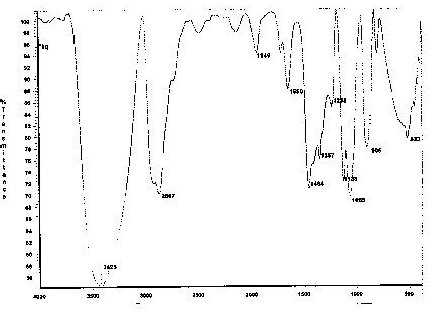
Рисунок 6 — ИК — спектр этиленгликоля, полученный от реакции между ПЭТ и гидроксида натрия
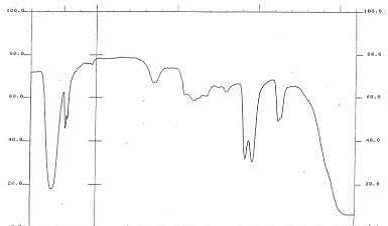
Рисунок 7 — ИК — спектр чистого этиленгликоля в качестве эталонного образца


Рисунок 8 — ИК — спектр полученной терефталевой кислоты из реакции между терефталатом натрия и соляной кислоты

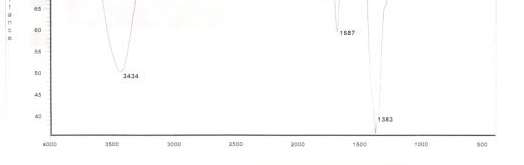
Рисунок 9 — ИК — спектр чистой терефталевой кислоты в качестве эталонного образца
На рисунке 6 и рисунке 7 показывают ИК — спектр полученного этиленгликоля из реакци между ПЭТ и гидроксидом натрия, и чистого этиленгликоля в качестве эталонного образца. Видно, что ИК — спектр этиленгликоля, полученный из реакции практически совпадает с ИК — спектром контрольного образца и алкильной группы с числом 3425, наблюдаемым на спектре. На рисунке 8 и 9 показаны ИК — спектры получения терефталевой кислоты из реакции между терефталатом натрия и соляной кислоты и чистой терефталевой кислотой в качестве эталонного образца. Из этого рисунка видно, что ИК спектр терефталеваой кислоты, полученной из реакции практически совпадает с ИК — спектром контрольного образца. В ИК — спектре показано присутствие карбоксильной группы с числом 3434, ароматических соединений с числом 1383 и карбонильной группы с числом 1687, а эти числа полученные в ИК — спектре из реакции получения терефталевой кислоты: 3432, 1393 и 1583, показывает хорошее совпадение с предоставленными данными, указывающее, что чистота продуктов при этом методе является приемлемой.
Заключение
В сравнении с другими методами химической переработки ПЭТ, можно предположить, что гидролиз ПЭТ с гидроксидом натрия — это удобный и простой процесс, а чистота получаемых продуктов является приемлемой. В этом методе использнованные ПЭТ — бутылки конвертируются в этиленгликоль и терефталат натриевой соли.
Необходимое количество гидроксида натрия для реакции с 1 кг ПЭТ было 500 граммов. Оптимальное значение температуры для реакции между ПЭТ и гидроксидом натрия 180 °С. при этой температуре конверсия реакции составила 92 %. Время реакции на этой стадии было около 180 мин. Количество производимого этиленгликоля 200 мл и полиэтилентерефталатовой соли 453 на 1 кг потребляемого ПЭТ.
Оптимальное значение температуры для реакции между терефталатом натрия и соляной кислотой 90 °C при 88 % конверсии. Время реакции на этом этапе около 90 минут и получено: 166 граммов соляной кислоты на 453 граммов терефталата натрия и 433 грамма терефталевой кислоты.
Список использованной литературы
1. Frounchi M., M. Mehrabzadeh and R. Ghiaee, 1997. Studies on Recycling of Poly(ethylene terephthalate) Beverage Bottles, Iranian Polymer J., 6: 269–272.
2. Fraisse F., V. Verney, S. Commereuc and M. Obadal, 2005. Recycling of polyethylene terephthalate) polycarbonate blends, Polymer Degradation and Stability, 90: 250–255.
3. Navarro, R., S. Ferrandiz, J. Lopez and V. J. Segui, 2007. The influence of polyethylene in the mechanical recycling of polyethylene terephthalate, J. Materials Processing Technol., pp: 1–7.
4. Mankodi, J. W., 1986. US Pat., 4: 605–762.
5. Guclu, G., T. Yalcinyuva, S. Ozgimus and M. Orbay, 2003. Hydrolysis of waste polyethylene terephthalate and characterization of products by differential s canning calorimetry, Thermochemica Acta, 404: 193–205.
6. Sao, K. S. and D. Cloyd, 1991. Kinetics of Hydrolysis and Thermal Degradation of Polyester Melts, J. Polymer Sci., 42: 845–853.
7. Kurokawa, H., M. Ohshima, K. Sugiyama and H. Miura, 2003. Methanolysis of polyethylene terephthalate (PET) in the presence of aluminum tiisopropoxide catalyst to form dimethyl terephthalate and ethylene glycol, Polymer Degradation and Stability, 79: 529–533.
8. Genta, M., T. Iwaya, M. Sasaki and M. Goto, 2007. Supercritical methanol for polyethylene terephthalate depolymerization: Observation using simulator, Waste Management, 27: 1167–1177.
9. Yang, Y., Y. Lu, H. Xiang, Y. Xu and Y. Li, 2002. Study on methanolytic depolymerization of PET with supercritical methanol for chemical recycling, Polymer Degradation and Stability, 75: 185–191.
10. Ghaemy, M. and K. Mossaddegh, 2005. Depolymerization of poly(ethylene terephthalate) fibre waste using ethylene glycol, Polymer Degradation and Stability, 90: 570–576.
11. Karayannidis, G. P., D. S. Achilias, I. D. Sideridou and D. N. Bikiaris, 2005. Alkyd resins derived from glycolized waste poly(ethylene terephthalate), European Polymer J., 41: 201–210.
12. Dulius, J., C. Ruecker, V. Oliveira, R. Ligabue and S. Einloft, 2006. Chemical recycling of post — consumer PET: alkyd resin synthesis, Progress in Organic Coating, 57: 123–157.
13. Shukla, S. R., A. M. Harad and L. S. Jawale, 2006. Recycling of waste PET into useful textile auxiliaries, Waste Management.
14. Shukla, S. R. and A. M. Harad, 2006. Aminolysis of polyethylene terephthalate waste Polymer Degradation and Stability, 91: 1850–1854.
15. Parra, J. B., C. O. Ania, A. Arenillas, F. Rubiera and J. J. Pis, 2004. High value carbon materials from PET recycling, Applied Surface Sci., 238: 304–308.
16. Barriocanal C., M. A. Diez and R. Alvarez, 2005. PET recycling for the modification of precursors in carbon materials manufacture, J. Analytical and Applied Pyrolysis, 73: 45–51.