Реферат
Цель. Целью данной статьи является изучение влияние рассеянного мерцания яркости освещения разных частот на диаметр сосуда сетчатки человеческого глаза.
Методы. В исследовании приняли участие девять здоровых субъектов. Анализатор сосудов сетчатки (RVA, Zeiss, Jena, Germany) был модифицирован, чтобы обеспечить непрерывное измерение диаметра сосуда во время стимуляции мерцания. С помощью этой технологии свет, используемый для измерения диаметра сосуда, состоит из длин волн от 567 до 587 нм, тогда как спектр стимуляции является низкочастотным с длиной волны отсечки при 550 нм. Частоты мерцания составляли от 2 до 64 Гц.
Результаты. В артериях сетчатки увеличение наблюдалось на всех частотах мерцания с менее выраженным эффектом при 64 Гц. В венах сетчатки все частоты мерцания, за исключением 2 и 64 Гц, вызывали вазодилатацию. Как правило, ответная реакция на мерцание была менее выраженной в венах, чем в артериях сетчатки.
Выводы. Отклики, вызванные мерцанием диаметра больших артерий сетчатки и вен, могут непрерывно измеряться с помощью модифицированной системы RVA, которая спектрально отделяет стимуляцию мерцания от света освещения дна. Вазодилатация артерий сетчатки наблюдалась в ответ на короткое волновое мерцание с частотами от 2 до 64 Гц, что указывает на то, что парво- и магноцеллюлярные нейронные пути активируются этой стимуляцией.
В своей классической статье, опубликованной более 100 лет назад, Рой и Шеррингтон [1] предположили, что мозг обладает внутренним механизмом, благодаря которому его сосудистое питание может варьироваться локально в соответствии с локальными вариациями функциональной активности. Используя различные методы измерения регионального церебрального кровотока, такие как лазерная доплеровская флоуметрия, транскраниальная допплер-сонография и позитронно-эмиссионная томография, исследователи с тех пор хорошо подтвердили эту гипотезу [2]. Доказано, что такой механизм также действует в головке зрительного нерва (ONH) и сетчатке у кошек [3], [4], [5], приматов [6], и человека [7], [8].
Поскольку ретинальный кровоток (RBF) в основном сосуде сетчатки равен значению PiD2V / 4, где D - диаметр сосуда, а V означает среднюю скорость крови, двукратное увеличение V приводит к двукратному увеличению RBF, тогда как двукратное увеличение D приводит к четырехкратному увеличению RBF. Это подчеркивает важность измерения точных изменений в диаметра сосуда при попытке обнаружить изменения RBF в ответ на стимул.
Наиболее благоприятными участками в сосудистом ложе для обнаружения изменения диаметра являются артериолы, у которых он ниже приблизительно 20 мкм, потому что эти сосуды являются основными участками устойчивости к течению в отсутствие предкапиллярных сфинктеров. Однако количественная оценка изменений диаметра в этих сосудах затруднена из-за ограниченных возможностей существующих методов. Напротив, изменения менее 3% в диаметрах больших артерий сетчатки обычно обнаруживаются. Хотя они не составляют основной компонент сосудистого сопротивления, эти артерии, как известно, проявляют вазореактивность в ответ на различные физиологические стимулы [9], [10].
Предыдущие методы исследования реакции диаметра сосудов и ретинального кровотока на мерцание у людей не позволяли оценивать эти параметры во время мерцания [7], [8], но измеряли их реакцию после прекращения мерцания. Мы приступили к разработке метода, который позволяет выполнять онлайн-регистрацию изменений в диаметре сосудов во время мерцания. С этой целью мы модифицировали коммерчески доступную систему для измерения диаметра сосудов сетчатки у людей и исследовали вызванное мерцанием изменение этой величины на различных частотах мерцания.
Методы
Объекты. Исследование проводилось в соответствии с руководящими принципами, изложенными в Хельсинкской декларации. Участвовали семь мужчин и две женщины (средний возраст, 34 ± 11 лет). После объяснения характера исследования было получено письменное согласие от всех участников. Всех испытуемых попросили воздержаться от употребления алкоголя и кофеина в течение как минимум 4 часов до начала испытания. У них не было истории окулярной болезни или эпилепсии и ошибки рефракции менее 3 диоптрий. Среднее артериальное давление варьировалось от 85 до 100 мм рт.
Протокол исследования.Измерения диаметра сосудов производились непрерывно на протяжении 3 минут в течение каждого эксперимента. Симуляция мерцания была запланирована с 60 по 120 секунду. Чтобы исследовать изменение диаметра, вызванное мерцанием, которое было получено с помощью нашей экспериментальной установки, было проведено пять экспериментов в течение 30 минут с симуляцией мерцания на частоте 8 Гц. Из этих экспериментов был рассчитан коэффициент изменения величины D.
Протокол повторяли восемь раз, каждый на другой частоте, с интервалом времени между двумя экспериментами по стимуляции мерцания не менее 3 минут. Измерения с использованием частоты мерцания 4, 8, 16, 24 и 32 Гц выполнялись в обоих глазах у восьми субъектов и в одном глазу у одного субъекта. Измерения с 40 и 64 Гц выполнялись как в глазах шести субъектов, так и в одном глазу у двух субъектов, тогда как измерения с 2 Гц выполнялись в обоих глазах у четырех субъектов и в одном глазу у четырех других субъектов. Диаметр измеряли на стволе нижних или верхних временных артерий сетчатки и вен, ближних к бифуркации их первых основных ветвей.
Дополнительные измерения диаметра проводились в автономном режиме с использованием видеозаписей экспериментов с 8 и 16 Гц для изучения региональных различий в реакции величины D. Мы снова измерили диаметр нижних или верхних временных артерий сетчатки и вен. Одно измерительное окно было расположено на стволе этих сосудов в пределах одного диаметра оптического диска. Другое окно было помещено на тот же ствол на расстоянии между одним и двумя диаметрами диска от оптического диска. Наконец, мы измерили диаметр артериальных и венозных ветвей, которые возникли вдали от описанных точек дна.
Анализатор сосудов сетчатки (Retinal Vessel Analyzer)
RVA включает фундус-камеру (поле 50°, model FF 450, Zeiss, Jena, Germany), видеокамеру, монитор в режиме реального времени и компьютер с программным обеспечением для анализа изображений для точного определения артериального и венозного диаметра сетчатки [11].
Диаметр ретинального сосуда анализировался в реальном времени с максимальной частотой 40 Гц так, что каждую секунду можно получить максимум 25 показаний диаметра сосуда. С этой целью глазное дно изображают на чипе с зарядовой связью (CCD) видеокамеры. Последовательные изображения дна оцифровывались с помощью захвата кадров. Оценка диаметра венозной сетчатки проводилась в режиме онлайн, а оценка артериального диаметра проводилась в автономном режиме с записанных видеокассет.
Из-за абсорбционных свойств гемоглобина каждый кровеносный сосуд имеет специфический профиль пропускания. Измерение диаметра сосудов сетчатки основано на адаптивных алгоритмах, которые используют эти конкретные профили. Когда распознается конкретный профиль сосуда, анализатор сосудов сетчатки может следовать за этим сосудом, пока он появляется в окне измерения. Это означает, что система может автоматически корректировать изменения яркости, вызванные, например, небольшим движением глаз. Если требования к оценке диаметра не выполняются временно, как это происходит во время моргания, система автоматически останавливает измерение диаметра. Как только снова будет получено адекватное изображение дна, измерение перезапустится автоматически.
Чтобы выбрать интересующую область, прямоугольник, который включает конкретный сосуд, можно определить на экране монитора в реальном времени. Диаметр затем вычисляется вдоль артериального или венозного сегмента, который лежит внутри прямоугольника. Пока исследуемые сосуды находятся в пределах выбранного прямоугольника во время движений глаз, система автоматически корректирует их движения. Это также обеспечивается адаптивным характером программного обеспечения D-анализа. Мы показали, что эта система обеспечивает высокую воспроизводимость и чувствительность ответа диаметра сосудов к фармакологической стимуляции.
Симуляция мерцания
Фликер генерировался путем фокусировки света от системы ксеноновой лампы мощностью 150 Вт (Oriel, Stratford, CT) на секторном диске. Перед лампой был установлен фильтр нижних частот с отсечкой при 550 нм (Laser Components, Olching, Germany). Свет, проходящий через диск, попадал на волоконно-оптический кабель, расположенный за диском. Свет на выходе кабеля был введен в канал освещения фундус-камеры. Среднее облучение сетчатки стимуляции составляло приблизительно 150 Вт / см2.
Чтобы спектрально отделять мерцающий свет от света, используемого для освещения глазного дна и измерения диаметра сетчатки, перед источником света был помещен интерференционный фильтр с центральной длиной волны 577 нм и шириной полосы на половине высоты 10 нм (компоненты лазера) фундус-камеры. Это спектральное окно между 567 и 587 нм было выбрано для оптимизации контраста между кровеносными сосудами и окружающими тканями. Облученность сетчатки глазного дна было примерно 220 Вт / см2.
Во время стимуляции субъект воспринимал сине-зеленое/желтое мерцание, потому что свет на выходе сектора диска чередовался между сине-зеленым светом и его отсутствием, а непрерывная подсветка на заднем фоне выглядела желтоватой (567-587 нм). Чтобы увеличить восприятие мерцания, 50-градусное поле освещенности фундус-камеры было уменьшено до 30° посредством помещения кольцевой диафрагмы в плоскость сетчатки фундус-камеры, которая лежит за офтальмоскопической линзой. Эта диафрагма была прозрачной для мерцающего света, но непрозрачна для освещения подсветки глазного дна. В результате, мерцающий свет, который был доставлен в 50-градусное поле, в основном воспринимался на периферии поля (30-50°). Интерференционный фильтр, который точно соответствовал спектру непрерывной подсветки дна и, следовательно, был непрозрачным для света мерцания, помещался перед CCD.
Аналих данных
Изменения, вызванные фликером в диаметре сосудов, были выражены как процентное изменение от базового значения диаметра (без мерцания). Среднее за последние 30 секунд записи значение величины D во время базовой линии считалось базовой линией диаметра. Под воздействием мерцаний значение диаметра усреднялось в течение периодов длительностью 10 секунд. Среднее значение за последние 20 секунд мерцания использовалось для вычисления процентного изменения в диаметре относительно базовой линии. Корреляции между данными, вызванными мерцанием D-ответами между левым и правым глазом и между изменением диаметра и начальным значением диаметра, были проанализированы с помощью корреляции момента-продукта Пирсона. Статистическую значимость изменений величины диаметра сосудов оценивали с помощью повторных измерений ANOVA и парных t-тестов для специального пост-анализа. Двухсторонний P <0,05 считался статистически значимым.
Результаты
Повторяемая стимуляция мерцанием при частоте 8 Гц приводила к средней реакции в венозном диаметре в размере 2,1%. Коэффициент вариации изменения диаметра для пяти испытаний составил 25%. Наглядное представление изменения диаметра, вызванного реакцией на мерцание в артерии сетчатки, показан далее на рисунке 1.
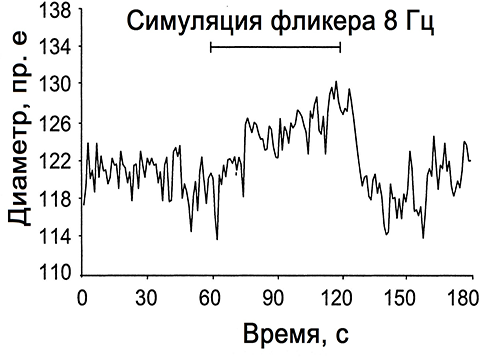
Рисунок 1 - Пример изменения диаметра артерии сетчатки глаза человека
Изменение диаметра сосудов в левом и правом глазах
В артериях изменение диаметра в правом и левом глазах не коррелировали с частотой мерцания между 4 и 64 Гц. Напротив, значительная корреляция была обнаружена при частоте в 2 Гц (r=0,99, P=0,006). Однако в венах сетчатки изменения диаметра в правом и левом глазах отрицательно коррелировали при 4 Гц (r=-0,92, P=0,002) и 40 Гц (r=-0,87, P=0,03). На других частотах взаимосвязи обнаружено не было.
Влияние частоты мерцания на вызванное фликером изменение диаметра
Стимуляция фликером значительно увеличивалась в артериях и венах с каждой последующей применяемой частотой (Таблица 1). Мерцание при 64 Гц вызывало значительно меньшее изменение диаметра в артерии сетчатки, чем другие частоты (P = 0,0072). На рис. 2 частотная зависимость реакции диаметра в артериях изображена в двойном логарифмическом масштабе. В сетчатых венах стимулы мерцающего света на всех частотах, кроме 2 и 64 Гц, значительно увеличивали изменение диаметра сосудов (табл. 1). Увеличение диаметра, вызванное мерцанием, было сопоставлено с остальными проверенными частотами (P = 0,16). Изменение величины диаметра вен сетчатки в зависимости от частоты также показано на рис. 2.
| Частота, Гц | Исходное значение диаметра, пр.е | Значение диаметра после 20-секундного воздействия фликером, пр.е | P |
|---|---|---|---|
| Артерии | |||
| 2 (n=12) | 118±16 | 121±16 | <0,0002 |
| 4 (n=17) | 119±17 | 124±16 | <0,0001 | 8 (n=17) | 120±16 | 124±16 | <0,00001 |
| 16 (n=17) | 119±16 | 121±17 | <0,0002 |
| 24 (n=17) | 120±16 | 124±17 | <0,0005 |
| 32 (n=17) | 121±16 | 125±15 | <0,0003 |
| 40 (n=14) | 117±15 | 119±15 | 0,003 |
| 64 (n=14) | 117±14 | 118±14 | <0,05 |
| Вены | |||
| 2 (n=12) | 153±19 | 154±20 | нс |
| 4 (n=17) | 148±19 | 151±20 | <0,001 | 8 (n=17) | 150±21 | 153±20 | <0,0002 |
| 16 (n=17) | 149±18 | 151±19 | <0,002 |
| 24 (n=17) | 150±20 | 151±20 | <0,03 |
| 32 (n=17) | 151±19 | 153±20 | <0,003 |
| 40 (n=14) | 151±20 | 153±20 | <0,01 |
| 64 (n=14) | 151±18 | 151±18 | нс |
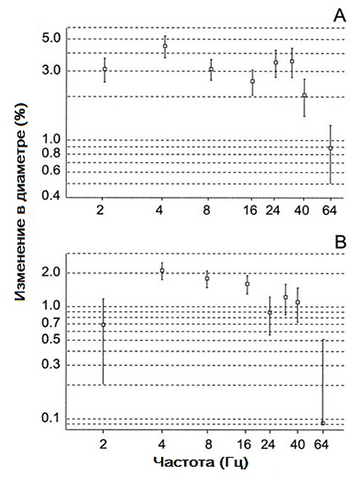
Рисунок 2 - Зависимость среднего (± SD) диаметра сосудов сетчатки от частоты стимулов
На рисунке 2: (A) Артерии; (В) вены. Количество измеренных сосудов при 2 Гц: n = 12; при 4, 8, 16 и 32 Гц: n = 17; и при 40 и 64 Гц: n = 14.
Процесс изменения величины диаметра во время воздействия мерцающим светом
Изменения диаметра артерий и вен сетчатки, вызванные стимуляцией мерцающим светом, представлены для всех примененных частот на рис. 3. В процессе изменения диаметр всегда увеличивался, что в большинстве случаев происходило в течение первых 20 секунд опыта. После этого он оставался почти стабильным в течение следующих 40 секунд. Реакция диаметра в венах была менее выраженной, чем в артериях (Р <0,001). Однако время изменения артериального диаметра во время мерцания было сопоставимо со временем изменения этой же величины вен.
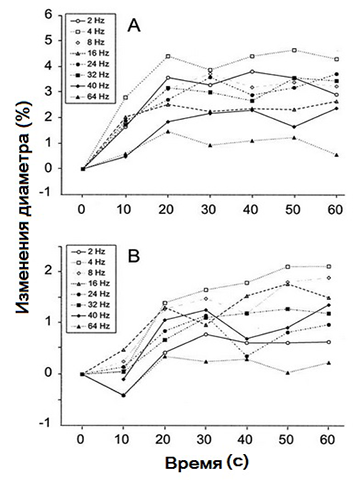
Рисунок 3 - Средний артериальный (A) и венозный (B) диаметры сетчатки в течение 60 секунд воздействия фликером
На рисунке 3: Количество измеренных сосудов: 2 Гц: n = 12; при 4, 8, 16 и 32 Гц: n = 17; и при 40 и 64 Гц: n = 14.
Изменение диаметра после прекращения воздействия фликера
В большинстве случаев после прекращения воздействия мерцающего света наблюдалось уменьшение величины диаметра. Аппроксимация, полученная при помощи отдельной зависимости диаметра от времени, показана на рис. 4. Это приближение было основано на экспоненциальном разложении с линейной компонентой. Указан диаметр в начале, в течение последних 20 секунд мерцания и на локальном минимуме. Кроме того, показан промежуток времени от прекращения мерцания до минимального значения величины D. В 96 из 119 индивидуальных измерений в артериях и в 69 из 119 отдельных измерений в венах был обнаружен минимум этой величины. В других случаях диаметр вернулся к исходному уровню, но не было видно наблюдавшегося ранее чрезмерного его уменьшения. Минимальное значение диаметра после прекращения воздействия фликера наблюдалось через 10-40 секунд.
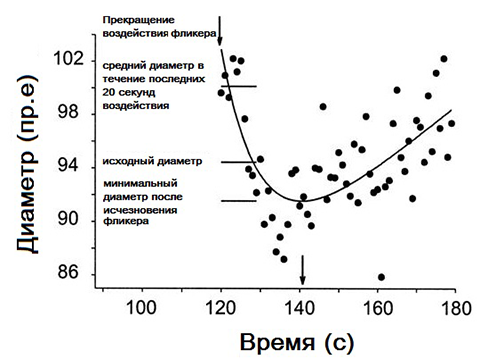
Рисунок 4 - Примерное измерение уменьшения диаметра сосуда сетчатки, наблюдаемое после прекращения мерцания у одного субъекта (частота мерцания, 8 Гц).
Реакция диаметра и расположение глазного дна
Эффект от стимуляции фликером при частоте 8 и 16 Гц в разных местах дна показан в табл. 2. Опять же, увеличение диаметра было более выраженным в артериях сетчатки, чем в венах. В артериях сетчатки изменения диаметра в стволе и ветви сосуда были сопоставимы (8 Гц: P = 0,96, 16 Гц: P = 0,35). В ретинальных венах изменение в ответвлениях было выше, но этот эффект был незначительным (8 Гц: P = 0,15; 16 Гц: P = 0,62). Отрицательная корреляция наблюдалась между исходным уровнем диаметра и его реакцией на воздействие фликера на частоте 8 Гц в венах (r = -0,497, P <0,0001), но не в артериях (P = 0,4), как показано на рис. 5. Однако корреляция между исходным уровнем величины D и его изменением на стимуляцию мерцающим светом на частоте 16 Гц в артериях и венах не наблюдалась.
| Расположение(число сосудов) | Изменение по сравнению с исходным значением при 8 Гц, % | P | Изменение по сравнению с исходным значением при 16 Гц, % | P |
|---|---|---|---|---|
| Артерии | ||||
| 2 Магистральная проксимальная (n=17) | 3,5±2,3 | <0,00005 | 2,7±2,0 | <0,0001 |
| Магистральная периферическая(n=17) | 3,5±2,4 | <0,00002 | 1,9±1,5 | <0,0001 | Ветвь (n=17) | 3,3±2,4 | <0,00006 | 1,7±2,7 | <0,02 |
| Вены | ||||
| Магистральная проксимальная (n=17) | 1,9±1,2 | <0,000019 | 1,8±1,1 | <0,00005 |
| Магистральная периферическая(n=17) | 1,8±1,6 | <0,0003 | 1,1±0,8 | <0,02 | Ветвь (n=17) | 2,9±2,2 | <0,0002 | 1,4±2,8 | нс |
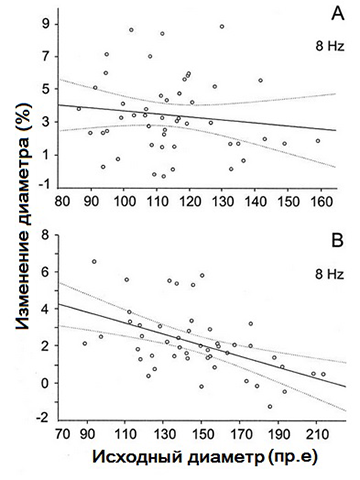
Рисунок 5 - Зависимость между исходным диаметром артерий (A) и вен (B) сетчатки от вызванного фликером его изменения
Изменение диаметра было рассчитано на основе последних 20 секунд воздействия фликера. Сплошная линия на рис. 5 ? корреляция; пунктирные линии ? 95% доверительный интервал. 51 точка данных соответствует реакциям, полученным по трем участкам глазного дна 17 глаз.
Обсуждение
В настоящем исследовании был использован новый метод измерения диаметра сосуда сетчатки во время стимуляции мерцающим освещением. Было предпринято несколько попыток исследовать изменение кровотока в сетчатке во время стимуляции нейронов у людей. В одном из этих исследований использовался метод энтоптической терапии голубого поля, и у здоровых добровольцев наблюдалось повышение потока белых кровяных клеток сетчатки в ответ на стимуляцию фликером. Тем не менее, мерцающий свет предотвращает видимость лейкоцитов, и поэтому сетчатый макулярный поток крови не может быть определен количественно во время стимуляции. В другом исследовании диаметр измеряли при помощи фоновых снимков, сделанных сразу после прекращения мерцания, для оценки изменения диаметра в ответ на мерцание [8].
Из этих измерений было обнаружено, что во время мерцания диаметр увеличивается. В отличие от исследования, приведенного в [8], в этой статье описаны измерения диаметра во время мерцания. Реакция величины D в артериях была более выраженной, чем в венах, что указывает на то, что артериальный слой играет важную роль в снижении резистентности сосудов сетчатки во время мерцания. Однако изменение диаметра не зависит от его базовой величины. Хотя у нас нет данных о небольших артериолах (<40 мкм) или капиллярах, наши результаты показывают, что во всех сосудах сетчатки во время стимуляции происходит увеличение диаметра. Предполагая, что большая часть реакции сетчатки на мерцание происходит внутри небольших артериол, можно ожидать, что скорость крови в артериях сетчатки и вен значительно возрастет. Двунаправленная лазерная допплеровская скорость (BLDV) или Heidelberg Retinal Flowmeter Laser Doppler Flowmetry [13], [14] в принципе может показать это увеличение. Однако BLDV требует отличной фиксации мишени, чего может быть трудно достичь во время стимуляции фликером. Также еще предстоит изучить применимость HRF для измерения изменений в кровотоке сетчатки при стимуляции мерцанием. Напротив, метод на основе RVA является привлекательным из-за его высокой воспроизводимости и его применимости у пациентов с сосудистыми заболеваниями глаза. В головке зрительного нерва измерения изменений кровотока, вызванные фликером, были получены с использованием лазерной доплеровской флоуметрии [14], [16], но этот метод в настоящее время в сетчатке не используется.
Общее отсутствие корреляции в изменении диаметра, вызванном мерцанием, между правым и левым глазами, позволило нам рассматривать результаты для каждого глаза как статистически независимые. Локальная изменчивость величины диаметра может быть вызвана местными регуляторными механизмами в сосудах сетчатки, но может также зависеть от конкретной ангиоархитектуры. Тем не менее, во всех отобранных сегментах сосудов наблюдалась явная флуоресцентная вазодилатация, предполагая, что в клинических исследованиях выбор фундус-селекции сегмента не очень важен.
Следует упомянуть две важные характеристики установки на основе RVA. Во-первых, из-за высокого уровня освещенности, необходимого для измерения диаметра сосудов, контраст мерцания был низким. Во-вторых, из-за того, что глазное дно и мерцающее освещение были спектрально разделены, воспринимаемый фликер был смесью яркости и хроматического мерцания. Эта последняя особенность важна для понимания частотной характеристики вызванной фликером вазодилатации, поскольку, как было предложено предыдущими выводами у кошек и людей, [16] [17] ожидается, что изменение диаметра будет, среди прочих переменных, зависеть от яркости, длины волны, и глубины модуляции стимула, а также средней освещенности сетчатки и расположение ствола. В настоящем исследовании изменение диаметра, по сравнению с частотой фликера, отображало характеристики полосовой функции с широким диапазоном между 4 и 40 Гц. Из электрофизиологических исследований хорошо известно, что максимальная чувствительность зрительной системы человека находится на частотах между 10 и 20 Гц для мерцания яркости, тогда как чувствительность к равномерной хроматической модуляции достигает своего максимума на гораздо более низких частотах (<5 Гц) , [18], [19], [20].
Таким образом, сходство между этими электрофизиологическими данными и изменением диаметра сосудов по сравнению с временной частотой особенно подчеркивает вклад как яркости, так и цветности в соответствии с конкретными характеристиками освещения нашей установки на основе RVA. Это говорит о том, что стимулируются как парво-, так и магноцеллюлярные пути. Хотя наш метод не подходит для исследования либо чистых яркостных, либо чистых хроматических изменений диаметра, вызванных фликером, тем не менее он может стать новым инструментом в исследовании сосудистых реакций при глаукоме. Электрофизиологические исследования у пациентов с ранней глаукомой продемонстрировали, что это заболевание влияет на функциональный ответ на оба типа стимуляции мерцанием [21], предполагая, что в этом заболевании влияют как магноцеллюлярный, так и парвоцеллюлярный слои ганглиозных клеток. Более того, характеристики наших раздражителей особенно актуальны при изучении глаукомы, поскольку компьютерная периметрия [22], [23] выявила изменение сине-желтой системы на ранней стадии этого заболевания.
Важным открытием настоящего исследования является временной ход изменений в диаметре сосудов во время стимуляции фликером. Примерно через 20 секунд после начала опыта обычно наблюдался устойчивый ответ. После прекращения мерцания происходило быстрое уменьшение диаметра, которое достигало базового уровня примерно через 6 секунд, что согласуется с предыдущими результатами. Однако наши измерения также показывают, что диаметр продолжает снижаться ниже базовой линии, достигая минимума примерно через 10-40 секунд после прекращения стимула. Причина этого недостатка заслуживает дальнейшего изучения.
На основании фотографий, сделанных в течение первых 6 секунд после стимуляции фликером, в [8]сообщается о среднем изменении диаметра сосудов на 4,2%. Ввиду быстрого уменьшения величины диаметра, о котором сообщается в текущем исследовании, вполне вероятно, что это значение занижает фактическую величину изменения диаметра во время мерцания. В настоящем исследовании средний D-ответ, измеренный во время воздействия фликером, был даже меньше, чем 4,2%. Это может быть связано с относительно низким контрастом мерцания, воспринимаемым системой RVA, поскольку в методе RVA стимуляция мерцания накладывается на свет яркого освещения (свет, необходимый для измерения диаметра), тогда как в методе [8], контраст стимула был почти равен 1. Однако, хотя наша установка на основе RVA вызвала меньшее изменение диаметра, она позволила точно записать течение этого ответа во времени, что может представлять интерес для исследования различных сосудистых изменений сетчатки.
Механизм, лежащий в основе увеличения изменения диаметра сосудов сетчатки и, по-видимому, увеличения кровотока сетчатки еще предстоит выяснить. В ряде исследований были выявлены факторы, связанные с модуляцией сосудистого тонуса при повышенной нейронной активности. Исследована предполагаемая роль различных веществ в вазодилатации, вызванных повышенной активностью сетчатки, таких как ионы K+[24], оксида азота [5],[25], циркулирующие гормоны и другие [4], но нельзя исключать также и другие факторы, способствующие этому. Дальнейшее понимание механизмов, лежащих в основе индуцированной фликером вазодилатации, может быть получено, когда будет более подробно проанализировано избыточное уменьшение диаметра сосудов, который обычно наблюдался после прекращения воздействия мерцающим светом. Для этой цели необходимы более длительные периоды наблюдения после прекращения мерцания.
В настоящем исследовании квадратно-волновое мерцание вызвало изменение величины диаметра сосудов. Однако кровообращение сетчатки также реагирует на синусоидальное мерцание, последовательность вспышек (например, генерируемые травяным световым стимулятором, Grass Instruments, Quincy, MA) и красно-зеленым хроматическим мерцанием. Дальнейшие исследования, таким образом, попытаются оптимизировать D-ответ путем изменения параметров (средняя яркость, контраст, частота и длина волны) различных типов воздействия.
В заключение был предложен новый метод для регистрации вазодилатации диаметра сосуда, вызванного мерцанием, и зависимости этого процесса от частоты мерцания для смешанного ярко-хроматического воздействия. Предполагается, что ответ диаметра с частотой мерцания обусловлен активацией как магно-, так и парвоклеточного слоев ганглиозных клеток.
При поддержке проекта 32-53785 от Швейцарского национального научного фонда и проекта P14262 от Австрийского фонда содействия научным исследованиям.
Представлено для публикации 15 января 2002 года; пересмотрен 22 марта 2002 года; принята 29 марта 2002 года.
Политика коммерческих отношений: N.
Расходы на публикацию этой статьи частично покрывались оплатой за подписку. Поэтому эта статья должна быть помечена как «реклама» в соответствии с 18 U.S.C. §1734 исключительно для указания этого факта.
Корреспондент: Чарльз Э. Рива, Институт Исследований по офтальмологии, Av. Grand Champsec 64, CP 4168, CH-1950 Sion 4, Switzerland; charles.riva@iro.vsnet.ch.
Перечень ссылок