Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность темы
- 2. Цель и задачи исследования, планируемые результаты
- 3. Обзор литературных источников
- 3.1 Получение кислорода из пероксидных соединений
- 3.2 Пероксид натрия Na2O2
- 3.3 Реакции пероксида натрия и супероксида натрия с оксидами
- 3.4 Перхлораты
- Выводы
- Список источников
Введение
Трудно представить себе область существования или практической деятельности человека без потребления кислорода. Ведущими компаниями, занимающимися производством кислорода, проводятся интенсивные поиски новых способов получения О2, число которых приближается к двадцати[1].
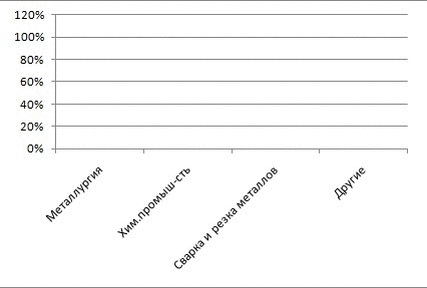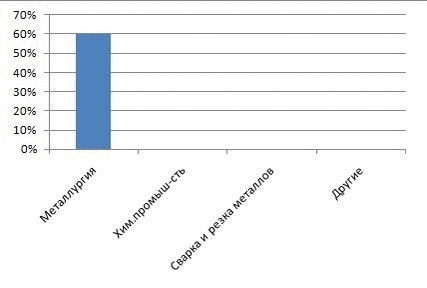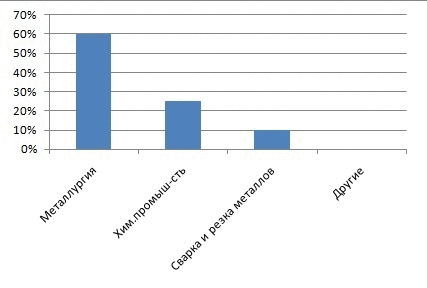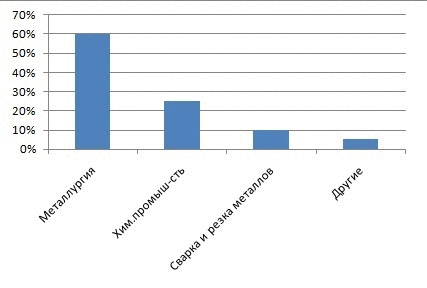
Рисунок 1 – Доля кислорода на различные виды промышленности
(анимация: 5 кадров, постоянно повторяется 72,5 кб)
Главными потребителями кислорода, конечно, являются энергетика, металлургия и химическая промышленность. Электрические и тепловые станции, работающие на угле, нефти или природном газе используют атмосферный кислород для сжигания топлива. Для металлургической и химической промышленности нужен уже не атмосферный, а чистый кислород. Ежегодно во всем мире получают свыше 80 млн. тонн кислорода. Для его производства требуется огромное количество электроэнергии, получение которой, тоже связано с расходованием кислорода. Чистый кислород расходуется главным образом на получение стали из чугуна и металлолома[1]. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь. Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди, никеля, свинца и др.). Кислород используют при резке и сварке металлов. При этом применяют баллонный
кислород. В баллоне кислород может находиться под давлением до 15 МПа[2]. Баллоны с кислородом окрашены в голубой цвет. Применение кислорода для решения экологических проблем, связанных с очисткой сточных вод и с уничтожением опасных отходов.
Известно более десяти способов получения О2. При этом выделяются две группы процессов: классические, открытые к началу ХХ века, и новые, разрабатываемые с шестидесятых годов (табл. 1).
| Классические | |
|---|---|
| 1. Термическое разложение 2. Электролиз воды 3. Каталитическое разложение пероксида водорода | 4. Гидролиз перекисных соединений 5. Термохимическое выделение из воздуха 6. Криогенное выделение из воздуха |
| Новые | |
| 7. Термохимическое разложение составов 8. Абсорбция из воздуха растворителями 9. Адсорбционное выделение из воздуха 10. Выделение из воздуха в мембранных аппаратах 11. Электрохимическое выделение из воздуха | 12. Разложение воды в термохимическом цикле 13. Магнитное выделение из воздуха 14. Фотохимическое разложение воды 15. Радиолиз воды 16. Радиочастотное разложение воды 17. Резонансное разложение воды |
1. Актуальность темы
На сегодняшний день, по мнению большинства экспертов, теоретических и технологических революционных изменений в классических способах получение кислорода в ближайшем будущем не предвидится. Поэтому новые методы получения кислорода приобретают все большую актуальность. Особое значение имеет способ получения кислорода методом термохимического разложения специально разработанных твердофазных химических композиций. Кислород в химически связанном состоянии позволяет создать системы сочетающие преимущества как баллонного хранения: простоту, высокую надежность, постоянную готовность к работе, отсутствие потерь, так и хранения при криогенных параметрах: высокие удельные и объемные характеристики. Для реализации преимуществ химические источники О2 должны удовлетворять ряду основных, порой противоречивых, требований: легкость получения О2;устойчивость при хранении;высокая чистота получаемого кислорода;безопасность и надежность в эксплуатации;выделение большого количества кислорода из единицы объема химического источника кислорода.Этим требованиям удовлетворяют две группы веществ: хлораты и перхлораты щелочных и щелочноземельных металлов; пероксиды, супероксиды и озониды металлов.
2. Цель и задачи исследования, планируемые результаты
Целью исследования является получения кислорода путем каталитического разложения хлората натрия и выбора эффективного катализатора.
В работе поставлены следующие задачи:
- Провести анализ литературных данных по свойствам хлораты и перхлораты щелочных и щелочноземельных металлов.
- Провести анализ литературных данных по свойствам пероксидных соединений на удельное содержание кислорода, способности образовывать устойчивые супероксиды.
- Проанализировать взаимодействие пероксидных соединений натрия с хлоратами и перхлоратами металлов.
- Исследовать эффективность использования реакций простых веществ с пероксидными соединениями натрия.
3. Обзор литературных источников
3.1 Получение кислорода из пероксидных соединений
Интерес к пероксидным соединениям продиктован двумя обстоятельствами: многообразием видов, которые приобретает кислород, соединяясь с различными элементами при образовании того или иного пероксидного соединения, и возможностью использования этого многообразия во всех случаях, когда необходимо иметь источник химически связанного и легко выделяемого О2.
Из пероксидных соединений по удельному содержанию кислорода наибольший интерес представляют пероксиды лития, натрия, кальция и магния. Вместе с тем, по содержанию кислорода в единице объема они, в целом, уступают пероксидам более тяжелых металлов (Sr, Ba, Zn, Cd). Щелочные металлы (кроме лития) способны образовывать устойчивые, в отличие от тяжелых металлов, супероксиды. Наилучшими характеристиками, как видно, обладает супероксид натрия.
3.2 Пероксид натрия Na2O2
Пероксид натрия Na2O2 – одно из пероксидных соединений натрия, характеризующееся наличием молекулярного иона O22–; содержание активного кислорода составляет 20,5 вес %. Чистый натрия пероксид – белый порошок; технический порошок имеет слабожелтую окраску, обусловленную примесью надпероксида натрия NaO2. Решетка Na2O2 гексагональная (искаженная); плотность 2,60. Существует в трех модификациях: Q – Na2O2, устойчива при температуре жидкого воздуха, Na2O2 (I), устойчива до 512±10С и Na2O2 (II), устойчива выше этой температуры. Пероксид натрия диомагнитен.

Рисунок 2 – Пероксид натрия
При нагревании пероксида натрия при 311–4000С наблюдается некоторая потеря активного кислорода, бурное разложение начинается при 5400С. Плавится пероксид натрия выше 5960С и полностью отдает свой активный кислород при 6750С.Растворяется в воде. При этом образуются NaOH, H2O2 и выделяется некоторое количество кислорода, т.к. щелочная среда и повышенная температура способствуют разложению H2O2.С разбавленными кислотами пероксид натрия реагирует с образованием соответствующих солей и пероксида водорода. Энергично реагирует с кислородом, серой, натрием, моно- и диоксидом углерода. Известны молекулярные соединения пероксида натрия с водой (октагидрат Na2O2x8H2O), с пероксидом водорода (дипероксигидрат Na2O2x2H2O2) и с водой и пероксидом водорода (тетрагидрат дипероксигидрата Na2O2x2H2O2x4H2O).С влагой и углекислым газом воздуха пероксид натрия реагирует с образованием NaOH, Na2CO3 и с выделением кислорода. На этом основано его применение для регенерации воздуха в закрытых помещениях[4].
Пероксид натрия получают окислением расплавленного на противнях металлического натрия в противотоке очищенного от CO2 и высушенного воздуха или форсуночных аппаратах. Для получения высококачественного пероксида натрия рекомендуется восстанавливать пероксид натрия, полученный окислением металла, до окиси путем нагревания при 130–2000С с небольшими порциями металлического натрия в инертной атмосфере, увлажненной парами воды, а полученный таким образом оксид окислять до пероксида во вращающихся печах при 250–4000С. Полученный продукт содержит 96–98% Na2O2. Поскольку пероксид натрия весьма агрессивен по отношению к металлам, при его получении пользуются обычно реакторами из никелевых сплавов, покрытых графитом, и мешалками из циркония.
В герметически закрытой таре пероксид натрия не подвержен разложению даже при продолжительном хранении. Сосуды с пероксидом натрия следует хранить в прохладном месте, вдалеке от воспламеняющихся материалов. Сам по себе пероксид натрия не воспламеняется, но огнеопасен при соприкосновении с органическими веществами, например деревом, маслом, бумагой или восстановителями в присутствии влаги [5].
Применение пероксида натрия в последних случаях основано на процесс взаимодействия между пероксидом и двуокисью углерода:
Выдыхаемый легкими углекислый газ поглощается с одновременным выделением газообразного кислорода. Последний снова может служить для дыхания [3].
3.3 Реакции пероксида натрия и супероксида натрия с оксидами
Взаимодействие пероксидных соединений натрия с оксидами представляет интерес, по крайней мере, по двум причинам. Во-первых, Na2O2 и NaO2 являются наиболее распространенными после KO2 компонентами смесей, используемых для регенерации воздуха в замкнутых объемах или изолирующих дыхательных аппаратах . Теоретически 1 кг Na2O2 способен выделить 143 литра О2 и поглотить 287 л СО2, а NaO2 соответственно 305 л О2 и 203 л СО2 . Этим обусловлен интерес к реакциям взаимодействия пероксидных соединений с Н2О, водяным паром и другими газообразными оксидами – СО, NO, NO2, SO2 и т.д. Во-вторых, Na2O2 способен взаимодействовать с плохо растворимыми оксидами, переводя их в растворимое состояние, что облегчает их определение.
По М.Хармелену, характер взаимодействия конденсированных оксидов элементов с Na2O2 может быть сведен к четырем видам реакций.
- Пероксид натрия реагирует как оксид с образованием соли и выделением кислорода, который в реакции не участвует.
- Na2O2 реагирует с оксидом металла, переводя его в другой оксид, в котором металл находится в более высоком валентном состоянии. При этом кислород не выделяется и пероксид восстанавливается до оксида.
- Пероксид натрия реагирует с оксидом металла, переводя его в более высокое валентное состояние и образуя с ним соединение. В этом случае, как и в предыдущем, кислород не выделяется.
- Реакция между оксидом металла и пероксидом натрия проходит при участии кислорода воздуха по уравнениям[6]:
3.4 Перхлораты
Перхлораты — соли или эфиры хлорной кислоты. Соли металлов, неметаллов, гидразина, гидроксиламина и аммония относятся к неорганическим производным хлорной кислоты, а эфиры и соли органических соединений — к органическим производным хлорной кислоты.
Впервые перхлорат калия был открыт в 1816 г. в Германии венским ученым Стадионом, который расплавил в реторте небольшое количество хлората калия и осторожно добавил в неё немного серной кислоты. Он обнаружил, что после выделения диоксида хлора остаток представляет собой смесь сульфата калия и труднорастворимой соли, которую он идентифицировал как перхлорат калия. Занимаясь изучением новой соли Стадион приготовил хлорную кислоту электролизом.
В 1830 г. Серулля сообщил о разработке нового метода получения хлорной кислоты, разложением хлорноватой кислоты. В 1831 г. Серулля описал ещё один метод превращения хлората калия в перхлорат. Одновременно с изучением хлорной кислоты Серулля приготовил перхлорат аммония и перхлораты ряда металлов. Заслугой Серулля можно считать также популяризацию термина «перхлорат», вместо употреблявшегося Стадионом и другими исследователями с 1816 по 1831 гг. термина оксихлорат
.
В 1886 г. Бекуртс впервые сообщил о присутствии перхлоратов в природных залежах нитратов в Чили. В связи с этим повреждения посевов зерновых в Бельгии, где применяли в качестве удобрений чилийскую селитру, были объяснены действием перхлоратов. Перхлорат калия впервые получили в промышленном масштабе в 1905 г. в Мансбо.
Гофман с сотрудниками в 1906 г. начали изучение соединений, образующихся при добавлении водного раствора хлорной кислоты к различным органическим соединениям. Почти все эти соединения термически неустойчивы и детонируют при нагревании[7].
Производные металлов, неметаллов и неорганических катионов, общей формулы M(ClO4)n (где n — валентность металла) относят к неорганическим соединениям. Неорганические перхлораты делятся на две группы — ионные и ковалентные. Перхлорат-ион очень редко входит во внутреннюю сферу комплексных соединений. Радиус перхлорат-иона 0,236 нм.
Ионные перхлораты (например, перхлораты щелочных, щелочноземельных металлов, аммония) — твердые кристаллические вещества, неокрашенные, если катион не имеет окраски, не гидролизуются водой, часто образуют гидраты. При нагревании плавятся, при дальнейшем нагревании разлагаются до достижения температуры кипения (некоторые перхлораты разлагаются без плавления) с выделением кислорода. Растворимость в воде может быть различной (например, перхлорат натрия NaClO4 хорошо растворим в воде, а перхлорат калия KClO4 — мало растворим в воде).
Ковалентные перхлораты — твердые легкоплавкие или жидкие вещества, неокрашенные, если катион не имеет окраски. Перхлораты неметаллов и некоторых металлов гидролизуются водой. При нагревании плавятся, некоторые кипят без разложения. Обычно растворимы в органических растворителях (например, перхлорат серебра хорошо растворим в бензоле, спиртах, эфире). Перхлорат хлора ClClO4 (т.кип. +44,5 0C) — интересное соединение, имеющее хлор в двух степенях окисления и обладающее сильным хлорирующим действием. К неорганическим перхлоратам иногда относят перхлорилфторид FOClO3(бесцветный газ).
Применение неорганических перхлоратов:
- При нагревании перхлораты разлагаются выделяя кислород, что обусловило их применение в качестве окислителей ракетного твердого топлива.
- Перхлораты щелочных металлов служат исходными соединениями для синтеза других органических и неорганических перхлоратов.
- Перхлораты комплексов железа, кобальта и меди рассматриваются в качестве перспективных взрывчатых веществ (например, для подрыва лазером).
- Перхлорат магния используется как осушитель.
- Перхлорат калия используется для лечения заболеваний щитовидной железы.
- Перхлорат-ион используется для осаждения калия, рубидия, цезия из водных или спиртовых растворов[7].
Выводы
Проведенный анализ литературных источников позволяет сделать следующие выводы:
- Появление новых и развитие существующих способов получения кислорода свидетельствует о растущей потребности общества в кислороде.
- Рассмотрены и проанализированы общие свойства пероксидов натрия и перхлоратов.
- Анализ химических и физических свойств веществ (неорганических пероксидов, перхлоратов), что в индивидуальном состоянии они не могут использоваться для решения практических задач. Они перспективны лишь в качестве составных компонентов химических систем.
При написании данного реферата магистерская работа еще не завершена. Окончательное завершение: июнь 2018 года. Полный текст работы и материалы по теме могут быть получены у автора или его руководителя после указанной даты.
Список источников
- Синявский Ю.В., Боярский М.Ю. Оптимизация систем хранения кислорода. – М.: МЭИ. 1972. – 46 с..
- Угай Я.А. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — 432-527 с.
- Михайленко Я.И. Курс общей и неорганической химии / Я.И. Михайленко – М.: Высшая школа, 1966. – 238 c.
- Глинка Н. Л. Общая химия. — М.:
Химия
, 1977, переработанное. — 566. — 720 с. - Кнунянц И.Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — 387- 671 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с.
- Шумахер И. «Перхлораты: свойства, производство и применение». — М.:ГНТИХЛ 1963
