Аннотация
В.В. Шлома, В.В.Шаповалов Хлорат натрия в качестве химического источника кислорода. Представлены способы получение кислорода. Изучен процесс получения кислорода из хлората натрия. Установлено, что соединения Со(II) являются эффективными катализаторами разложения хлората натрия.
Трудно представить себе область существования или практической деятельности человека без потребления кислорода. Ведущими компаниями, занимающимися производством кислорода, проводятся интенсивные поиски новых способов получения О2, число которых приближается к двадцати. Более 60% получаемого О2 используется в металлургии, 25% - в химической промышленности, около 10% - в сварке и резке металлов, остальное - в медицине, для создания дыхательной атмосферы в герметичных объемах (на подводных судах, космических кораблях и пp.) и для других нужд. Развивается применение кислорода для решения экологических проблем, связанных с очисткой сточных вод и с уничтожением опасных отходов.
Известно более десяти способов получения кислорода. При этом выделяются две группы процессов: классические, открытые к началу ХХ века, и новые, разрабатываемые с шестидесятых годов (табл. 1).

Таблица 1 - Способы получения кислорода [1]
Особое значение имеет способ получения кислорода методом термохимического разложения специально разработанных твердофазных химических композиций. Кислород в химически связанном состоянии позволяет создать системы сочетающие преимущества как баллонного хранения: простоту, высокую надежность, постоянную готовность к работе, отсутствие потерь, так и хранения при криогенных параметрах: высокие удельные и объемные характеристики. Для реализации преимуществ химические источники О2 должны удовлетворять ряду основных, порой противоречивых, требований: 1-легкость получения О2; 2-устойчивость при хранении; 3-высокая чистота получаемого кислорода; 4-безопасность и надежность в эксплуатации; 5-выделение большого количества кислорода из единицы объема химического источника кислорода. Этим требованиям удовлетворяют две группы веществ: -хлораты и перхлораты щелочных и щелочноземельных металлов; -пероксиды, супероксиды и озониды металлов.
Цель работы состояла в выяснении возможности получения кислорода путем каталитического разложения хлората натрия и выбору эффективного катализатора.
Преимущественное разложение хлората натрия по схеме:
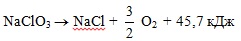
Ппроисходит лишь в присутствии катализаторов. В их отсутствии существенную роль играет экзотермический процесс диспропорционирования хлората натрия по схеме:
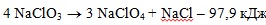
вклад которой в термическое разложение чистого NaClO3 может достигать 75%.
Температурный интервал разложения хлората натрия зависит от параметров динамического нагрева. В квазиизотермическом режиме при регулируемой скорости потери массы его разложение протекает в две плохо разделенные стадии: 370-470 0C c выделением 0,45 моля О2 на моль NaClO3 и 480-520 0С с полным выделением кислорода. В условиях динамического нагрева при скорости 15 град/мин в отсутствии катализаторов NaClO3 плавится при 260 0С и начинает разлагаться при температуре 400 0С. Интенсивное его разложение протекает при t = 480-580 0C также в две плохо разделенные стадии. Тепловыделения при разложении NaClO3 (45,7 кДж/моль) достаточно для разогрева продуктов реакции (NaCl и О2) от 25 0С до температуры 470 0С. Более низкий уровень температуры реакции, чем температура интенсивного разложения NaClO3, делает проблематичным процесс получения кислорода из NaClO3 в режиме самораспространяющейся реакции.
Вследствие достаточно высокого тепловыделения реакция может принципиально протекать в режиме самоддерживающегося процесса после инициирования образца высокотемпературным источником.
Результаты численного эксперимента разложения хлората натрия при различных наборах кинетических параметров k0 и E/R показывают, что самораспространяющееся разложение NaClO3 может осуществляться в адиабатических условиях в том случае, если снизить температуру разложения хлората натрия до 300 – 400 0С. При наличии теплопотерь температура разложения должна быть 200–280 0С. Следовательно, самораспространяющееся разложение хлоратов может быть осуществлено в присутствии катализаторов, снижающих температуру разложения примерно на 200 0С.
Для проверки расчетных данных было изучено разложение хлората натрия в присутствии ряда веществ. Среди катализаторов разложения NaClO3 выделяются соединения Со(II) (табл. 2). В их присутствии NaClO3 разлагается в твердой фазе без признаков плавления.
Наиболее эффективным катализатором оказался основной карбонат кобальта(II). В его присутствии (табл.3) NaClO3 разлагается в режиме самораспространяющейся реакции.
| Соединение | Содержание,% | Температура, 0С |
|---|---|---|
| Основной карбонат кобальта(II) | 3,0-5,0 | 256-252 |
| CoCl2 | 30 | 235 |
| CoC2O4 | 3,0 | 240 |
| Co3(PO4)2 | 20 | 260 |
| СоО(получен в вакууме) | 3,0 | 240 |
| CoO ,(,получен нa воздухе) | 7,0 | 265 |
| Основной карбонат меди(II) | 10,0 | 280-290 |
| CuCl | 10,0 | 320 |
| CuO | 10,0 | 300-540 |
| Основной карбонат никеля | 10,0 | 270 |
Началу выделения О2 из NaClO3 предшествует разложение nCoCO3*mCо(ОН)2, протекающее по суммарной схеме:
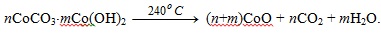
Активным каталитическим компонентом является СоО полученный в вакууме.
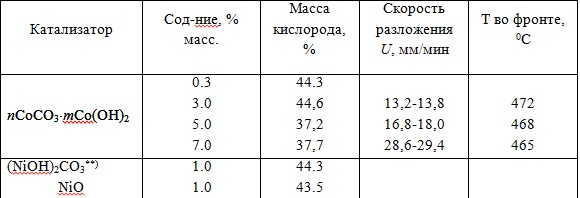
Таблица 1 - Таблица 3 - Характеристики разложения NaClO3 в присутствии соединений кобальта и никеля
Таким образом, реакция каталитического разложения хлората натрия может быть использована для создания устройств получения кислорода. Такие устройства могут представлять интерес для передвижных медицинских систем, для сварки и резки металла и т.д.
Список использованной литературы
1. Синявский Ю.В., Боярский М.Ю. Оптимизация систем хранения кислорода. – М.: МЭИ. 1972. – 46 с.