1. Введение
Нынешняя приверженность устойчивому развитию и потреблению энергии создает множество технических проблем, среди которых необходимость в накоплении энергии. Ключевым материалом, который может быть использован для решения этой задачи, является графен. Графеновые листы позволяют хранить Li+ на обеих гранях, по этой причине его теоретическая емкость накопления энергии в качестве электрода в литий–ионных аккумуляторах вдвое больше, чем в графите [1]. Среди наиболее изученных материалов в литий–ионных аккумуляторах для накопления энергии — материалы на основе графена [2, 3]. Глубоко исследуются возможности графена в различных энергетических устройствах, таких как суперконденсаторы [4, 5], топливные элементы [6, 7] и солнечные элементы [8, 9].
Для выделения графена из графита могут использоваться химические и физические методы. Наиболее распространенным методом получения графеновых нанолистов (GNS) из графита (природного или синтетического) является восстановление оксида графена (GO), полученного при окислении графита [10]. Синтез GO из графита может осуществляться различными методами на основе хлората или перманганата [11]. Сегодня наиболее часто используемым методом синтеза GO является метод Хаммеров, при котором графит окисляется KMnO4 в очень кислой среде. GO имеет увеличенное базальное расстояние по сравнению с графитом. Увеличение базального интервала вызвано вставкой функциональных групп, в основном кислородсодержащих, между углеродными слоями. Восстановление GO может осуществляться химическими, электрохимическими, термическими и микроволновыми методами. Конечные свойства полученного графена зависят от исходного сырья и способа синтеза [12].
Графит является наиболее распространенным источником графена и может быть классифицирован в соответствии с его происхождением как природный (NG) или синтетический. Природный чешуйчатый графит является макрокристаллическим и встречается в большем количестве минеральных запасов. Тем не менее, извлечение чешуйчатого графита из окружающих его минералов обычно включает сложный и загрязняющий процесс очистки из-за его низкого содержания в рудах. Как правило, синтетический графит может быть получен в более высокой степени чистоты, чем NG [13]. Однако синтетический графит имеет более низкую кристалличность, чем жильный или натуральный чешуйчатый графит, и более дорогой, чем NG. За последние несколько лет цена синтетического графита в восемь раз превышала цену NG [14].
Необходимо массово производить графен из графита по низкой цене. NG дешевле синтетического графита; таким образом, производство графена из необработанного NG снизит производственные затраты. Кроме того, в земле все еще имеются огромные запасы минералов NG. В настоящее время для приготовления графена используется только высокочистый графит (более 99,9% фиксированного углерода) [15, 16]. Для достижения такого уровня чистоты силикатные минеральные примеси в исходном графите необходимо удалять путем испарения при сверхвысокой температуре или выщелачивания в плавиковой кислоте [17-19]. Эти методы очистки вызывают обеспокоенность в связи с их высоким потреблением энергии или остаточным содержанием фтора в сбрасываемых сточных водах [20, 21], соответственно.
Здесь мы показываем, что нелеченый NG может быть использован для получения высококачественных нанолистов графена, которые обладают отличными энергетическими свойствами. Si, Fe и Ca некоторые из примесей которых присутствовали в NG. Установлено, что значительное количество этих примесей все еще остается в химически восстановленных графеновых материалах, хотя при окислительной обработке графитовых образцов происходит их существенное удаление. С использованием этого материала в качестве электрода в литий–ионных аккумуляторах исследована емкость накопителя энергии. Удивительно, примеси, оставшиеся в образце, не влияют на электрохимические свойства электрода. Сравнивая эти результаты с аналогичным исследованием образцов синтетики, NG и синтезированный графен демонстрируют отличные энергетические свойства, которые превосходят энергетические значения, указанные для других графеновых материалов, полученных аналогичными методами из чистого синтетического графита.
2. Материалы и методы
2.1. Синтез графена
Необработанный NG в Испании используется в качестве сырья. Этот графит встречается в вулканических породах и является примером графита, образующегося при осаждении флюидов [22]. Оксид графита (GO) синтезировали с использованием модификации метода Хаммера [23]. GNS готовили методом термического пилинга, нагревая уже синтезированный GO в трубчатой печи при температуре 300°С в течение 2 ч в атмосфере N2 со скоростью 5°С•мин-1.
3. Результаты и обсуждение
3.1. Структурная, композиционная и морфологическая характеристика
Структурные свойства и образцы NG, GO и GNS были исследованы методом XRD (Рис. 1). XRD картины показывают характерные пики для всех этих материалов.
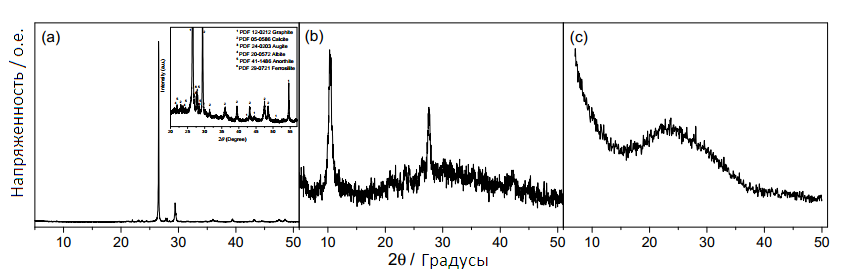
Рисунок 1 — Дифракционная картина необработанного природного графита (а); вставка показывает увеличенную область; графитовая окись (b); и графеновые наношиты (с)
XRD показывает дополнительные пики из–за остальных фаз. NG содержит кальцит (05–0586 JCPDS) и силикаты на основе алюминия и железа с низкой кристалличностью (в минеральных фазах, таких как аугит, альбит, анортит и феррозилит) в дополнение к графиту (12–0212 JCPDS). GO и GNS сохраняют те же примеси, что и NG, за исключением кальцита, который удаляется во время окислительной обработки.
EDAX анализ подтверждает данные XRD, что NG состоит изC, O, Si, Fe, Ca и Al, GO и GNS состоят из C, O, Si, Fe и Al. Как и ожидалось, содержание кальция в графите исчезает при окислительной обработке, что согласуется с XRD–результатом. Однако, примеси Fe, Al и Si не исчезают в ходе этой обработки. Значения атомного состава полученные от анализа элемента (АЭ) и EDAX согласуются. Содержание кислорода для GO высоко, и уменьшается во время термального отслаивания по мере того как температура увеличивается. С другой стороны, при обработке серной кислотой сера появляется в анализе GO , но уменьшается при отслаивании. Межслойное расстояние, как правило, увеличивается по мере увеличения содержания функциональных групп.
Количество каждого элемента в NG, GO и GNS определялось по данным TG (рис.2a), и значения соответствовали анализу элементного состава. Кривая TG для NG, полученного в кислородной атмосфере, показала потерю веса между 500–700°С, что соответствует окислению графита (45–50% по массе). В декарбонизации кальцита происходит при несколько более высоких температурах около 780–800°С (5–10%). Остальная часть образца состояла из силикатов на основе алюминия и железа, которые невосприимчивы к процессу. Для неиндуцированного GO основная потеря массы (~55%) приходилась на 200°С и связана с разложением лабильных функциональных групп кислорода [24, 25]. Потеря массы при температурах ниже 100°С (~10%) может быть отнесена на счет удаления поглощенной воды, тогда как устойчивая потеря, наблюдаемая при более высоких температурах, объясняется выделением более стабильных кислородсодержащих функциональных групп [26]. Кривая TG для GNS отражает его типичную термическую стабильность до 400°С [27], после чего он начинает быстро терять вес. Около 45–50% образца соответствует GNS, в то время как остальная часть образца состоит из силикатов алюминия и железа в соответствии с другими методами анализа. Процесс восстановления был подтвержден отсутствием потери массы около 200°С. Кривая TG GNS также показывает значительную потерю массы (10%) ниже 100°С из–за десорбции воды.
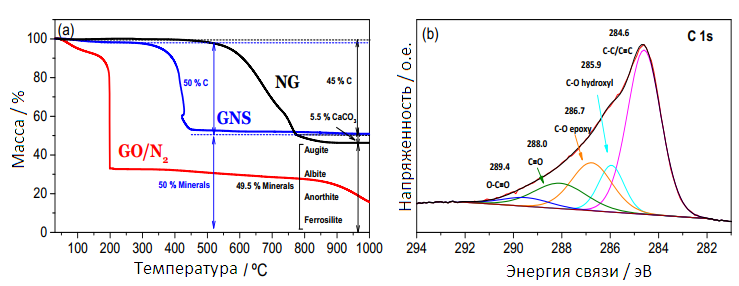
Рисунок 2 — Кривые TG образцов NG, GO и GNS. Скорость нагрева составила 5°С•мин-1 при кислороде, за исключением GO, которая проводилась при N2 (а); спектры XPS для пика фотоэмиссии С1 с образца GNS (b).
Для получения дополнительной информации о химическом составе были получены спектры XPS (рис. 2b). Как и ожидалось, спектры С1 XPS для GNS показали, что в процессе термического восстановления происходило значительное дезоксигенирование. Сигналы были хорошо приспособлены, с сочетанием из по крайней мере 5 перекрыли пики (Р2 более высоко чем 0,999). Самый сильный сигнал в 284.6 эВ был назначен на C–C связи [28].
Спектроскопия комбинационного рассеяния света является мощным методом исследования углеродсодержащих материалов, таких как графен, а также полезна для изучения упорядоченных и неупорядоченных кристаллических структур и различия одиночных и многослойных характеристик графена [29]. Спектроскопия комбинационного рассеяния света может использоваться для наблюдения расщепления графитовых слоев. Спектры комбинационного рассеяния для NG, GO и GNS можно увидеть на рисунке 3. Относительная интенсивность пары полос в диапазоне 1200–1800 см-1 была предложена в качестве индикатора графенового распада [30]. Наличие дефектов в высококачественном графене необходимо для его активации [31]. Значения отношения ID/IG значительно увеличились от NG (0,14) до GO и GNS (0,88 и 0,91 соответственно), что указывает на то, что оба материала обладают более дефектной структурой и более низкой степенью графитации, чем природный графит. Перекрывающиеся пики, наблюдаемые для GNS (рис. 3с) в диапазоне 2250–3300 см-1, характерны для данного углеродсодержащего материала и свидетельствуют о структуре, состоящей из штабелированных слоев.
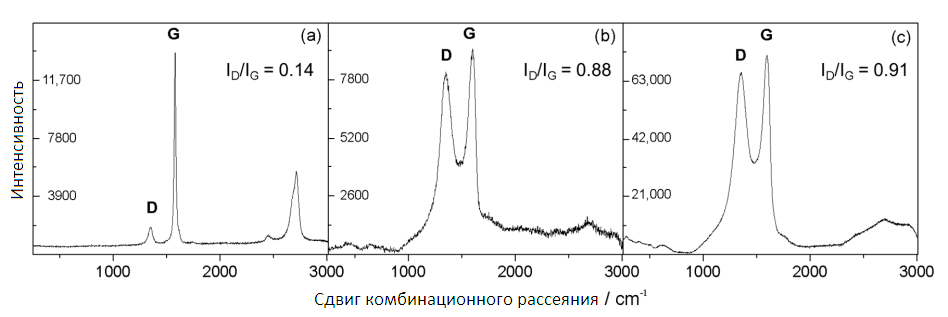
Рисунок 3 — Спектры комбинационного рассеяния света необработанного природного графита (а); графитового оксида (b); графеновых наношитов (с).
Морфологические свойства NG, GO и GNS изучали SEM и TEM (рис.4). Микрометрические частицы сажи показаны на рисунке 4а. TEM–изображения GO и образцы GNS (рис. 4Б,в) содержат темные и матовые пятна из–за минеральных фаз, хотя существуют значительные различия между изображениями. GNS показывают характерную систему запутанных и прокрученных листов, которые напоминают скомканную бумагу. Анализ EDAX минеральных фаз в образце GNS подтвердил, что графеновый углерод находится в прозрачной области изображения, в то время как Si, Fe и Al присутствуют в темных пятнах.

Рисунок 4 — Микрофотография NG (а); TEM изображения GO (b); TEM изображения GNS (с); EDAX сопоставление C, Si, Fe и Al образец GNS (d).
3.2. Электрохимические свойства
На рис. 5 показано, что GNS, синтезированные из необработанного NG, обладают прекрасными энергетическими свойствами, даже без применения стратегий предварительного литиирования [32]. На рис. 5a показаны кривые разряда/заряда для 1–го, 10–го и 100–го циклов ячейки, изготовленной с помощью NG–электрода, а на рис.5b — кривые ячейки GNS, записанные на C/5. Первые кривые разряда/заряда демонстрировали необратимую емкость, которая обычно ассоциировалась с образованием твердой электролитной интерфазы (SEI), происхождение которой можно приписать либо силикатным примесям [33] и/или морфологии нановолокна графита [34]. Удельная емкость GNS в последующих циклах более чем в два раза превышает емкость NG.
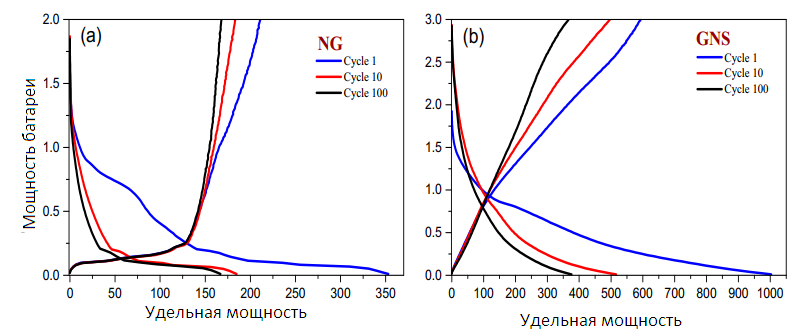
Рисунок 5 — Кривые разряда/заряда для электродов NG (a) и GNS (b) со скоростью C/5.
Емкость этих ячеек в зависимости от числа циклов показана на рис. 6а. Как графит, так и графен демонстрировали высокую начальную необратимую емкость. Как и ожидалось, сохранение емкости ячеек, изготовленных из графита, лучше, чем у ячеек, изготовленных из электрода GNS, что согласуется с кривыми разряда/заряда (Рис.5). Эти результаты согласуются с результатами Hassoun et al. [35], так как любая химическая обработка применяется для графитовых хлопьев. Поэтому источником электрохимической необратимости, наблюдаемой в реальных литий–ионных ячейках, могут быть структурные модификации графитовых хлопьев, индуцированные обработкой сильными химическими веществами для их превращения в GNS. В результате емкость GNS была значительно ниже чем собственная разряжающая способность. При дальнейшем циклическом движении не было заметных изменений, влияющих на форму кривых разряда/заряда, и была замечена тенденция к выравниванию удельных мощностей разряда и заряда; кроме того, наблюдалось увеличение кулоновской эффективности. Кроме того, в течение первых десяти циклов для GNS наблюдалось резкое снижение мощности (рис. 6а). Только 45% общей массы электрода состояло из углерода. Результаты показывают, что емкость электрода GNS составила 770 мА • ч•г-1, что превышает теоретическую емкость для графена (744 мА•ч•г-1). Эта незначительная избыточная емкость может быть обеспечена проводящей добавкой электрода, обратимая емкость которого сообщалась ранее [36].
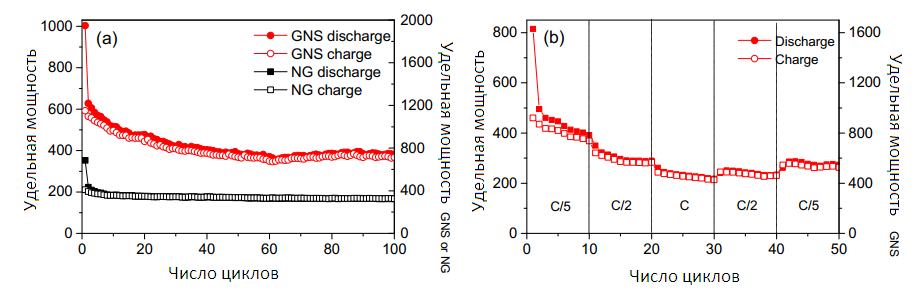
Рисунок 6 — Циклическое представление электродов NG и GNS по норме C/5 (a); Испытание возможности электрода GNS (b).
Рисунок 6b показывает циклическую GNS при различных токах. Поведение в C/2 и C/5 похожи, а в 1С удельная емкость немного ниже. Электроды имеют высокую начальную емкость, которая затем снижается и стабилизируется в районе 800 и 600 мА•ч•г-1 с цикличностью C/2 и C/5.
Сравнивая эти результаты с аналогичными исследованиями с чистым синтетическим графитом в качестве источника графена [23] или графеном, полученным крупномасштабным CVD методом из ацетилена [37], GNS, полученный из необработанного NG, обладает отличными свойствами в качестве электрода для хранения энергии.
4. Выводы
Таким образом, мы разработали электрод из необработанного NG для использования в литий-ионных аккумуляторах, который обладает высокой электрохимической стойкостью, которая остается постоянной при 200 мА•ч•г-1 в течение первых 100 циклов. Кроме того, мы продемонстрировали возможность получения графена путем окисления необработанного NG модифицированным Хаммерным методом и последующего восстановления методом термического отслаивания при 300°С. Полученный GNS по–прежнему содержит примеси из необработанного NG; однако он имеет вдвое большую удельную емкость по NG, так как остальные фазы не влияют на электрохимические свойства синтезируемых материалов в качестве электродов в литий–ионных аккумуляторах.
Список использованной литературы
- Sun, Y.Q.; Wu, Q.O.; Shi, G.Q. Graphene based new energy materials. Energy Environ. Sci. 2011, 4, 1113–1132. [CrossRef]
- Liang, M.H.; Zhi, L.J. Graphene–based electrode materials for rechargeable lithium batteries. J. Mater. Chem. 2009, 19, 5871–5878. [CrossRef]
- Guo, F.; Silverberg, G.; Bowers, S.; Kim, S.P.; Datta, D.; Shenoy, V.; Hurt, R.H. Graphene–Based Environmental Barriers. Environ. Sci. Technol. 2012, 46, 7717–724. [CrossRef] [PubMed]
- Genc, R.; Alas, M.O.; Harputlu, E.; Repp, S.; Kremer, N.; Castellano, M.; Colak, S.G.; Ocakoglu, K.; Erdem, E. High–Capacitance Hybrid Supercapacitor Based on Multi–Colored Fluorescent Carbon–Dots. Sci. Rep. 2017, 7, 11222. [CrossRef] [PubMed]
- Repp, S.; Harputlu, E.; Gurgen, S.; Castellano, M.; Kremer, N.; Pompe, N.; Worner, J.; Hoffmann, A.; Thomann, R.; Emen, F.M.; et al. Synergetic effects of Fe3+ doped spinel Li4Ti5O12 nanoparticles on reduced graphene oxide for high surface electrode hybrid supercapacitors. Nanoscale 2018, 10, 1877–1884. [CrossRef] [PubMed]
- He, D.; Tang, H.; Kou, Z.; Pan, M.; Sun, X.; Zhang, J.; Mu, S. Engineered Graphene Materials: Synthesis and Applications for Polymer Electrolyte Membrane Fuel Cells. Adv. Mater. 2017, 29, 1601741. [CrossRef] [PubMed]
- Tong, X.; Wei, Q.L.; Zhan, X.X.; Zhang, G.X.; Sun, S.H. The New Graphene Family Materials: Synthesis and Applications in Oxygen Reduction Reaction. Catalyst 2017, 7, 1. [CrossRef]
- Low, F.W.; Lai, C.W. Recent developments of graphene–TiO2 composite nanomaterials as efficient photoelectrodes in dye–sensitized solar cells: A review. Renew. Sustain. Energy Rev. 2017, 82, 103–125. [CrossRef]
- Eck, M.; Pham, C.V.; Zufle, S.; Neukom, M.; Sessler, M.; Scheunemann, D.; Erdem, E.; Weber, S.; Borchert, H.; Ruhstaller, B.; et al. Improved efficiency of bulk heterojunction hybrid solar cells by utilizing CdSe quantum dot–graphene nanocomposites. Phys. Chem. Chem. Phys. 2014, 16, 12251–12260. [CrossRef] [PubMed]
- Zhu, Y.W.; Murali, S.; Cai, W.W.; Li, X.S.; Suk, J.W.; Potts, J.R.; Ruoff, R.S. Graphene and Graphene Oxide: Synthesis, Properties, and Applications. Adv. Mater. 2010, 22, 3906–3924. [CrossRef] [PubMed]
- Hummers, W.S., Jr.; Offeman, R.E. Preparation of graphitic oxide. J. Am. Chem. Soc. 1958, 80, 1339. [CrossRef]
- Pumera, M. Graphene–based nanomaterials for energy storage. Energy Environ. Sci. 2011, 4, 668–674. [CrossRef]
- Pierson, H.O. Handbook of Carbon, Graphite, Diamond and Fullerenes: Properties, Processing and Applications; Noyes Publications: Park Ridge, NJ, USA, 1993.
- Olson, D.W. 2010 Minerals Yearbook: Graphite; United States Geological Survey (USGS): Reston, VA, USA, 2012; Volume 32.
- Wu, Z.S.; Ren, W.C.; Gao, L.B.; Liu, B.L.; Jiang, C.B.; Cheng, H.M. Synthesis of high–quality graphene with a pre–determined number of layers. Carbon 2009, 47, 493–499. [CrossRef]
- Badenhorst, H. Microstructure of natural graphite flakes revealed by oxidation: Limitations of XRD and Raman techniques for crystallinity estimates. Carbon 2014, 66, 674–690. [CrossRef]
- Li, Y.F.; Zhu, S.F.; Wang, L. Purification of natural graphite by microwave assisted acid leaching. Carbon 2013, 55, 377–378. [CrossRef]
- Zhang, X.–J.; Chen, B.; Gao, X.–M. Depuration of scaly graphites by high temperature graphitization. Carbon Tech. 2001, 2, 39–40.
- Kuang, J.; Xu, H.; Xie, W.; Tang, W.; Deng, Y.; Wang, T.; Peng, S. Investigation of Purification Technology for Aphanitic Graphite by Ammonium Fluoride and Hydrochloric Acid. Mater. Rev. 2013, 27, 9–12.
- Rao, R.B.; Patnaik, N. Preparation of high pure graphite by alkali digestion method. Scand. J. Metall. 2004, 33, 257–260. [CrossRef]
- Cohen-Solal, M.E.; Baudoin, C.; Omouri, M.; Kuntz, D.; De Vernejoul, M.C. Bone mass in middle–aged osteoporotic men and their relatives: Familial effect. J. Bone Miner. Res. 1998, 13, 1909. [CrossRef] [PubMed]
- Rodas, M.; Barrenechea, J.F.; Luque, F.J. Fluid–deposited graphite: The mineralization from Huelma (Jaen). Geogaceta 1996, 20, 1573.
- Vargas, O.A.; Caballero, A.; Morales, J. Can the performance of graphene nanosheets for lithium storage in Li–ion batteries be predicted? Nanoscale 2012, 4, 2083–2092. [CrossRef] [PubMed]
- Si, Y.; Samulski, E.T. Synthesis of water soluble graphene. Nano Lett. 2008, 8, 1679–1682. [CrossRef] [PubMed]
- Rutter, G.M.; Crain, J.N.; Guisinger, N.P.; Li, T.; First, P.N.; Stroscio, J.A. Scattering and interference in epitaxial graphene. Science 2007, 317, 219–222. [CrossRef] [PubMed]
- Paredes, J.I.; Villar–Rodil, S.; Martinez–Alonso, A.; Tascon, J.M.D. Graphene oxide dispersions in organic solvents. Langmuir 2008, 24, 10560–10564. [CrossRef] [PubMed]
- Wu, Z.S.; Ren, W.C.; Xu, L.; Li, F.; Cheng, H.M. Doped Graphene Sheets As Anode Materials with Superhigh Rate and Large Capacity for Lithium Ion Batteries. ACS Nano 2011, 5, 5463–5471. [CrossRef] [PubMed]
- Abouimrane, A.; Compton, O.C.; Amine, K.; Nguyen, S.T. Non–Annealed Graphene Paper as a Binder–Free Anode for Lithium–Ion Batteries. J. Phys. Chem. C 2010, 114, 12800–12804. [CrossRef]
- Guo, H.L.; Wang, X.F.; Qian, Q.Y.; Wang, F.B.; Xia, X.H. A Green Approach to the Synthesis of Graphene Nanosheets. ACS Nano 2009, 3, 2653–2659. [CrossRef] [PubMed]
- Ni, Z.H.; Wang, Y.Y.; Yu, T.; Shen, Z.X. Raman Spectroscopy and Imaging of Graphene. Nano Res. 2008, 1, 273–291. [CrossRef]
- Pimenta, M.A.; Dresselhaus, G.; Dresselhaus, M.S.; Cancado, L.G.; Jorio, A.; Saito, R. Studying disorder in graphite–based systems by Raman spectroscopy. Phys. Chem. Chem. Phys. 2007, 9, 1276–1291. [CrossRef] [PubMed]
- Holtstiege, F.; Barmann, P.; Nolle, R.; Winter, M.; Placke, T. Pre–Lithiation Strategies for Rechargeable Energy Storage Technologies: Concepts, Promises and Challenges. Batteries 2018, 4, 4. [CrossRef]
- Yang, J.; Guo, Y.Y.; Zhang, Y.F.; Sun, C.C.; Yan, Q.Y.; Dong, X.C. Cobalt silicate hierarchical hollow spheres for lithium–ion batteries. Nanotechnology 2016, 27, 7. [CrossRef] [PubMed]
- Arrebola, J.C.; Caballero, A.; Hernan, L.; Morales, J. Graphitized Carbons of Variable Morphology and Crystallinity: A Comparative Study of Their Performance in Lithium Cells. J. Electrochem. Soc. 2009, 156, A986–A992. [CrossRef]
- Hassoun, J.; Bonaccorso, F.; Agostini, M.; Angelucci, M.; Betti, M.G.; Cingolani, R.; Gemmi, M.; Mariani, C.; Panero, S.; Pellegrini, V.; et al. An Advanced Lithium–Ion Battery Based on a Graphene Anode and a Lithium Iron Phosphate Cathode. Nano Lett. 2014, 14, 4901–4906. [CrossRef] [PubMed]
- Peng, B.; Xu, Y.; Wang, X.; Shi, X.; Mulder, F.M. The electrochemical performance of super P carbon black in reversible Li/Na ion uptake. Sci. China Phys. Mech. Astron. 2017, 60, 064611. [CrossRef]
- Chen, S.; Bao, P.; Xiao, L.; Wang, G. Large–scale and low cost synthesis of graphene as high capacity anode materials for lithium–ion batteries. Carbon 2013, 64, 158–169. [CrossRef]