Аннотация
Кожевников А. Б., Петросян О. П., Баранов А. А. Недостатки гипохлорита фатально неисправимы.
Колебательные процессы в технике имеют большое значение. Электромагнитные колебания лежат в основе всех современных электронных средств передачи и обработки информации.
Для облегчения понимания общих закономерностей колебательных процессов целесообразно начинать их изучение с простых и наглядных систем, например, замкнутая цепь, содержащая конденсатор и катушку индуктивности. Изменение во времени физических величин, характеризующих разные колебательные системы, описывается одинаковыми дифференциальными уравнениями.
Исследование компьютерных программ при моделировании разных способов возбуждения колебаний позволяет определить точностные и частотные характеристики программ.
Развернутая на страницах прессы и тематических конференциях жаркая дискуссию вокруг хлора и гипохлорита натрия наши оппоненты стараются направить в русло что лучше с точки зрения производителя питьевой воды: хлор или гипохлорит?
, забывая о качестве питьевой воды в кране потребителя-гражданина России, ради которого они и работают и который обеспечивает их заработной платой, отчисляет иные платежи в надежде на то, что он получит качественную питьевую воду. А наша позиция гораздо проще: мы не против гипохлорита и тем более не против хлора, так как производим и готовы поставлять собственное оборудование для дозирования и того, и другого хлорреагента. Если посмотреть на схемы, представленные в сайте www.kravt.ru, то не трудно заметить идентичность оборудования для автоматического дозирования и хлора, и гипохлорита.
Нас интересует иное – истина, а именно: достоинства и недостатки хлора и гипохлорита как дезинфектантов и рациональное использование их в технологиях водоподготовки[1 , 2] Перефразируя известного литературного героя в данной ситуации можно сказать: Вы наши друзья, но истина дороже
. Считаем необходимым в процессе дискуссии не забывать уже известные научные факты, ссылаясь на которые можно обеспечить объективность.
Прежде всего, в очередной раз подчеркнем, что без хлора или без гипохлорита ну никак нельзя, если вода распределяется потребителям через водопроводную сеть, так как только хлор (а он содержится и в гипохлорите) обладает эффектом последействия или пролонгированного действия, благодаря которому гарантируется бактериологическая безопасность воды в любой точке распределительной сети вплоть до крана каждого потребителя. Что поделаешь, так свыше устроена жизнь. И если кому-то не нравится хлор, жаль, но это его проблемы. Без хлорирования нельзя, если есть водопроводная сеть! Надеемся, что это понятно.
Итак, чистую воду (и артезианскую тоже) надо хлорировать, прежде чем направлять ее в водопроводную сеть (для справки: в России более 50 тысяч водопроводных сетей). Чтобы уяснить чем хлорировать в каждом конкретном случае, давайте проанализируем диаграмму, представленную на рис.1, которая показывает состояние системы вода-хлор в зависимости от значения водородного показателя воды рН независимо от того, как туда попал хлор: в виде чистого хлора или гипохлорита [3 , 4].
Общеизвестно, что качество обеззараживания воды хлорсодержащими реагентами зависит от значения водородного показателя рН, так как именно значение рН воды определяет формы соединений хлора в воде и их активность. И эта диаграмма весьма точно демонстрирует проявление таких качеств хлором (рис. 1).
При низких значениях рН (от 0 до 3) преобладают молекулярный хлор Cl2 и в верхней половине этого диапазона начинает образовываться, хлорноватистая кислота НСlO, возрастая количественно так, что уже в диапазоне значений рН от 3 до 6 в воде присутствует только хлорноватистая кислота НСlO. А далее (рН>6) хлорноватистая кислота распадается на ионы Н+ и ClO- , а при рН>9 HСlO переходит полностью в гипохлорит-ион ClO- .
Таким образом из диаграммы на рис. 1 следует, что в зависимости от значения рН воды существуют зоны стабильности хлорреагентов в воде: зона Cl2 , зона HСlO , зона ClO- (зона гипохлорита), в которых не проявляется их активность, и зоны нестабильности: зона Cl2-HСlO (рН=1,5-3,5), зона HСlO-ClO- (рН=6-9). Так как рН воды поверхностных источников составляет 6,5-8,5, то вторая зона нестабильности должна быть предметом нашего внимания, так как именно в этой зоне проявляется высокая бактерицидная активность, причем наивысшая бактерицидная активность соединений хлора проявляется в диапазоне рН от 7,0 до 7,5, где концентрации гипохлорит-ионов и хлорноватистой кислоты сопоставимы.
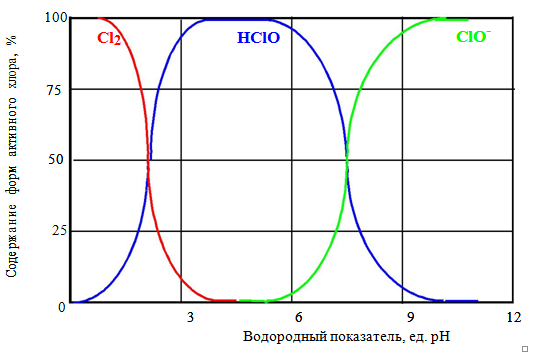
Рисунок 1 – Соотношение содержания форм соединений хлора в воде в зависимости от значения pH
Объясняется данный факт тем, что указанные соединения, являясь сопряженными кислотой и основанием (HClO + H2O > H3O+ + ClO-; ClO- + H2O > HClO + OH-), образуют в указанном диапазоне значений рН метастабильную систему, способную генерировать ряд соединений и частиц, обладающих гораздо большим антимикробным действием, нежели хлорноватистая кислота: 1О2-синглетный молекулярный кислород; ClO - гипохлорит-радикал; Cl – хлор-радикал (атомарный хлор); O — атомарный кислород; ОН — радикал гидроксида. Катализаторами реакций с участием хлоркислородных соединений являются ионы H+ и OH-, существующие в воде также приблизительно в равном количестве при значениях рН, близких к нейтральному, равному 7-7,5 [5].
А теперь вернемся к вопросу: хлор или гипохлорит?
- Известно, что низкоконценрированный гипохлорит натрия, производимый непосредственно на объекте, и концентрированный гипохлорит натрия, производимый самостоятельным предприятием химического профиля, представляют собой водный раствор хлора и щелочи (NaOH) со значением рН таких растворов более 9 и более 12 соответственно, что объясняется неизбежным присутствием в каждом из этих растворов щелочи в меньшем или большем количестве. Это значит, что согласно диаграммы рис.1, гипохлорит имеет место быть только в зоне значений рН свыше 9 единиц. А эта зона есть зона стабильности, а не бактерицидной активности соединений хлора. И это фатально неустранимо, так как если убрать из гипохлорита излишнюю щелочь, чтобы соответствовать зоне наивысшей бактерицидной активности, то это уже будет не гипохлорит, а раствор хлора в очищенной природной воде, который называется хлорной водой;
- Как хлор, так и гипохлорит производятся по одной и той же технологии, основу которой составляет электролиз поваренной соли (NaCl). Эта технология хорошо отработана, так как достаточно давно используется для промышленного производства каустической соды (NaOH). Причем чистый хлор, а также водород, являются побочными продуктами этого производства. А так как их появление неизбежно в этом производстве, то технология их доведения до товара также давно и детально отработана.
Для того, чтобы на основе этой технологии получать гипохлорит натрия (NaClO), достаточно в электролизере убрать диафрагму, разделяющую анод и катод. При этом конечным продуктом будут: гипохлорит натрия, водород и в меньшем количестве – хлор, так как происходит его непрерывное испарение из раствора гипохлорита. Причем в таких действующих технологиях водород и хлор выбрасываются в атмосферу (рис.2), а гипохлорит содержит лишь 0,6% хлора [6 , 7].
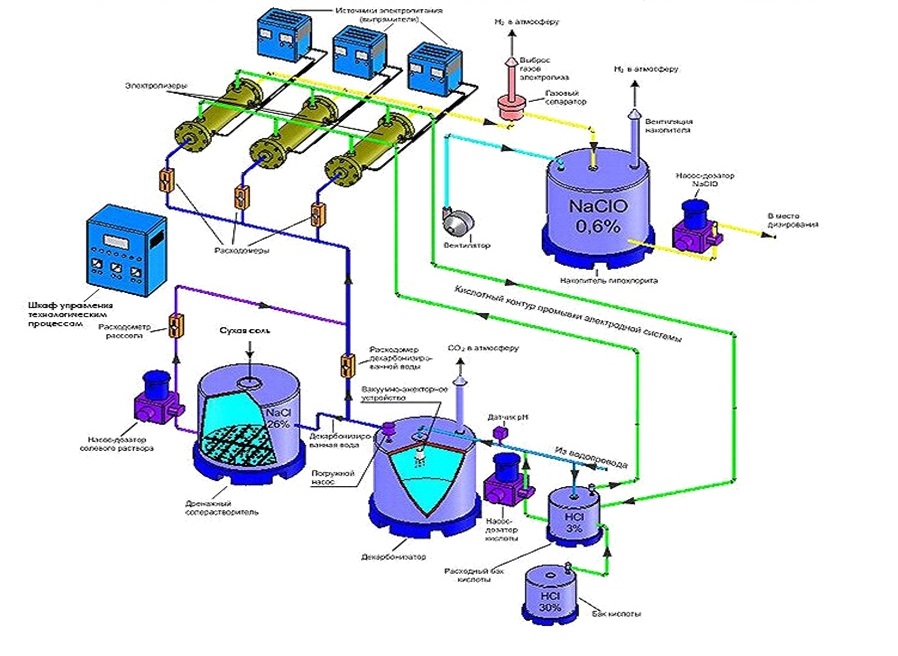
Рисунок 2 – Установка Хлорэфс
производства НПП ЭКОФЭС
А сколько стоит гипохлорит, эквивалентный 1 кг чистого хлора? Определим его себестоимость по укрупненным затратам на его производство, рассчитанным на основе опубликованных данных, взяв за основу установку Хлорэфс
:

И это только себестоимость, а не отпускная цена. К сожалению, получилось намного дороже чистого хлора. Извините, оппоненты, мы пользовались вашими данными [6 , 7]. Может мы где-то ошиблись. Согласны пересмотреть эти цифры, если нарушили объективность. Но этого следовало ожидать. Если при производстве каустической соды кроме нее поступают в продажу водород и чистый хлор (на 1кг соды приходится 0,89 кг хлора и 0,03 кг водорода), то производственные затраты на этом предприятии покрываются продажей трех вышеназванных продуктов. А чем должны покрываться затраты небольшого по объему производства заводика Хлорэфс
, работающего на водоканале? Только тарифом на питьевую воду, так как кроме гипохлорита, идущего на обеззараживание воды на этом водоканале, никаких дополнительных или побочных продуктов этот заводик не производит. А мог бы производить, если бы его создатели не убрали диафрагму из электролизера! Тогда бы появились и сода, и водород от продажи, которых, согласно действующим ценам, можно было бы получить доход в 59 рублей на каждый килограмм полученного хлора и практически полностью компенсировать затраты. Но, увы, в страхе перед хлором создатели производства низкоконцентрированного гипохлорита напрочь забыли про экономику.
Вывод: с переходом на гипохлорит должен прилично возрасти тариф на питьевую воду, иначе Водоканал может стать банкротом. А гражданину России это надо? Можно было бы с этим и согласиться, если бы качество питьевой воды стало бы хоть чуть-чуть выше. Но увы, эта сторона вопроса не выдерживает никакой критики.
Если в чистую воду вводится гипохлорит, то это значит, что вводятся не только компоненты, определяющие его химическую формулу NaClO, но и иные составляющие, необходимые для его приготовления. Их можно определить, например, проанализировав технологический процесс приготовления низкоконцентрированного гипохлорита на современной установке Хлорэфс
[6 , 7], схема которой представлена на рис.2.
Установка Хлорэфс
включает следующие технологические узлы: солерастворитель; декарбонизатор; электролизеры; резервуары для хранения приготовленного гипохлорита натрия; кислотное хозяйство для промывки электродной системы и декарбонизации воды. Из этой технологии следует, что в воду дополнительно вводятся не улучшающие ее качество химические компоненты, являющиеся примесями используемой соли и реагентов, а также продукты их взаимодействия. И сколько же вводится в чистую воду этого неконтролируемого по составу балласта?
Так как произведенный на минипредприятии Хлорэфс
гипохлорит содержит лишь 0,6% хлора (а остальное и есть балласт) то нетрудно подсчитать, что введение в чистую воду 10 кг чистого хлора, например в час (одна пятая объема баллона для хлора), что реально для многих станций водоподготовки и соответствует производительности установки Хлорэфс
, равнозначно введению в туже чистую воду 1667 литров гипохлорита в час, в котором 1656 литров этого балласта. Если читателя эти цифры не впечатлили, то предлагаю оценить суточное производство: 41 тысяча 675 литров гипохлорита в сутки вместо 240 кг хлора (четвертая часть контейнера). Есть ли здравый смысл в таком предприятии, КПД которого ниже даже паровоза? Напомним, что КПД паровоза порядка 9% в то время как КПД этого чудо-предприятия
всего лишь 0,6%. Но даже забыв о здравом смысле, можно констатировать: гипохлорит снижает качество питьевой воды.
система, находящаяся в состоянии устойчивого химического равновесия, при внешнем воздействии (изменении температуры, давления, концентрации реагирующих веществ и т.д.) стремится вернуться в состояние равновесия, компенсируя эффект воздействия[8], т.е. гипохлоритные ионы все это время будут медлить переходить в активную форму, что весьма негативно должно сказаться на обеззараживании воды.
А что же с хлором? При обеззараживании воды хлором, растворяясь в воде, хлор не влияет на рН воды, т.е. ни коим образом не дестабилизирует систему с точки зрения ее химического равновесия, а значит, и бактерицидной активности.
По всей вероятности именно этим объясняются худшая бактерицидная активность обеззараживающего раствора на базе гипохлорита, доказанная проведенными научными и экспериментальными исследованиями: гипохлорит замедляет процесс обеззараживания, неэффективен против цист и споровых форм микроарганизмов, не в состоянии обеспечить удаление биопленок с поверхности трубопроводов, которые благоприятны для развития микроорганизмов и вторичного загрязнения воды, значительно увеличивает вероятность образования тригалометанов (ТГМ), что ухудшает качество воды, и процесс образования ТГМ растягивается во времени до нескольких часов.
Вывод здесь весьма однозначен: гипохлорит имеет худшую бактерицидную активность.
Авторы Хлорэфса
говоря, что они внедряют безопасную технологию, тем не менее, получили разрешение на применение Ростехнадзора (РРС 00-29825 от 07.06.2008). А мы добавим, что с гипохлоритом соседствует опасность для обслуживающего персонала. Рассматривая схему работы электролизера, производящего низкоконцентрированный раствор гипохлорита натрия из раствора поваренной соли в проточном электрохимическом реакторе, следует отметить, что в емкости с готовым раствором гипохлорита образуется не чистый водород, а взрывоопасная смесь, состоящая из водорода, кислорода и хлора. Только вентиляция взрывоопасных электролизных газов (см. рис.2) приводит к бесконтрольному рассеванию в атмосфере хлора, что не допустимо и поэтому применение на объекте электролизеров должно предусматривать устройства нейтрализации выбросов хлора. Более того, потенциальной опасностью гипохлорита является его полная несовместимость с кислотами. Поэтому наиболее крупные аварии случаются при смешивании гипохлорита с кислотами, что приводит к выбросу газообразного облака хлора при этом следует учесть, что выделяется в таких случаях влажный хлор, который при проникновении в легкие не вызывает болевых ощущений, поэтому наиболее опасен и приводит к большим жертвам (а в установке Хлорэфс
одним из основных реагентов является соляная кислота). С другой стороны, имеют место постоянные газовыделения в ходе естественного разложения гипохлорита. Поэтому в случаях, когда гипохлорит оказывался между двумя закрытыми запорными устройствами, наблюдались взрывы шаровых клапанов, фильтров, и других устройств. Причем в составе выделяемых газов опять содержится хлор, поэтому помещения насосных, туннелей, фильтровальных установок и других аналогичных пространств потребовалось оснастить системами очистки воздуха, причем такими, которые также обеспечивают нейтрализацию выделяющегося хлора. Возникают проблемы и с подбором оборудования, и с его эксплуатацией в среде растворов гипохлорита, обладающих очень высокой коррозионной активностью. При использовании вместо газообразного хлора гипохлорита натрия в процессе ввода этого реактива в систему трубопроводов для его разбавления там образуется осадок, состоящий из гидроксида магния и диоксида кремния, забивающий водные каналы, поэтому требуются дополнительные мероприятия и по предотвращению кальцинации арматуры, особенно точек ввода – инжекторов и диффузоров.
Из сказанного выше следует, что применение раствора гипохлорита вне зависимости от способа его получения (промышленный или на локальных установках) в сравнении с хлором не только не снижает опасность происшествий и аварий на производственных объектах водоподготовки, но и способствует интенсивному разрушающему воздействию на технологическое оборудование, способствуя досрочному выходу его из строя. Вывод: гипохлорит не менее опасен, чем хлор.
Но хлор же очень-очень опасен, его в Первой мировой войне применяли как отравляющее вещество, а значит будет страдать и персонал, обслуживающий хлорное хозяйство
– такую фразу непременно выскажут сторонники гипохлорита. А гражданин РФ (потребитель питьевой воды) на это ответит: мне нужна качественная питьевая вода, а защита персонала – проблема водоканалов, соблюдайте требования ПБ09-594-03
. А эрудит добавит: Правила безопасности при производстве, хранении, транспортировании и применении хлора
и все будет в порядкенаденьте персоналу, в крайнем случае, противогаз, так как благодаря его изобретению хлор никогда больше не применялся в войнах в качестве боевого отравляющего вещества
.
А к вопросу опасности гипохлорита своевременным является решение, вынесенное на совещании Ростехнадзора по теме: Состояние и перспективы развития хлориспользующих объектов систем водоподготовки ЖКХ
в апреле 2008 года, в котором отмечалось, что объекты, на которых применяются привозные или произведенные на месте гипохлорит натрия, двуокись хлора и озон, являются опасными и к ним применяются требования Федерального закона No 116-ФЗ О промышленной безопасности опасных производственных объектов
. Это получило свое отражение в редакции этого закона No313-ФЗ от 30.12.2008 года.
Так в чем же собственно достоинства гипохлорита? Пока таковых не обнаружено. Может что-то подскажут или докажут оппоненты?
И в заключение хочется поделиться своими научно обоснованными выводами о месте хлора на планете Земля.
Общеизвестно, что человек на 80 процентов состоит из воды. А в свете вышерассмотренных вопросов уместно спросить, а каково значение рН этой воды? И здесь открываются очень интересные факты. Так, согласно БСЭ [8], в норме pH крови человека поддерживается в пределах 7,35-7,47, несмотря на поступление в кровь кислых и основных продуктов обмена веществ Постоянство pH внутренней среды организма — необходимое условие нормального течения жизненных процессов. Значения pH крови, выходящие за указанные пределы, свидетельствуют о существенных нарушениях в организме, а значения ниже 6,8 и выше 7,8 несовместимы с жизнью
. Более того, pH большинства тканевых жидкостей организма поддерживается на уровне 7,1-7,4
. Оба этих диапазона гарантированно входят в центральную (самую антибактерицидную) часть метастабильной зоны (см. рис.1). Эти факты провоцируют вполне целенаправленные дальнейшие рассуждения.
Если мы с пищей употребляем поваренную соль (NaCl), то последняя, попадая в организм человека, взаимодействует с находящейся там водой ( H2O ), образуя чистый хлор, а именно:
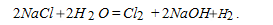
А теперь смотрим на диаграмму рис.1. Так как вода в организме человека имеет рН=7,1-7,47, то появившийся хлор попадает в метастабильную зону и придает раствору наивысшую антибактерицидную активность. Отсюда следует, что хлор защищает наш организм (с уверенностью можно сказать: и другие организмы) от разрушающего воздействия микроорганизмов. Теперь становиться понятна фраза в БСЭ: Суточная потребность взрослого человека в хлоре (2-4 г) покрывается за счет пищевых продуктов
. Именно суточная потребность
, так как хлор расходуется на уничтожение опасных для человека микроорганизмов и, соответственно, должен восполнятся.
Закрепить эти выводы можно ссылкой на последние результаты исследований в этой области. Исследованиями последних десятилетий установлено, что все высшие многоклеточные организмы, включая человека, синтезируют в особых клеточных структурах (микросомы гепатоцитов, эндоплазматический ретикулум фагоцитов) хлорноватистую кислоту и высокоактивные метастабильные хлоркислородные и гидропероксидные соединения (метастабильную смесь оксидантов) для борьбы с микроорганизмами и чужеродными субстанциями [1 , 3 , 9]. Этот механизм антибактериальной защиты, созданный Природой, функционирует во внутренней среде организма животных и человека на протяжении миллионов лет без каких-либо сбоев [10].
Наши рассуждения и наши выводы настолько прозрачны и настолько очевидны, что не должны вызывать ни у кого, даже у оппонентов, никаких противоречивых ассоциаций. Конечно, хотелось вместе с ними более подробно остановиться на некоторых вопросах, но издательские рамки ограничивают эти желания, но не запрещают нам углубить наши познания в этой области и поделиться ими в следующих публикациях.
Литература
1. Кожевников А. Б., Петросян О. П. Для тех, кому не нравится хлор // СтройПРОФИль
, 2004, No4/1
2. Кожевников А. Б., Петросян О. П. Хлорирование – микробиологическая и техническая безопасность водоподготовки // Материалы XII Международной научно-практической конференции Проблемы управления качеством городской среды
. Водная безопасность поселений России, г.Москва, 2008г.
3. Бахир В. М. К проблеме поиска путей промышленной и экологической безопасности объектов водоподготовки и водоотведения ЖКХ// Водоснабжение и канализация. No 1, 2009г.
4. Краснобородько И. Г. Деструктивная очистка сточных вод от красителей. Л.: Химия, 1988.-193 с.
5. Арчаков А. И., Карузина И. И. Окисление чужеродных соединений и проблемы токсикологии, Вестник АМН СССР. 1998. No 1. С. 14-28
6. Фесенко Л. Н., Скрябин А. Ю., Игнатенко С. И. Внедрение экологически безопасных технологий обеззараживания питьевой воды в г. Ростове-на-Дону // Материалы V международной научно-практической конференции ТЕХНОВОД-2009. Технологии очистки воды
, г.Кисловодск, 2009 г.
7. Методические рекомендации по расчету и проектированию электролитических установок Хлорэфс
для получения низкоконцентрированного раствора гипохлорита натрия: учеб. пособие/ Л. Н. Фесенко [и др.]; Юж.-Рос. гос. Техн. Ун-т.-Новочеркасск: ЮРГТУ (НПИ), 2009.-99с.
8. Ле Шателье – Брауна принцип — Большая Советская Энциклопедия. Третье издание 1970-1977 гг.
9. Лопаткин Н. А., Лопухин Ю. М. Эфферентные методы в медицине (теоретические и экспериментальные аспекты экстракорпоральных методов лечения). М.: Медицина, 1989.
10. М. Бахир, Леонов Б. И., С. А. Паничева, В. И. Прилуцкий, Н. Ю. Шомовская. Химический состав и функциональные свойства хлорсодержащих дезинфицирующих растворов // Вестник новых медицинских технологий, No4, 2003.