Реферат по теме выпускной работы
Содержание
- Введение
- 1. Актуальность темы
- 2. Цель магистерской диссертации и задачи исследований
- 3. Объект и методы исследования
- Заключение
- Список источников
Введение
Биотопливо – топливо из растительного или животного сырья, из продуктов жизнедеятельности организмов или органических промышленных отходов. Различается жидкое биотопливо (для двигателей внутреннего сгорания, например, этанол, метанол, биодизель), твёрдое биотопливо (дрова, брикеты, топливные гранулы, щепа, солома, лузга) и газообразное (синтез–газ, биогаз, водород). 54–60% биотоплива составляют его традиционные формы: дрова, растительные остатки и сушёный навоз для отопления домов и приготовления пищи. Их используют 38% населения Земли [2].
Расширению использования биотоплива способствуют обязательные нормы, требующие иметь определённый процент биотоплива в энергопотреблении. Жизнь людей невозможна без употребления топлив. Различают две группы топлив:
- топлива, добываемые из земных недр (ископаемые топлива);
- топлива, получаемые из наземного сырья (их принято называть биотопливами).
Основное различие между данными группами топлив состоит в том, что сжигание ископаемых топлив приводит к увеличению содержания углекислого (т. н. парникового) газа в атмосфере Земли (углерода в Земле становится меньше, а в атмосфере – больше); сжигание же топлив второй группы не увеличивает содержания углекислого газа в атмосфере (например, при сжигании древесины в атмосферу вводится ровно углекислого газа, сколько было изъято из атмосферы в процессе роста древесины за счёт фотосинтеза) [1].
Очевидно, что самым перспективным видом сырья для производства биотоплива являются водоросли. Водоросли являются самыми быстрорастущими растениями на земле (масса за сутки удваивается), для их роста требуется легкодоступное сырье: солнечный свет, вода и диоксид углерода.
Микроводоросли могут выращиваться как в пресной воде, так и в соленой. Также для производства микроводорослей не требуется использование вредных пестицидов и гербицидов. Одно из основных преимуществ микроводорослей заключается в том, что они эффективно преобразуют энергию солнечного света в биомассу
Приставка био
в названии говорит, что в процессе получения биотоплива мы использовали углекислый газ. Нужно обратить внимание, что биотопливо – это CO2 – нейтральное топливо: при сжигании биотоплива образуется углекислый газ, но и при его получении столько же углекислого газа снова преобразуется в биомассу.
За последние 20 лет выбросы углекислого газа в атмосферу увеличились в полтора раза, и концентрация газа в атмосфере с каждым годом повышается. Можно предположить, что располагаемый на Земле фотосинтезирующий потенциал уже не справляется с теми выбросами углекислого газа, которые человечество производит. Углекислый газ, вода и энергия солнечного света в процессе фотосинтеза преобразуются в энергию связей химических соединений органического вещества и кислород.
Процесс фотосинтеза – это реакция, которая обусловливает круговорот углерода и кислорода в природе. По оценкам специалистов, до 80% всего кислорода на нашей планете производит в морях и океанах фитопланктон, то есть водоросли и цианобактерии, а оставшиеся 20% – наземные растения. Сегодня в научном сообществе есть большой интерес к микроводорослям как средству захвата углекислого газа и возобновляемому источнику биотоплива.
Самая распространенная – это микроводоросль Chlorella vulgaris.
Chlorella vulgaris – одноклеточная водоросль, обитающая в пресных и соленых водоемах, на влажной почве, скаллах. Клетки имеют вид зеленых шариков диаметром до 15 мкм. Жгутиков, глазков и сократительных вакуолей не имеет. В клетках имеется чашевидный хроматофор с пиреноидом или без него и мелкое ядро. Половой процесс для этой водоросли не известен. Бесполое размножение происходит путем митотического деления содержимого материнской клетки дважды или трижды.
В результате деления формируется четыре или восемь дочерних клеток. После разрыва материнской оболочки клетки выходят наружу, увеличиваются в размерах и делятся вновь.
Хлорелла интересна тем, что ее клетки содержат большое количество питательных веществ – 50 полноценных белков, жирные масла, углеводы, витамины В, С и К и даже антибиотики. Она размножается так интенсивно, что за сутки происходит тысячекратное увеличение числа ее клеток. Хлорелла стала первой водорослью, которую человек стал выращивать в культуре. Она использовалась в качестве экспериментального объекта для изучения некоторых этапов фотосинтеза.
1. Актуальность темы
Одна из актуальных проблем современности является поиск альтернативных видов источников энергии. Одним из них является жидкое топливо, среди них можно выделить разные виды биотоплива, в том числе наиболее актуальным является биотопливо получаемое из микроводорослей. Положительным моментом является, то что микроводоросль можно интенсивно выращивать в большом объеме, при чем технология этого процесса достаточно проста [3].
2. Цель магистерской диссертации и задачи исследований
Целью данной работы является: изучение процесса генезиса микроводорослей с определением его качественных показателей на экспериментальной установке.
Задачи:
- Определение показателей качества роста микроводорослей различными инструментальными методами.
- Сравнение и выбор лучшего инструментального метода.
3. Объект и методы исследования
В качестве объекта исследования применялась культуральная среда микроводорослей на различных стадиях. Главным отличием суспензии являлось интенсивность ее окраски, и поэтому на первом этапе необходимо определить реальное число клеток в единице объема (млн/мл).
Оценка продуктивности микроводоросли осуществляется по стандартной методике в качестве, которой применяется традиционная для световой микроскопии методика подсчета клеток культуры с помощью счетных камер (Горяева, Тома – Цейса) [5].
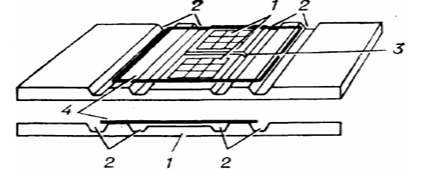
Рисунок 1 — Устройство двухсеточной камеры Горяева
1 – пластинки с выгравированными сетками; 2 – продольные желобки; средняя часть пластинки ниже боковых на 0,1 мм (глубина камеры) и разделена поперечным желобком (3); 4 – покровное стекло.
После тщательного перемешивания исследуемой жидкости берут ее образец и наносят на сетку счетной камеры, накрывают покровным стеклом размером 18 х 18 мм толщиной 0,25–0,35 мм и притирают покровное стекло к боковым пластинкам камеры до образования колец Ньютона. Притирают покровное стекло для того, чтобы высота слоя исследуемой жидкости в камере была 0,1 мм.
После заполнения камеры исследуемым образцом, ее помещают на столик микроскопа и находят в его поле зрения сетку. Подсчитывают все клетки микроорганизмов, находящиеся внутри большого квадрата, а также на пограничных линиях, если клетки большей частью находятся в данном квадрате. Если клетки пересекаются пограничной линией пополам, то клетки считают только на двух смежных сторонах квадратом. В каждом препарате подсчитывают клетки в пяти больших квадратах, например, по углам и в центре сетки.
Биореактор
Получение биотоплива из липидов содержащиеся в микроводорослях, является высокоэффективной биотехнологией и обладает значительным потенциалом.
Биореактор — аппарат, в котором осуществляется рост и развитие генезиса, а также перемешивание культуральной среды в процессе микробиологического синтеза.
Биореактор хлореллы на входе с емкостью готовой суспензии обеспечивает выполнение оптимальной технологии выращивания микроводорослей с получением качественного целевого продукта.
Установка имеет в своем составе блок определений количественных показателей с использованием приборов определения интенсивности цвета культурной среды (суспензии Хлореллы).
Высокая продуктивность микроводорослей зависит от следующих условий культивирования: световой режим, состав питательной среды, концентрация CO2, конструкции фотобиореакторов. Оптимальное сочетание все этих параметров позволит получить максимальный выход биомассы. CO2 — основной источник питания.
Значение необходимой концентрации углекислого газа в газовоздушной смеси зависит от используемого штамма, конструкции фотобиореактора и режима культивирования. Углекислый газ вводится в фотобиореакторы с воздухом или в чистом виде из баллонов.
Концентрация углекислого газа зависит от плотности клеток микроводорослей в суспензии. Так, при плотности клеток хлореллы 100–150 млн/мл углекислотное насыщение фотосинтеза происходит при концентрации CO2 в газовой смеси 0,2%, а при 4–5 млрд. — 4,5–5,5 %.
Наиболее влияющий на рост микроводорослей фактор — освещенность. Известно, что недостаток или избыток освещенности замедляет процесс фотосинтеза, что отрицательно сказывается на приросте биомассы.
Одним из наиболее перспективных направлений является использование закрытых фотобиореакторов с использованием искусственного света для освещения биомассы в тёмное время суток.
В настоящее время в качестве искусственных источников света применяются люминесцентные, натриевые, светодиодные (фито или биколор), галогеновые лампы, а также лампы накаливания [4].

Рисунок 2 — Культивирование микроводорослей
(анимация: 5 кадров, 5 циклов повторения, 326 килобайт)
Фотографический метод
Значительным преимуществом фотографического метода является его документальность, так как фотографическая пластинка со спектром может быть сохранена. Кроме того, метод отличается высокой абсолютной чувствительностью и достаточной при определении низких концентраций воспроизводимостью [4].
Фотографический метод – метод изучения различных явлений происходящих в природе, заключающийся в запечатлении явления на фотографии или серии фотографий, которые в дальнейшем подвергаются анализу со стороны специалистов. Проведем имитацию процесса генезиса, чтоб определить зависимость красителя, как количество красителя влияет на интенсивность и цветовую интенсивность исследуемой суспензии. В одну наливаем 1мл и получаем 20 млн клеток; во вторую 3мл — 60 млн клеток, в третью 5мл — 100 млн клеток. Далее будем работать с графическим редактором. Нужно залить фото с пробирками, навести на центр фото и получим результат значения трех составляющих цвета R (красный), G (зеленый), B (синий). Используется значение G для построения графиков.

Рисунок 3 — Пробирки с разным количеством красителя
Фотоколориметрический метод
Фотоколориметрический метод основан на определении содержания веществ в растворах по поглощению немонохроматического излучения света в видимой области спектра. Этим методом можно по интенсивности окраски раствора установить концентрацию определяемого вещества в растворе [4].
Для этого нам понадобится: три пробирки с веществом, датчик цвета TCS230, Arduino UNO, программное обеспечение для Arduino UNO.
Соединим схему, сверху на датчик нужно по очереди поднести, каждую из пробирок, на экране в программе Arduino, мы увидим значения RGB. Далее нужно построить график и сделать вывод.
Датчик TCS230, расположенный в центре платы, состоит из фотодиодов четырёх типов: 16 фотодиодов с красным фильтром, 16 фотодиодов с зелёным фильтром, 16 фотодиодов с синим фильтром и 16 фотодиодов без светофильтра. К датчику подносят образец одного из трёх цветов — красного, зелёного или синего. Образец освещается светодиодами на плате вокруг датчика. Датчик имеет преобразователь тока в частоту, он преобразует показания фотодиодов в квадратную волну с частотой, пропорциональной интенсивности света выбранного цвета. Эта частота затем считывается Arduino.

Рисунок 4 — Рабочий вариант схемы люксметра
G1 — Фотографический метод, G2 — Фотоколориметрический метод.
Таблица 1 — Данные для фотографического и фотоколориметрического метода.
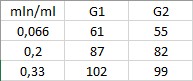
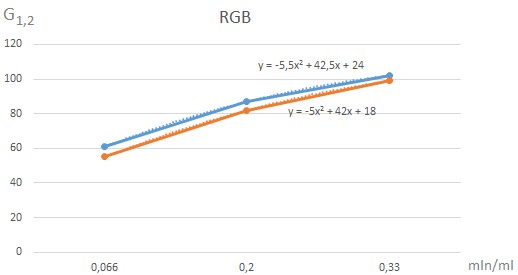
Рисунок 5 — Графики зависимости G1, G2 от количества красителя
Заключение
Таким образом, биодизель – топливо на основе жиров животного, растительного и микробного происхождения, а также продуктов их этерификации.
Для получения биодизельного топлива используются растительные или животные жиры. Сырьём могут быть рапсовое, соевое, пальмовое, кокосовое масло, или любого другого, а также отходы пищевой промышленности. Разрабатываются технологии производства биодизеля из водорослей.
Выбор подходящей среды является важным условием для успешного культивирования микроводорослей. Поэтому перед началом выделения самое пристальное внимание следует уделить выбору среды для культивирования.
Определение интенсивности цветовой компоненты(G1, G2), различными методами, показал, что характер зависимости имеют подобный характер.
Для фотографического и колориметрического метода, важной задачей данного исследования является определение количества микроводоросли для получения биотоплива.
Список источников
- Основные тенденции развития рынка биотоплива в мире и России за период 2000–2012 годов. [Электронный ресурс]. URL: http://portal-energo.ru/files/...
- Биодизельное топливо. Производство биодизеля. [Электронный ресурс]. URL: http://amastercar.ru/articles/...
- Кулманаков, С. С. Перспективные смесевые кислородсодержащие топлива / С. С. Кулманаков, Д. Д. Матиевский, А. И. Балашев, С. В. Лебедевас // Ползуновский Вестник. – 2009 г. – №1–2. – С. 17–21.
- Попова, И. Ю. Методы биотоплива / И. Ю. Попова // Сверхкритические Флюиды: Теория и Практика. – 2007 г. Т. 2. – № 4. – C. 85–95.
- Иманкулов, Н. Н. Фотокалориметрический метод / Н. Н. Иманкулов, О. С. Балабеков // Материалы научно–практической конференции Нефтехимия и нефтепереработка. Уфа, 2008 г.
- Виноградова, А. В., Биотехнология топлива: учеб. пособие / А. В. Виноградова, Г. А. Козлова, Л. В. Аникина. – Пермь: Изд–во Перм. гос. техн. ун–та, 2008. – 212 с.
- Особенности производства биодизеля. [Эдектронный ресурс]. – Режим доступа: http://www.cleandex.ru/articles/...
