Анализ возможностей лазерного флуоресцентного метода контроля состояния растений в стрессовых ситуациях, вызванных различными механическими повреждениями
О.А. Булло, Ю.В. Федотов, М.Л. Белов, В.А. Городничев
МГТУ им. Н.Э. Баумана, Москва, Россия
Аннотация
Статья посвящена разработке лазерного флуоресцентного метода контроля состояния растений. Приведены результаты экспериментальных исследований спектров лазерно‑индуцированной флуоресценции растений при длине волны возбуждения флуоресценции 532 нм. Показано, что воздействие стрессового фактора, вызванного различными механическими повреждениями растений, может проявляться в изменении формы спектра флуоресценции. Идентифицирующим фактором, характеризующим изменение формы спектра лазерно‑индуцированной флуоресценции, может быть отношение интенсивностей флуоресценции на двух длинах волн 680 и 740 нм. Измерение этого идентифицирующего фактора может быть положено в основу лазерного метода обнаружения стрессовых состояний растений.
Введение
Флуоресцентный анализ широко используется в науке и тех нике в качестве высокочувствительного аналитического средства. На сегодняшний день одним из наиболее перспективных направлений использования флуоресцентного анализа является контроль состояния растительности (см., например, [1–17]).
Основной составляющей флуоресцентного излучения живого листа в красном и дальнем красном диапазонах является флуоресценция хлорофилла а. При комнатной температуре этот спектр флуоресценции имеет два максимума – основной в области 680–690 нм (красный) и минорный – в области 730–740 нм (дальний красный). При этом флуоресценция в красном диапазоне и большая часть флуоресценции дальнего красногодиапазона практически полностью определяется фотосистемой (ФС) II, см., например, [18].
Неблагоприятные внешние факторы приводят к стрессовым ситуациям для растений и невозможности их нормального роста. Для растения в стрессовом состоянии процесс фотосинтеза нарушается и картина флуоресценции изменяется (по сравнению с растением в нормальном состоянии). Причем спектр флуоресценции при этом зависит от многих факторов – вида стресса, вида растения, длины волны возбуждения и др. Окончательной ясной картины в настоящее время нет, поскольку стресс растений явление сложное (см., например, [19]).
Эффективным методом обнаружения стрессовых состояний растительности является метод лазерной индуцированной флуоресценции (см., например, [1–17]).
1. Постановка задачи
Число работ, в которых приводятся результаты экспериментальных исследований спектров флуоресценции растительности в нормальном и стрессовом состояниях довольно велико. Однако, большинство работ в этой области посвящено контролю стрессовых состояний растений, вызванных недостаточным уровнем питательных веществ или наличием загрязнителей в почве. В настоящее время имеются лишь отдельные экспериментальные работы, посвященные исследованию спектров флуоресценции растений в стрессовых состояниях, вызванных различными механическими повреждениями растений.
На сегодняшний день накоплены экспериментальные данные по спектрам флуоресценции различных видов здоровой растительности и растительности в различных стрессовых при разных длинах волн возбуждения от 266 до 635 нм. Наибольшее количество экспериментальных работ, посвященных лазерно‑индуцированной флуоресценции растений, приходится на длины волн возбуждения 337, 335 и 532 нм.
Статья посвящена экспериментальному исследованию изменений спектра лазерно‑ индуцированной флуоресценции при различных механических повреждениях растений для длины волны возбуждения флуоресценции 532 нм (для длины возбуждения 532 нм таких работ совсем мало [14, 17].). Такая задача представляет практический интерес для оценки возможности контроля состояния растений (например, сельскохозяйственных культур) по результатам дистанционного измерения спектра флуоресценции растений.
2. Эксперимент
Для измерения спектров флуоресценции была создана лабораторная установка, структурная схема которой представлена на рис. 1.
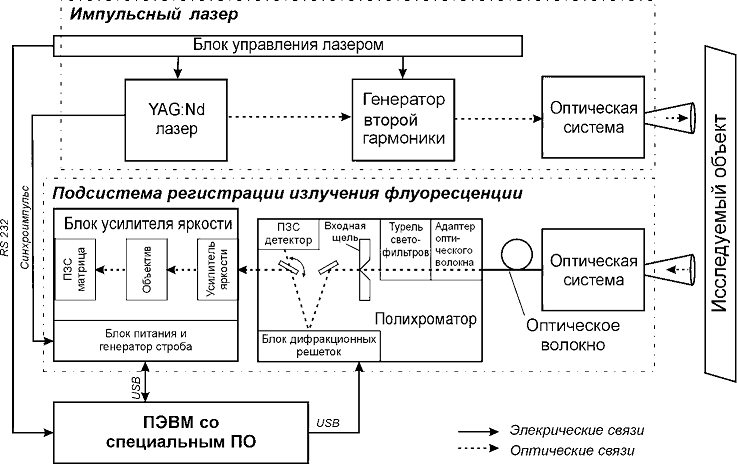
Рисунок 1 – Схема лабораторной установки
В качестве источника возбуждения излучения флуоресценции был использован твердотельный импульсный YAG:Nd лазер с диодной накачкой и с удвоением частоты.
Излучение флуоресценции собирается приемным объективом и вводится в оптическое волокно (диаметр сердечника которого 600 мкм) ахроматическим адаптером оптического волокна FA‑1. Адаптер оснащен оптическим разъемом типа SMA‑905 для присоединения волокна и позволяет проводить юстировку в трех плоскостях.
В качестве спектрального прибора используется полихроматор. Полихроматор полностью автоматизирован: смена решеток, оптических фильтров, выбор ширины входной щели осуществляется автоматически.
Спектр флуоресценции регистрируется высокочувствительным матричным детектором с усилителем яркости.
После усилителя яркости изображение переносится оптической системой на ПЗС детектора. Детектор преобразует изображение в цифровой массив и по интерфейсу USB 2.0 передает этот массив на компьютер.
Для управления установкой использовалось специальное программное обеспечение, реализованное в среде визуального программирования LabVIEW.
Основные параметры лабораторной установки приведены в таблице 1.
| Параметр | Значение параметра |
|---|---|
| Энергия импульса лазера, мДж | 22,1 |
| Длина волны возбуждения, нм | 532 |
| Длительность импульса лазера, нс | <7 |
| Частота повторения, Гц | до 500 |
| Диапазон регистрации спектра, нм | 595 – 800 |
| Разрешение по спектру, нм | 6 |
| Диаметр приемного объектива, мм | 15 |
Объектом исследования в статье были изменения в спектрах лазерно‑ индуцированной флуоресценции растений, при воздействии на растения различных видов механических повреждений: обрезание листьев растения; повреждение корней; примятие листьев
Экспериментальные исследования проводились для быстрорастущих и неприхотливых видов растений (в статье приведены данные для салата, как примера сельскохозяйственных культур).
Экспериментальное исследование спектров флуоресценции включало в себя как предварительный этап калибровку оборудования. Калибровка измерительной аппаратуры состояла из следующих этапов:
1). Калибровка полихроматора по длине волны с использованием стандартной методики и калибровочного источника света на основе ртутно‑аргоновой лампы с линейчатым спектром. Проверка проводилась по трем длинам волн (253,65 нм; 435,85 нм; 696,54 нм). В случае наличия недопустимого уровня погрешностей по длине волны, большего 0,5 нм, осуществлялась перекалибровка подсистемы регистрации по длине волны.
2). Измерение фоновых шумов детектора на основе усилителя яркости при тех же параметрах, при которых впоследствии проводилась регистрация спектров флуоресценции. Регистрация фоновых шумов осуществлялась при закрытом затворе полихроматора, результирующее распределение фоновых шумов по каналам детектора определялось в результате усреднения по 100 измерениям. Полученное распределение фоновых шумов записывалось в файл и в дальнейшем вычиталось из измеряемых спектров, что позволило частично устранить их влияние и тем самым повысить отношение сигнал‑шум.
3). Калибровка системы регистрации по чувствительности в диапазоне от 250 до 750 нм осуществлялась по стандартной методике с помощью калиброванного источника света DH2000‑CAL.
Для измерения спектров флуоресценции использовалась ширина щели полихроматора равная 200 мкм, что обеспечивало спектральное разрешение 5 нм.
3. Анализ полученных экспериментальных данных
Первая фаза стресса растений – первичная индуктивная стрессовая реакция [18, 19]. Для этой стадии характерно уменьшение интенсивности фотосинтеза, что сопровождается существенным увеличением интенсивности флуоресценции хлорофилла.
Возрастание квантового выхода флуоресценции в этом случае обусловлено уменьшением эффективности первичных процессов фотосинтеза – поглощенная световая энергия не используется в фотосинтезе, поэтому интенсивность флуоресценции возрастает (т.е. интенсивность флуоресценции может быть показателем стрессового состояния растения).
Увеличение интенсивности флуоресценции характерно для данных измерений спектров при механическом повреждении растений (см., например, [14, 17])
В тоже время по имеющимся данным для растений в стрессовом состоянии колебания активности ФС II могут приводить к изменениям отношения интенсивностей флуоресценции в красной и дальней красной области (т.е. к изменению формы спектра флуоресценции) [18].
Этот эффект хорошо виден из результатов работ [9, 11]. В этих приведены экспериментальные данные для длины волн возбуждения 532 нм при стрессах, связанных с недостатком азотных удобрений и внесением в почву различных загрязнителей.
Эффект изменения отношения интенсивностей флуоресценции в красной и дальней красной области для механических повреждений растений и длины волн возбуждения 532 нм хорошо иллюстрирует рисунок 2.
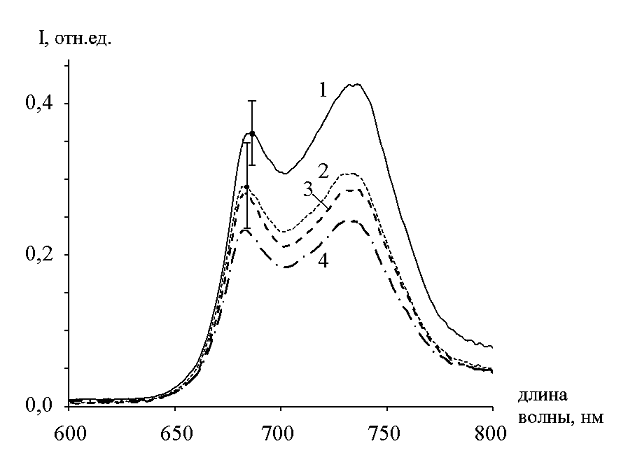
Рисунок 2 – Спектры лазерно‑индуцированной флуоресценции для кресс‑салата при различных механических повреждениях.
На рисунке 2 приведены спектры лазерно‑индуцированной флуоресценции кресс‑ салата в нормальном состоянии (кривая 1) и стрессовом состоянии, вызванном примятием листьев салата (кривая 2), обрезанием листьев салата (кривая 3) и механическим повреждением корней растения (кривая 4). Кривая 1 соответствует усредненному (по разным измерениям) спектру контрольных экземпляров растений (в нормальном состоянии). Кривые 2,3,4 – усредненным (по разным измерениям) спектрам экземпляров растений в стрессовых состояниях (в интервале времени от 20 мин до 40 минут после механического повреждения). Вертикальные линии показывают доверительные интервалы (при доверительной вероятности 99%) для контрольного спектра 1 и спектра 2 для стрессового состояния, вызванного примятием листьев салата (доверительные интервалы для спектров 3 и 4 имеют тот же порядок, что и спектра 2).
Из рисунка 2 видно, что интенсивность флуоресценции для растений в стрессовом состоянии для данной конкретной серии экспериментов в среднем даже несколько меньше интенсивности флуоресценции для растений в нормальном состоянии (а для отдельных измеренных спектров интенсивность флуоресценции в стрессовом состоянии может быть как больше, так и меньше интенсивности флуоресценции для нормального состояния).
Усреднение данных для рисунка 2 проводилось по времени измерения и по разным образцам растений – по 18 измерениям для контрольных экземпляров растений и по 12 – для растений в стрессовом состоянии. При этом положение лазерного пятна (на растении) для разного времени измерения и для разных образцов растений было случайным. Это приводило к разбросу значений интенсивности флуоресценции для разных измерений: мы связываем разброс интенсивности флуоресценции с тем, что некоторая (случайная) часть лазерного пятна попадала на почву, флуоресценция от которой была на порядок меньшей, чем от растений.
Однако, несмотря на значительный разброс значений интенсивности форма спектров флуоресценции (в пределах каждой из групп – растений в нормальном или стрессовом состоянии) изменяется несущественно. Во всех экспериментах при стрессовом состоянии растений существенно увеличивается отношение интенсивностей флуоресценции на длинах волн 680 и 740 нм.
На рисунке 3 приведено усредненное (по разным измерениям) отношение I740/I680 интенсивностей флуоресценции на длинах волн 680 и 740 нм. Обозначения те же, что и на рисунке 3 (только теперь они относятся не к спектрам флуоресценции, а к столбцам, характеризующим отношение I740/I680). Вертикальные линии также показывают доверительные интервалы (при доверительной вероятности 99%) для отношения I740/I680.
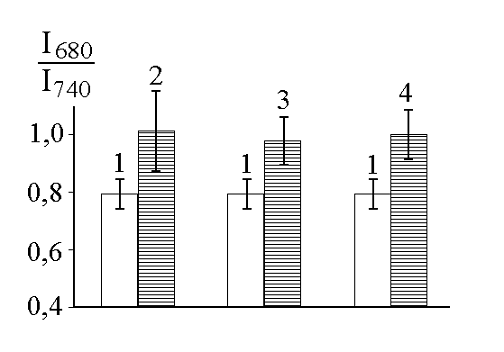
Рисунок 3 – Величина отношения I740/I680 для кресс‑салата при различных механических повреждениях
Из рисунка 3 видно, что величина I740/I680, характеризующая форму спектра флуоресценции, существенно отличается для контрольных образцов растений и растений в стрессовых состояниях.
Это говорит о потенциальной возможности использования отношения интенсивностей флуоресценции в красной и дальней красной области как показателя, отражающего стрессовые состояния, вызванные механическими повреждениями растений.
Заключение
Таким образом, экспериментальные исследования показывают, что при длине волны возбуждения флуоресценции 532 нм воздействие стрессового фактора, вызванного различными механическими повреждениями растений, может проявляться в изменении формы спектра флуоресценции. Это потенциально позволяет обнаруживать стрессовые состояния растений, вызванные механическим повреждением, лазерным флуоресцентным методом.
Список литературы
1. Gouveia‑Neto A.S., Silva E.A., Oliveira R.A., Cunha P.C., Costa E.B., Camara T.J.R.,
Willadino L.G. Water deficit and salt stress diagnosis through LED induced chlorophyll fluorescence
analysis in Jatropha curcas L. oil plants for biodisiel // Proc. of SPIE. 2011. Vol.
7902. Р. 79020А‑1 – 79020А‑10.
2. Burling K., Hunsche M., Noga G. Use of blue–green and chlorophyll fluorescence measurements
for differentiation between nitrogen deficiency and pathogen infection in winter
wheat // Journal of Plant Physiology. 2011. Vol. 168. Р. 1641–1648.
3. Афонасенко А.В., Иглакова А.И., Матвиенко Г.Г., Ошлаков В.К., Прокопьев В.Е.
Лабораторные и лидарные измерения спектральных характеристик листьев березы в
различные периоды вегетации // Оптика атмосферы и океана. 2012. Т. 25, № 3. С. 237–
243.
4. Panneton B., Guillaume S., Roger J.M., Samson G. Improved Discrimination Between
Monocotyledonous and Dicotyledonous Plants for Weed Control Based on the Blue‑Green
Region of Ultraviolet‑Induced Fluorescence Spectra // Applied Spectroscopy. 2010. Vol. 64,
no. 1. Р. 30–36.
5. Panneton B., Guillaume S., Roger J.M., Samson G. Discrimination of Corn from Monocotyledonous
Weeds with Ultraviolet (UV) Induced Fluorescence // Applied Spectroscopy.
2011. Vol. 65, no. 1. Р. 10–19.
6. Grishaev M. V., Sal’nikova N. S. A Setup for Remote Recording of the Spectrum of Laser‑
Induced Fluorescence from Crowns of Woody Plants // Instruments and Experimental Techniques.
2010. Vol. 53, no. 5. P. 746–749.
7. Gouveia‑Neto A.S., da Silva E.A., Cunha P.C., Oliveira‑Filho R.A., Silva L.M. H., da Costa
E.B., Camara T.J.R., Willadino L.G. Plant abiotic stress diagnostic by laser induced chlorophyll
fluorescence spectral analysis of in vivo leaf tissue of biofuel species // Proc. of SPIE.
2010. Vol. 7568. Р. 75680G‑1 – 75680G‑8.
8. Zhi‑qiang C., Wen‑li C. Effects of NaCl on photosynthesis in Arabidopsis and Thellungiella
leaves based on the fluorescence spectra , the fast Chlorophyll Fluorescence Induction Dynamics
Analysis and the delayed fluorescence technique// Proc. of SPIE. 2010. Vol. 7568. Р.
756822‑1 – 756822‑8.
9. Middleton E., McMurtrey J.E., P.K.E. Campbell P.K.E., Corp L.A., Butcher L.A., Chappelle
E.W. Optical and fluorescence properties of corn leaves from different nitrogen regimes //
Proc. of SPIE. 2003. Vol. 4879. Р. 72 – 83.
10. Fateeva N.L., Matvienko G. G. Application of the method of laser‑induced fluorescence //
Proc. of SPIE. 2004. Vol. 5232. Р. 652 – 657.
11. Matvienko G., Timofeev V., Grishin A., Fateyeva N. Fluorescence lidar method for remote
monitoring of effects on vegetation // Proc. of SPIE. 2006. Vol. 6367. Р. 63670F‑1 –
63670F‑8.
12. Н.Л. Фатеева, А.В. Климкин, О.В. Бендер, А.П. Зотикова, М.С. Ямбуров,
Исследование лазерно‑индуцированой флуоресценции хвойных и лиственных
растений при азотном загрязнении почвы // Оптика атмосферы и океана. 2006. Т. 19,
№ 2–3. С. 212 – 215.
13. Maurya R., Prasad S.M., Gopal R. LIF technique offers the potential for the detection of
cadmium‑induced alteration in photosynthetic activities of Zea Mays L. // Journal of Photochemistry
and Photobiology C: Photochemistry Reviews. 2008. Vol. 9. P. 29–35.
14. Belasque J., Gasparoto M.C.G., Marcassa L.G. Detection of mecanical and disease stresses
in citrus plants by fluorescence spectroscopy // Applied Optics. 2008. Vol. 47, no. 11, Р.
1922‑1926..
15. Креков Г.М., Крекова М.М, Лисенко А.А., Матвиенко Г.Г. Статистическое
моделирование лазерно‑индуцированной флуоресценции в растительных покровах //
Журнал прикладной спектроскопии. 2009. Т. 76, № 3. С. 411–418.
16. Corp L.A., McMurtrey J.E., Middleton E.M., Mulchi C.L., Chappelle E.W., Daughtry
C.S.T. Fluorescence sensing systems: In vivo detection of biophysical variations in field
corn due to nitrogen supply // Remote Sensing of Environment. 2003. Vol. 86. Р. 470–479.
17. Федотов Ю.В., Булло О.А., Белов М.Л., Матросова О.А., Городничев В.А.
Экспериментальное исследование лазерного флуоресцентного метода контроля
состояния растений в стрессовых состояниях, вызванных механическими
повреждениями // Наука и образование. МГТУ им. Н.Э. Баумана. Электрон. журн.
2012. № 11. С. 321–334. DOI: 10.7463/1112.0480063
18. Лысенков В.С., Вардуни Т.В., Сойер В.Г., Краснов В.П. Флуоресценция хлорофилла
растений как показатель экологического стресса: теоретические основы применения
метода // Фундаментальные исследования. 2013. № 4. С. 112–119.
19. Яковец О.Г. Фитофизиология стресса. Минск: БГУ, 2010. 103 с.