Реферат по теме выпускной работы
Содержание
- Введение
- 1 Дефосфорация стали
- 1.1 Дефосфорация стали в восстановительных условиях
- 1.2 Дефосфорация стали в вакууме
- 1.3 Дефосфорация стали в высоколегированных сталях
- Список использованных источников
Введение
Фосфор попадает в сталь главным образом с исходным чугуном, используемым для выплавки стали.
Фосфор обладает большой склонностью к ликвации, поэтому даже при незначительном среднем количестве фосфора в отливке всегда могут образоваться участки, богатые фосфором.
Расположенный вблизи границ фосфор повышает температуру перехода в хрупкое состояние (хладноломкость). Поэтому фосфор, как и сера, является вредной примесью, содержание его в углеродистой стали допускается до 0.050% [1].
Сегрегация фосфора (Р) в значительно меньшей степени, чем серы и углерода, происходит в ходе затвердевания сталей. Чем больший процент фосфора содержит сталь, тем выше ее хладноломкость и ниже ударная вязкость, пластичность.
Высокая температура среды позволяет достичь растворимости фосфора в пределах 1,2 %. Чем ниже становится температура, тем меньше растворимость фосфора. Она постепенно опускается до 0,02–0,03 %. Это может говорить о том, что он, как правило, полностью растворяется в альфа-железе.
Отпускная хрупкость хромистых, хромоникелевых и хромомарганцевых, марганцевых и магниево-кремниевых легированных сталей во многом зависит от сегрегации фосфора по границам зерен. Элемент способствует замедлению распада мартенсита и повышает упрочняемость.
Наличие фосфора в хромоникелевых аустеничных сталях приводит к увеличению предела текучести. При попадании аустеничной нержавеющей стали в среду сильного окислителя присутствие в ее составе фосфора вызывает коррозию на границах зерен. Такое поведение предопределено сегрегацией фосфора на этих границах [2].
Далее рассмотрим принципы удаления фосфора при различных условиях.
1 Дефосфорация стали
1.1 Дефосфорация стали в восстановительных условиях
Данная технология дефосфорации перспективна для сталей, содержащих в своем составе значительные количества хрома, марганца, углерода или других активных элементов.
По классической технологии удаление фосфора из жидкой стали протекает в период, обозначаемый условно с момента окончания расплавления шихты до кислородной продувки ванны. Наряду с фосфором в это же время окисляется заметная часть содержащихся в стали дорогостоящих легирующих, которые теряются безвозвратно с удаляемым из печи шлаком.
По новой технологии предлагается рафинировать металл от фосфора в восстановительный период плавки. В этом случае дефосфорацию стали осуществляют после проведения операции по раскислению и десульфурации металла либо совмещают с этими процессами. В результате угар элементов практически отсутствует, а рафинировочный шлак содержит минимальные количества оксидов ценных легирующих.
В качестве дефосфораторов применяют металлы щелочной и щелочно-земельной группы либо их соединения. Так, при использовании кальция процесс удаления фосфора из жидкого железа описывается реакцией 3(Са) + 2[Р] = (Са2Р2), а изменение стандартной свободной энергии AF° = 88230 + 40,4Г, кал.
Полноте развития рафинировочного процесса способствует понижение температуры ванны. Расчеты показали, что уменьшение температуры металлического расплава на 100 °C снижает равновесную концентрацию фосфора в стали более чем в 2 раза. Таким образом, температурный фактор имеет важное значение для успешного осуществления восстановительной дефосфорации стали.
Известно также, что кальций обладает значительно большим сродством к кислороду, чем к фосфору. Поэтому для преимущественного соединения кальция с фосфором необходимы безокислительные условия. Практически обеспечить их можно за счет глубокой раскисленности металлической ванны, низкого содержания монооксида железа в шлаковой фазе и минимального содержания кислорода в печной атмосфере.
Приведенная реакция является обратимой. Поэтому при изменении указанных условий возможна рефосфорация металла. Отсюда важное значение приобретает продолжительность обработки ванны реагентом-дефосфоратором. На эффективность дефосфорации может также оказывать влияние и способ ввода кальция в печь.
После определения необходимых технологических параметров процесс восстановительной дефосфорации был опробован в 0,3т плазменнодуговой печи постоянного тока на экспериментальной базе ЦНИИчермета и в 3т дуговой печи на одном из машиностроительных заводов. Плазмообразующим газом служил технически чистый аргон. В качестве дефосфорато ра применяли металлический кальций либо карбид кальция (последний главным образом для углеродистых сталей). Шихту составляли из 100% отходов стали заданной марки. После полного расплавления шихты шлак скачивали (полностью либо частично), в металл присаживали раскислители двух видов, затем наводили рафинировочный шлак из смеси извести и плавикового шпата, а также порошкообразного раскислителя в несколько измененной пропорции по сравнению с обычной технологией. Печь уплотняли. Далее в печь порциями в течение ~15 мин вводили дефосфоратор. После окончания реакции фосфорсодержащий шлак полностью удаляли из печи. Дальнейшие операции проводили по общеизвестной технологии.
Степень удаления фосфора из жидкой стали по новой технологии (в восстановительный период плавки) достигала 40%. При этом содержание легирующих элементов сохранялось неизменным. Одновременно с фосфором удалялось до 50% содержащейся в стали серы.
Опыты в 3т дуговой печи подтвердили эффективность новой технологии дефосфорации стали [3].
1.2 Дефосфорация стали в вакууме
Степень удаления фосфора заметно снижается при наличии оксидов железа в расплаве. Возможность удаления оксида фосфора из соединения с железом по реакции
12(FePO4)=4(Fe3O4)+6{P2O5}+{O2}
можно оценить, используя данные термодинамического моделирования программы HSC Chemistry 6.0 (рисунок 1)
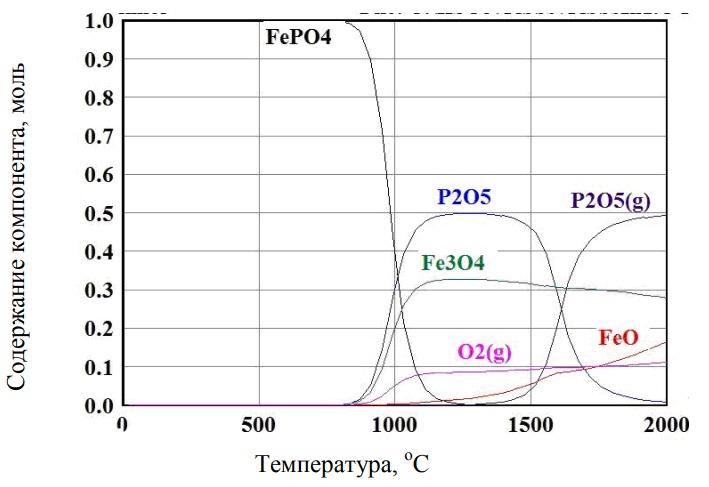
Рисунок 1 – Результаты термодинамического моделирования поведения фосфата железа в зависимости от температуры
На графике видно, что при Т=1500 °С прочных соединений фосфора и железа нет, и фосфор должен находиться в газообразном состоянии. Оценим температуру, при которой в такой системе давление P2O2(г)=1 атм и с учетом активностей компонентов в расплаве фосфор переходит в газовую фазу.
Температурную зависимость константы равновесия реакции можно определить, используя данные программы HSC Chemistry 6.0 (таблица 1).
Таблица 1 – Зависимость константы равновесия реакции от температуры
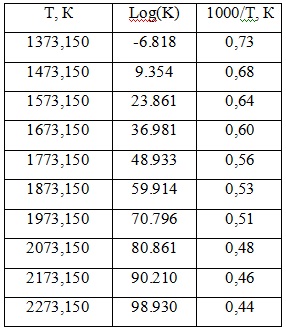
Температурная зависимость константы равновесия выражается уравнением:
![]()
Была получена зависимость возможности перехода фосфора в газовую фазу от температуры. При этом учитывалось, что Pp2o5=1 атм. Однако если процесс проводить в вакууме, то следует ожидать более полного протекания процесса удаления фосфора в газ. Аналогичное действие может оказывать продувка инертными или окислительными газами.
1.3 Дефосфорация стали в высоколегированных сталях
Можно выделить ряд направлений в решении проблемы удаления фосфора из высоколегированных расплавов, основанных на разбавлении шихты малофосфористыми материалами, дефосфорации электрохимическим методом, обработке шлаковыми смесями в восстановительных условиях, дефосфорации путем образования летучих соединений фосфора (галогенов, фосфина и др.), связывании фосфора фосфидообразующими элементами (В, Nb, Zr, V, Са, Mg, РЗМ).
Анализ экономических, технологических и экологических аспектов перечисленных способов позволяет заключить, что наиболее перспективными направлениями рафинирования высоколегированных сталей и ферросплавов от фосфора следует считать шлаковую дефосфорацию в слабоокислительных условиях, перевод этого элемента в газовую фазу и связывание его в устойчивые неметаллические включения типа фосфидов.
Для расплавов, где основными легирующими компонентами являются W, Сг и в определенной степени V, целесообразно проводить дефосфорацию в слабоокислительных условиях (10~14 атм.), что позволяет существенно упростить удаление фосфора и избежать заметного угара легирующих. Однако в этом случае использование традиционных печных шлаков оказывается неэффективным. Например, для стали типа Х18Н10 парциальное давление кислорода не должно превышать 10-12 атм. (это отвечает равновесию металлического расплава, содержащего 18 % Р, со шлаком, насыщенным Сг203 при 1823 К). При таких значениях р окислительная дефосфорация эффективно может осуществляться только с использованием флюсов, обладающих высокой фосфатной емкостью С. К таким рафинирующим смесям относятся системы СаО-CaF2; BaO-BaCl2: BaO-BaF2; NaO-SiО2; BaO-MnO, сорбционная способность которых по отношению к фосфору на 46 порядков превышает возможности печных шлаков.
Вместе с тем необходимо отметить нестабильность получаемых результатов по удалению фосфора из высокохромистых расплавов, что связано прежде всего с кинетическими затруднениями протекания процесса из-за гетерогенизации шлака и снижением его фосфатной емкости за счет перехода в него хрома из металла.
Дефосфорация за счет перевода фосфора в газовую фазу. На основе термодинамического анализа процесса дефосфорации коррозионностойкой стали типа Х18Н10 при обработке газовыми смесями, содержащими водяной пар, и шлаком с низким окислительным потенциалом, показана принципиальная возможность перевода фосфора из высоколегированного расплава в газовую фазу. Рассмотрены два механизма удаления фосфора: по первому фосфор в чистом виде либо в виде соединений переходит в газовую фазу; по второму фосфор сначала переходит в шлак, а далее в газовую фазу [4].
Процесс дефосфорации может быть облегчен, если в зону реакции искусственно ввести углерод, например, в виде графита.
Наиболее близки по технической сущности и достигаемому результату является способ дефосфорации стали в высокочастотной индукционной печи. Тигель магнезитовый. Печь дополнительно оборудована крышкой для изоляции плавящегося металла от воздушной атмосферы [5].
По способу-прототипу после полного расплавления и нагрева металла до требуемой температуры металл раскисляют алюминием на 0,3-0,4 %, печь накрывают крышкой, плавильное пространство заполняют аргоном с расходом 2 нм3/ч и на металл присаживают дефосфорирующую смесь, состоящую из Ca-CaF2, либо карбида кальция в количестве 20-25 кг/т и плавикового шпата в количестве 6-10 кг/т. После осуществления дефосфорации, продолжительность которой 10-20 мин фосфоросодержащий шлак скачивается из печи и подвергается окислению с целью предотвращения вредных выделений PH3 в атмосферу цеха. В итоге содержание фосфора в высокохромистой стали снизилось с 0,030 % до 0,016 % т.е. на 47 % [6].
Расчёт реакций выделения вредных газов PH2 в виде: P + 2H(g) = PH2(g) и PH3 в виде: Ca3P2 + 3H2O = 3CaO + 2PH3(g) в программе HSC Chemistry 5 показал следующие результаты (таблицы 2, 3):
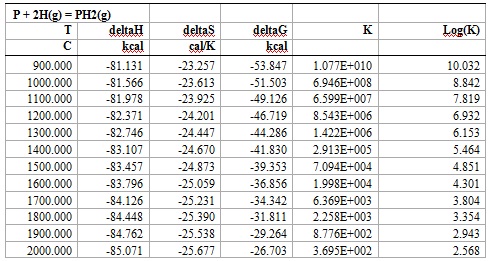
Таблица 2 – Результаты расчета реакций выделения вредны газов в программе HSC Chemistry 5
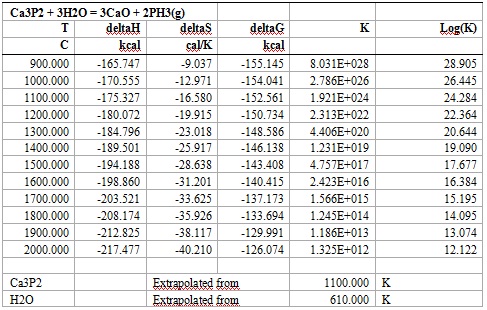
Таблица 3 – Характеристика веществ, задействованных в реакциях
Зависимость ΔG от температуры для двух реакций приведена на рисунках 1 и 2.
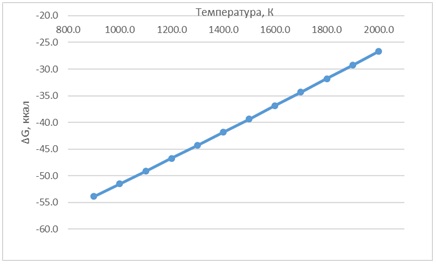
Рисунок 1 – Зависимость ΔG от температуры реакции P + 2H(g) = PH2
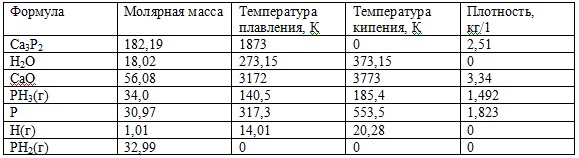
Рисунок 2 – Зависимость ΔG от температуры реакции Ca3P2 + 3H2O = 3CaO + 2PH3(g). Реакции протекают в сторону получения продуктов реакции. Характеристика веществ, задействованных в данных реакциях приведена в таблице 4 Таблица 4 – Характеристика веществ, задействованных в реакциях При написании данного реферата магистерская работа еще не завершена. Окончательное завершение: ноябрь 2021 года. Полный текст работы
и материалы по теме могут быть получены у автора или его руководителя после указанной даты.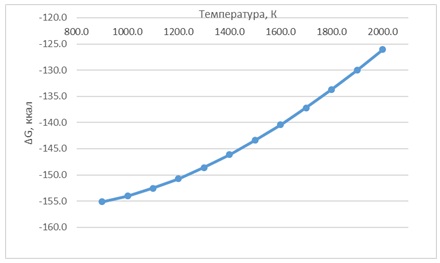
Список использованных источников
