Краснокутский Сергей Геннадиевич
Автореферат магистерской диссертации
"Исследование объемного поведения жидкой фазы системы g -бутиролактон -
диоксид углерода в околокритической области диоксида углерода".
Научный руководитель: доц. Матвиенко В.Г.
Донецк,2002 г.
Email автора//: sergkras2000@mail.ru/
Вследствие этого, исследование свойств системы g -бутиролактон - диоксид углерода имеет большое теоретическое значение для описания систем подобного рода и объяснения 'аномальной' сжимаемости жидкой фазы подобных систем при повышенных давлениях. Кроме того, информация об исследовании сжимаемости жидкой фазы двухкомпонентных систем при повышенных давлениях в литературе довольно ограничена [2,3].
Исследована сжимаемость чистых g -бутиролактона и диоксида углерода, предложены уравнения описывающие зависимость молярного объема g -бутиролактона от температуры и давления. Впервые изучена сжимаемость жидкой фазы двухкомпонентных растворов g -бутиролактон - диоксид углерода для составов примыкающих к чистому диоксиду углерода. Установлена повышенная сжимаемость двухкомпонентных жидких растворов, богатых диоксидом углерода по сравнению с чистым g -бутиролактоном. Также в исследуемой системе впервые обнаружена расслаиваемость на две жидкие фазы при температуре, которая выше критической температуры диоксида углерода.
В корпус малогабаритного вентиля 1, который снабжен деталью разъемного конусного соединения 2, вставлена на эпоксидной смоле цилиндрическая ампула 3. Корпус ампулы 3 изготовлен из прозрачного кварцевого стекла. Выбор этого материала обусловлен малым коэффициентом термического расширения и высокой прочностью кварцевого стекла. В широком температурном интервале объем ячейки остается практически постоянным. Кроме того, при дегазации и загрузке компонентов ячейка многократно погружается в жидкий азот и нагревается до комнатной температуры.
 Кварцевое стекло в отличие от обычного хорошо переносит тепловые удары. В ячейке находится мешалка 4 из ферромагнитного
металла (никеля), представляющая собой длинный колпачок с боковыми прорезями, который перемешивает
содержимое ячейки при перемещении кольцевого наружного магнита вдоль ее корпуса. Такая
конструкция мешалки повышает эффективность перемешивания и уменьшает время установления равновесия.
Масса ячейки с вентилем не превышает 60 г. Объем ячейки около 3 см3, внутренний диаметр 4,4 мм,
наружный 7,6 мм. Разрывное давление 22 МПа. Перед началом эксперимента ячейка калибруется по воде
с использованием катетометра.
Кварцевое стекло в отличие от обычного хорошо переносит тепловые удары. В ячейке находится мешалка 4 из ферромагнитного
металла (никеля), представляющая собой длинный колпачок с боковыми прорезями, который перемешивает
содержимое ячейки при перемещении кольцевого наружного магнита вдоль ее корпуса. Такая
конструкция мешалки повышает эффективность перемешивания и уменьшает время установления равновесия.
Масса ячейки с вентилем не превышает 60 г. Объем ячейки около 3 см3, внутренний диаметр 4,4 мм,
наружный 7,6 мм. Разрывное давление 22 МПа. Перед началом эксперимента ячейка калибруется по воде
с использованием катетометра.
Общая схема установки для исследования объемных свойств жидкой фазы системы g-бутиролактон - диоксид углерода при повышенных давлениях показана на рис.2. Установка включает в себя ячейку равновесия 3, термостат 6, разделитель масло-ртуть 10, масляный пресс 13, соединительную линию с вентилями и разъемными соединениями 8, 12, катетометр (на рис.2 не показан).Термостат 6 изготовлен из прозрачного плексигласа и имеет форму прямоугольного параллелепипеда.
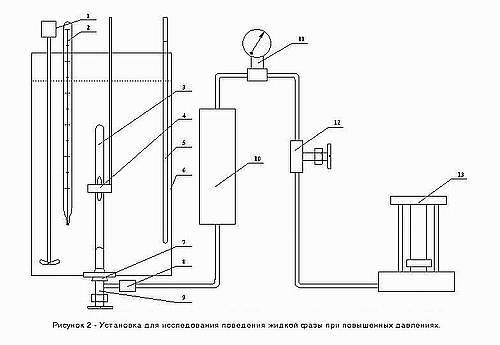 Такая форма придана термостату для того, чтобы при измерении высот равновесных фаз в ячейке не
происходило оптических искажений. Особенностью термостата является то, что ячейка равновесия 3
вставляется в него снизу на резиновой пробке 7, так что температура соединения кварцевое стекло-
металл остается комнатной в течение всего эксперимента.
В нижней части разделителя 10 находится ртуть, а верхней части масло, давление которого создается
масляным прессом 13 и измеряется образцовым манометром 11. С помощью катетометра измеряется высота
жидкой фазы в ячейке равновесия.
Такая форма придана термостату для того, чтобы при измерении высот равновесных фаз в ячейке не
происходило оптических искажений. Особенностью термостата является то, что ячейка равновесия 3
вставляется в него снизу на резиновой пробке 7, так что температура соединения кварцевое стекло-
металл остается комнатной в течение всего эксперимента.
В нижней части разделителя 10 находится ртуть, а верхней части масло, давление которого создается
масляным прессом 13 и измеряется образцовым манометром 11. С помощью катетометра измеряется высота
жидкой фазы в ячейке равновесия.
Температура воды в термостате измеряется нормальным термометром 2. Пропеллерная мешалка 1, приводимая в движение электродвигателем, перемешивает воду в термостате. Температуру воды в термостате можно изменять, регулирую напряжение, которое подается от регулируемого автотрансформатора к нагревателю 5. Охлаждение осуществляется с помощью добавления льда приготовленного из дистиллированной воды.
Сухая ячейка вакуумируется и взвешивается на аналитических весах. Затем из вентиля ячейки вывинчивается шпилька и с помощью медицинского шприца загружается g -бутиролактон. Ввинчивается шпилька, g -бутиролактон замораживается путем погружения ячейки в жидкий азот и ячейка вакуумируется. Когда она отсоединяется от вакуумной линии, g -бутиролактон плавится. Далее ячейка вновь погружается в жидкий азот и вакуумируется. Для полного удаления растворенного в жидкости воздуха требуется повторение этой операции 5-6 раз. Ячейка с обезгаженным g -бутиролактоном взвешивается и по разности масс загруженной и пустой ячейки определяется его масса.
Загруженная ячейка равновесия с помощью резиновой пробки вставляется в термостат 6 снизу и присоединяется с помощью конусного соединения 8 к разделителю масло-ртуть 10. Капилляр верхней части разделителя отсоединяется от масляной линии и присоединяется через разделительную емкость к форвакуумному масляному насосу. Происходит удаление воздуха из соединительных линий. После отсоединения вакуумного насоса ртуть заполняет линию от разделителя 10 до седла вентиля 9.
Разделитель масло-ртуть присоединяется к масляной линии конусным соединением и с помощью масляного пресса 13 создается давление. Открывается вентиль ячейки 9 и ртуть поступает в ячейку, сжимая исследуемую систему. В термостате 6 устанавливается необходимая температура и при требуемом значении давления производится энергичное перемешивание g -бутиролактона в ячейке кольцевым магнитом 4 до установления равновесия. Для этого требуется 15-20 мин. После установления равновесия с помощью катетометра определяется высота жидкой фазы g -бутиролактона в ячейке 3.
После проведения измерений при данном давлении g -бутиролактон сжимается и проводится эксперимент при новом значении давления. Получают информацию о поведении жидкой фазы при установленной температуре в широком интервале давлений. Затем изменяется температура термостата и вновь проводится эксперимент.
Таким образом, при одной загрузке ячейки можно получить информацию в широком интервале температур и давлений.
Подготовка ячейки к исследованию диоксида углерода производится аналогичным образом. После подготовки, с помощью конусного соединения ячейка присоединяется к сосуду определенного объема, в котором находится исследуемый газ. Из соединительной линии удаляется воздух, после открывания ячейки и погружения ее в жидкий азот намораживается газ. Ячейка закрывается, отепляется и взвешивается. Загруженная ячейка равновесия с помощью резиновой пробки вставляется в термостат и присоединяется с помощью конусного соединения к разделителю масло-ртуть.
Перед открытием вентиля ячейки, в установке необходимо создать давление, которое было бы выше равновесного давления на некоторую величину (P>Pравн.). Иначе, при недостаточном давлении в установке, газовая фаза способна вытолкнуть из ячейки запирающую ртуть, что также приведет к потере части исследуемого вещества. Затем открывается вентиль и ртуть поступает в ячейку, сжимая исследуемый диоксид углерода. В термостате устанавливается необходимая температура и при требуемом значении давления производится энергичное перемешивание жидкого диоксида углерода кольцевым магнитом до установления равновесия. После установления равновесия с помощью катетометра определяется высота жидкой фазы.
Полученные данные для обоих компонентов используются в дальнейшей обработке результатов исследований двухфазной системы. Так же их на основании определяется воспроизводимость литературных данных и делаются выводы о точности методики исследований.
После этого, производится загрузка диоксида углерода путем его намораживания в ячейку с g -бутиролактоном, которая погружена в жидкий азот. Ячейка отепляется, взвешивается и по разности масс загруженной ячейки и ячейки с g -бутиролактоном, определяется масса диоксида углерода. Загруженная ячейка равновесия вставляется в термостат и присоединяется к разделителю масло-ртуть 10.
Создание давления в системе и методика измерений аналогична методике, которая описана в предыдущем подразделе, примененной для исследования чистого диоксида углерода.
Таким образом, в результате исследований получают информацию о поведении жидкой фазы системы g -бутиролактон - оксид углерода в широком интервале температур и давлений.
 g-Бутиролактон (бутанолид) - C4H6O2, бесцветная гигроскопическая жидкость,
лактон g -гидроксимасляной кислоты. В воде медленно гидролизуется до g -гидроксимасляной кислоты.
Скорость гидролиза возрастает при нагреве в кислой среде. С NaOH образует Na-соль g -гидроксимасляной
кислоты. При взаимодействии с нуклеофилами разрывается связь между O и C в положении 5. Легко
растворяется во многих органических растворителях.
g-Бутиролактон (бутанолид) - C4H6O2, бесцветная гигроскопическая жидкость,
лактон g -гидроксимасляной кислоты. В воде медленно гидролизуется до g -гидроксимасляной кислоты.
Скорость гидролиза возрастает при нагреве в кислой среде. С NaOH образует Na-соль g -гидроксимасляной
кислоты. При взаимодействии с нуклеофилами разрывается связь между O и C в положении 5. Легко
растворяется во многих органических растворителях.
Для g -бутиролактона характерны реакции по активированной a -метиленовой группе (в положении 3) - хлорирование, бромирование, конденсация с бензальдегидом и др. Амины, NH3, гидразины и NH2OH раскрывают цикл g -бутиролактона с образованием амидов, гидразидов и гидроксамовых кислот. При взаимодействии с CO в присутствии никелевых или кобальтовых катализаторов образуется с высоким выходом глутаровая кислота. В таблице 1 приведены физико-химические свойства g -бутиролактона.
| № п/п | Наименование показателя | Ед.изм. | Значение |
| 1 | Молярная масса, M | г/моль | 86,09 |
| 2 | Температура плавления, tпл. | oС | - 44,0 |
| 3 | Температура кипения, tкип. | oС | 204,0 (134 oС при 100 мм рт.ст.) |
| 4 | Плотность, d420 | г/см3 | 1,1290 |
| 5 | Показатель преломления, nD20 | - | 1,4362 |
| 6 | Дипольный момент, m | Кл*м | 13,62*10-30 |
 Диоксид углерода (углекислый газ, угольный ангидрид, углекислота) CO2 - соединение углерода с
кислородом, конечный продукт окисления углерода; бесцветный, обладающий слегка кисловатым вкусом и
запахом, газ [8]. Свойства диоксида углерода приведены в таблице 2.
Диоксид углерода (углекислый газ, угольный ангидрид, углекислота) CO2 - соединение углерода с
кислородом, конечный продукт окисления углерода; бесцветный, обладающий слегка кисловатым вкусом и
запахом, газ [8]. Свойства диоксида углерода приведены в таблице 2.
С водой реагирует с образованием угольной кислоты. Термически диоксид углерода устойчив, диссоциирует на окись углерода и кислород при высокой температуре, процент диссоциации при 2000o, 2900o, 5000oС соответственно 2, 50 и 99.
Химически диоксид углерода инертен. С сильными основаниями он как ангидрид угольной кислоты энергично реагирует, образуя карбонаты. При высокой температуре реагирует с сильно электроположительными металлами, отдавая полностью или частично свой кислород. Диоксид углерода образуется при разложении органических углеродсодержащих веществ в процессах брожения, при сжигании топлив, является продуктом обмена веществ в организме и играет важную роль в процессе фотосинтеза. Получают диоксид углерода обжигом известняка или мела.
| № п/п | Наименование показателя | Ед.изм. | Значение |
| 1 | Молярная масса, M | г/моль | 44,011 |
| 2 | Температура плавления, tпл. | oС | - 56,65,2 ат |
| 3 | Температура сублимации, tвозг. | oС | - 78,47 |
| 4 | Плотность: -rг.
-rтв. -rж. |
г/л | 1,9770 1,560-79 1,101-37 |
| 5 | Критические параметры: -tкр. -pкр. -rкр. |
oC МПа г/см3 |
31,05 7,383 0,468 |
| 6 | Растворимость в воде | мл/ 100 г воды |
8820 2475 |
| 7 | Газовая постоянная, R | кДж/ (кг*К) |
0,188915 |
Для описания термодинамических свойств диоксида углерода в жидком состоянии очень важно знать уравнение состояния. В силу специфических особенностей жидкостей, которые занимают промежуточное положение между газами и кристаллами не только по структуре и интенсивности межмолекулярного взаимодействия, но и по способу теплового движения частиц, теория жидкостей заметно отстает в своем развитии от теории газового и кристаллического состояния вещества. Но хотя статистическая теория газов достигла высокого уровня развития, она дает возможность получить практически ценные результаты пока лишь в ограниченной области плотностей. Развитие вириального представления уравнения состояния на область жидкости или плотного газа позволяет получить во многих случаях удовлетворительные результаты с теоретической точки зрения, но для проведения практических числовых расчетов при высоких плотностях в настоящее время не имеет значения. Эти причины обусловили широкое распространение эмпирических и полуэмпирических форм, как для локальных, так и для единых уравнений состояния.
Известно несколько уравнений, описывающих состояние жидкого диоксида углерода. Наиболее пригодным из них является уравнение Путилова, которое в отличие от остальных, дает горизонтальную касательную к критической изотерме в критической точке, и по результатам расчетов [10] пригодно для определения p,n, T-зависимостей вплоть до Tкр.
Уравнение Путилова для жидкого диоксида углерода:
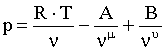 где А и В - функции температуры.
где А и В - функции температуры.
Так же интерес представляют единые уравнения состояния диоксида углерода. В работе [11] единое уравнение разработано на основании статистической обработки разнородных опытных данных.
Уравнение содержит 50 коэффициентов, область его применения достигает pmax=250 МПа и оно получено в следующей форме:
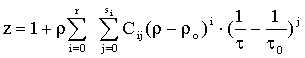 где to=1, ro=rкр.;r -плотность диоксида углерода; r, s - степени полинома.
где to=1, ro=rкр.;r -плотность диоксида углерода; r, s - степени полинома.
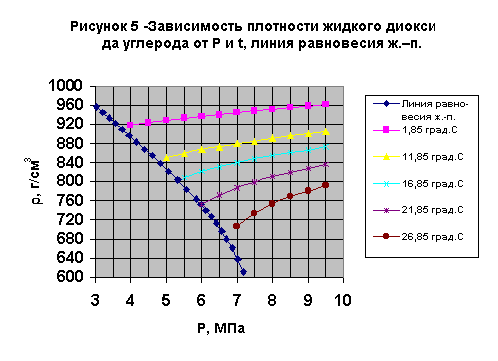
По этому уравнению проведен расчет многих термодинамических характеристик диоксида углерода [12]. Зависимости плотности жидкого диоксида углерода в широком диапазоне температур и давлений, линия равновесия жидкость - пар приведены на рис.5.
 Изучаемая система g -бутиролактон - диоксид углерода относится к двухкомпонентным, двухфазным
системам. Объемное поведение равновесной жидкой фазы системы g -бутиролактон - диоксид углерода
отличается своеобразием, заключающимся в том, что на изотермах молярных объемов наблюдается
отрицательное отклонение от аддитивности (рис.6). Это отклонение настолько велико, что приводит
к образованию минимума. С ростом температуры отклонение от аддитивных значений резко увеличивается
и, например, при температуре 30 oС достигает 31.5 %. Это можно связать с тем, что температура
системы близка к критической температуре диоксида углерода. Даже небольшие добавления g -бутиролактона
к жидкому диоксиду углерода приводят к резкому росту плотности раствора.
Изучаемая система g -бутиролактон - диоксид углерода относится к двухкомпонентным, двухфазным
системам. Объемное поведение равновесной жидкой фазы системы g -бутиролактон - диоксид углерода
отличается своеобразием, заключающимся в том, что на изотермах молярных объемов наблюдается
отрицательное отклонение от аддитивности (рис.6). Это отклонение настолько велико, что приводит
к образованию минимума. С ростом температуры отклонение от аддитивных значений резко увеличивается
и, например, при температуре 30 oС достигает 31.5 %. Это можно связать с тем, что температура
системы близка к критической температуре диоксида углерода. Даже небольшие добавления g -бутиролактона
к жидкому диоксиду углерода приводят к резкому росту плотности раствора.
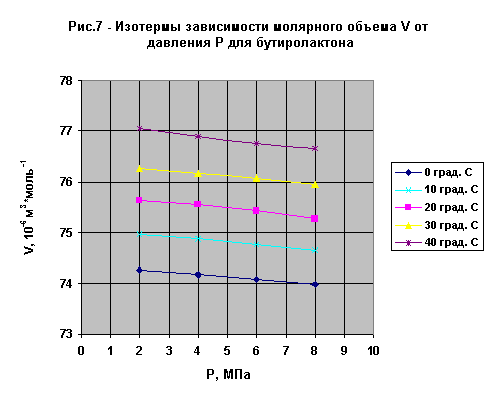
Вследствие того, что эти зависимости имеют ярко выраженный линейный характер, методом наименьших квадратов вычислены коэффициенты функциональной зависимости следующего вида:
V=A+B*T
V=A+B*P
A, B - коэффициенты функциональной зависимости;
T - температура, oС;
P - давление, МПа.
В таблицах 3,4 приведены коэффициенты функциональной зависимости такого вида.
| Давление P,МПа | Диапазон температур, oС | Коэффициент A |
Коэффициент B |
| 2 | 0-40 | 74,28 | 0,067 |
| 4 | 0-40 | 74,19 | 0,067 |
| 6 | 0-40 | 74,09 | 0,066 |
| 8 | 0-40 | 73,98 | 0,065 |
| Температура, oС | Диапазон давлений P,МПа | Коэффициент A |
Коэффициент B |
| 0 | 2-8 | 74,37 | 0,049 |
| 10 | 2-8 | 75,08 | 0,051 |
| 20 | 2-8 | 75,77 | 0,060 |
| 30 | 2-8 | 76,38 | 0,053 |
| 40 | 2-8 | 77,17 | 0,065 |
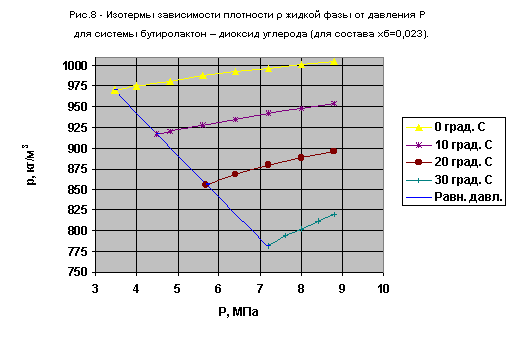
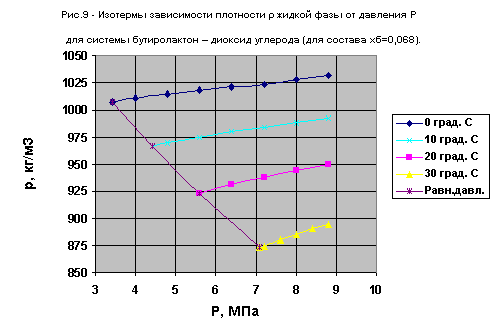
В таблицах 5,6 приведены данные по зависимости молярного объема и плотности жидкой фазы от давления и температуры для составов системы g -бутиролактон - диоксид углерода, близких к чистому диоксиду углерода.
| № п/п |
Температура, oС | Давление P,МПа | Молярный объем жидкой фазы, 10-6 м3*моль-1 |
Плотность жидкой фазы,кг/м3 |
| 1 | 0 | 4,0 | 46,12 | 975,2 |
| 2 | 0 | 4,8 | 45,84 | 981,2 |
| 3 | 0 | 5,6 | 45,55 | 987,4 |
| 4 | 0 | 6,4 | 45,32 | 992,5 |
| 5 | 0 | 7,2 | 45,12 | 996,8 |
| 6 | 0 | 8,0 | 44,93 | 1001,1 |
| 7 | 0 | 8,8 | 44,76 | 1004,9 |
| 8 | 10 | 4,8 | 48,86 | 920,6 |
| 9 | 10 | 5,6 | 48,47 | 928,0 |
| 10 | 10 | 6,4 | 48,10 | 935,1 |
| 11 | 10 | 7,2 | 47,75 | 942,0 |
| 12 | 10 | 8,0 | 47,44 | 948,2 |
| 13 | 10 | 8,8 | 47,15 | 954,0 |
| 14 | 20 | 5,6 | 52,60 | 855,1 |
| 15 | 20 | 6,4 | 51,80 | 868,3 |
| 16 | 20 | 7,2 | 51,16 | 879,2 |
| 17 | 20 | 8,0 | 50,62 | 888,6 |
| 18 | 20 | 8,8 | 50,19 | 896,2 |
| 19 | 30 | 7,2 | 57,52 | 782,0 |
| 20 | 30 | 7,6 | 56,62 | 794,4 |
| 21 | 30 | 8,0 | 56,04 | 802,7 |
| 22 | 30 | 8,4 | 55,40 | 811,8 |
| 23 | 30 | 8,8 | 54,86 | 819,9 |
| № п/п |
Температура, oС | Давление P,МПа | Молярный объем жидкой фазы, 10-6 м3*моль-1 |
Плотность жидкой фазы,кг/м3 |
| 1 | 0 | 4,0 | 46,37 | 1010,9 |
| 2 | 0 | 4,8 | 46,21 | 1014,4 |
| 3 | 0 | 5,6 | 46,04 | 1018,1 |
| 4 | 0 | 6,4 | 45,90 | 1021,3 |
| 5 | 0 | 7,2 | 45,78 | 1023,8 |
| 6 | 0 | 8,0 | 45,61 | 1027,7 |
| 7 | 0 | 8,8 | 45,45 | 1031,2 |
| 8 | 10 | 4,8 | 48,34 | 969,7 |
| 9 | 10 | 5,6 | 48,10 | 974,5 |
| 10 | 10 | 6,4 | 47,84 | 979,7 |
| 11 | 10 | 7,2 | 47,66 | 983,6 |
| 12 | 10 | 8,0 | 47,44 | 988,0 |
| 13 | 10 | 8,8 | 47,25 | 992,1 |
| 14 | 20 | 5,6 | 50,77 | 923,2 |
| 15 | 20 | 6,4 | 50,35 | 930,9 |
| 16 | 20 | 7,2 | 49,98 | 937,8 |
| 17 | 20 | 8,0 | 49,64 | 944,2 |
| 18 | 20 | 8,8 | 49,36 | 949,6 |
| 19 | 30 | 7,2 | 53,59 | 874,7 |
| 20 | 30 | 7,6 | 53,23 | 880,5 |
| 21 | 30 | 8,0 | 52,94 | 885,6 |
| 22 | 30 | 8,4 | 52,65 | 890,3 |
| 23 | 30 | 8,8 | 52,39 | 894,6 |
По этим данным построены изобары зависимости молярных объемов от состава жидкой фазы для температур 20 и 30 oС в диапазоне давлений 5,6 - 8,8 МПа (см.рис.10,11). При приближении ее состава к чистому диоксиду углерода и температуры к критической температуре диоксида углерода происходит резкое повышение сжимаемости жидкой фазы. При этом для исследованных составов жидкой фазы при давлениях превышающих максимальное ортобарическое давление при данной температуре кривые зависимости молярных объемов от состава проходят ниже соответствующих кривых для равновесных давлений.

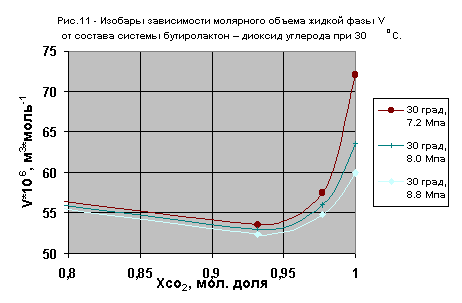
Так, при температуре 31,2 oС в жидкой фазе, содержащей 6,8 % (мол.) g -бутиролактона, наблюдается появление второй жидкой фазы, количество которой существенно возрастает с ростом температуры. Обнаруженное явление нуждается в дальнейшем более тщательном исследовании с целью определения координат области гетерогенности.
Изучена сжимаемость жидкой фазы двухкомпонентных растворов g -бутиролактон - диоксид углерода для составов примыкающих к чистому диоксиду углерода. Установлена повышенная сжимаемость двухкомпонентных жидких растворов, богатых диоксидом углерода по сравнению с чистым g -бутиролактоном.
В дальнейшем предполагается исследовать сжимаемость жидкой фазы данной системы во всем диапазоне составов с целью определения парциальных молярных объемов компонентов в жидкой фазе.
Полученные данные могут быть использованы для проведения расчетов тепловых балансов технологических схем очистки газа с помощью g -бутиролактона.
2. Bessieres D., Saint-Guirons H., Daridon J. Volumetric behavior of decane + carbon dioxide at high pressures. Measurement and calculation. Journal of chemical and engineering data, Vol. 46, No. 5, 2001.
3. Kiran E., Pohler H., Xiong Y. Volumetric properties of pentane + carbon dioxide at high pressures. Journal of chemical and engineering data, Vol. 41, No. 2, 1996.
4. Химическая энциклопедия. Т. 1. Гл. ред. Кнунянц И.Л. М., Советская энциклопедия. 1988.
5. Спайс Дж. Химическая связь и строение. М., Мир. 1966.
6. Howard A., McIver J., Collins J. Hyperchem computational chemistry.P. 1,2. Hypercube Inc. Canada. 1996.
7. Гордон А., Форд Р. Спутник химика. М., Мир. 1976.
8. Краткая химическая энциклопедия. Т. 5. Советская энциклопедия. 1967.
9. Справочник химика. Т.4, Ленинград, Химия. 1967.
10. Суворов Н.П. ЖФХ. Т. 34 (стр. 1938). 1960.
11. Алтунин В.В., Гадецкий О.Г. "Теплоенергетика", Т. 18. № 3. 1971.
12. Алтунин В.В. Теплофизические свойства двуокиси углерода. Изд. стандартов. М., 1975.