|
Л. А. Цветков Источник Internet: http://w-rabbit.narod.ru/chem/metan.htm Метан, его строениеПринадлежность веществ к группе предельных углеводородов определяется
характером их строения. Рассмотрим строение наиболее простого углеводорода
– метана.
Метан CH4 – газ без цвета и запаха, почти в два раза легче
воздуха. Он образуется в природе в результате разложения без доступа
воздуха остатков растительных и животных организмов. Поэтому он может быть
обнаружен, например, в заболоченных водоемах, в каменноугольных шахтах. В
значительных количествах метан содержится в природном газе, который широко
используется сейчас в качестве топлива в быту и на производстве.
В молекуле метана химические связи атомов водорода с атомом углерода
имеют ковалентный характер. Если перекрывающиеся попарно электронные
облака при образовании связей обозначить двумя точками или валентной
черточкой, строение метана можно выразить формулами:
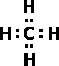 или
или 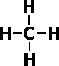 Когда в органической химии стало развиваться учение о
пространственном строении молекул, было выяснено, что молекула метана в
действительности имеет тетраэдрическую форму, а не плоскую, как мы
изображаем на бумаге.
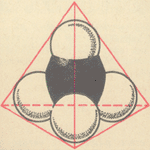 Выясним, почему же молекула метана представляет собой тетраэдр. Мы должны
исходить, очевидно, из строения атома углерода. Но здесь мы сталкиваемся с
противоречием. У атомов углерода четыре валентных электрона, два из них
являются спаренными s-электронами, они не могут образовывать химических
связей с атомами водорода. Химические связи могут установиться только за
счет двух неспаренных p-электронов. Но тогда молекула метана должна иметь
формулу не CH4, а CH2, что не соответствует
действительности. Такое противоречие устраняется следующей трактовкой
образования химических связей.
Выясним, почему же молекула метана представляет собой тетраэдр. Мы должны
исходить, очевидно, из строения атома углерода. Но здесь мы сталкиваемся с
противоречием. У атомов углерода четыре валентных электрона, два из них
являются спаренными s-электронами, они не могут образовывать химических
связей с атомами водорода. Химические связи могут установиться только за
счет двух неспаренных p-электронов. Но тогда молекула метана должна иметь
формулу не CH4, а CH2, что не соответствует
действительности. Такое противоречие устраняется следующей трактовкой
образования химических связей.Когда атом углерода вступает во взаимодействие с атомами водорода,
s-электроны наружного слоя в нем распариваются, один из них занимает
вакантное место третьего p-электрона и образует при своем движении облако
в виде объемной восьмерки, перпендикулярное по отношению к облакам двух
других p-электронов. Атом при этом переходит, как говорят, в возбужденное
состояние. Теперь все четыре валентных электрона стали неспаренными, они
могут образовать четыре химические связи. Но возникает новое противоречие.
Три p-электрона должны образовать три химические связи с атомами водорода
во взаимно перпендикулярных направлениях, т. е. под углом 90°, а четвертый
атом водорода мог бы присоединяться в произвольном направлении, так как
облако s-электрона имеет сферическую форму и эти связи, очевидно,
отличались бы по свойствам. Между тем известно, что все связи C—H в
молекуле метана одинаковы и расположены под углом 109°28'. Разрешить это
противоречие помогает представление о гибридизации электронных
облаков.
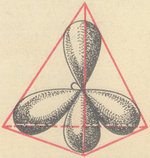 В процессе образования химических связей облака всех валентных электронов
атома углерода (одного s- и трех p-электронов) выравниваются, становятся
одинаковыми. При этом они принимают форму несимметричных, вытянутых в
направлении к вершинам тетраэдра объемных восьмерок (несимметричное
распределение электронной плотности означает, что вероятность нахождения
электрона по одну сторону от ядра больше, чем по другую).
В процессе образования химических связей облака всех валентных электронов
атома углерода (одного s- и трех p-электронов) выравниваются, становятся
одинаковыми. При этом они принимают форму несимметричных, вытянутых в
направлении к вершинам тетраэдра объемных восьмерок (несимметричное
распределение электронной плотности означает, что вероятность нахождения
электрона по одну сторону от ядра больше, чем по другую).Угол между осями гибридных электронных облаков оказывается равным
109°28', что позволяет им, как одноименно заряженным, максимально
удалиться друг от друга. Будучи вытянутыми к вершинам тетраэдра, такие
облака могут значительно перекрываться с электронными облаками водородных
атомов, что ведет к большему выделению энергии и образованию прочных,
одинаковых по свойствам химических связей (рис. А). |
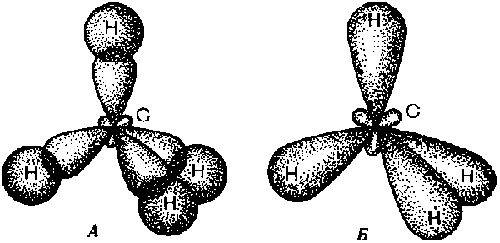 Ковалентные химические связи в молекуле метана: А – перекрывание
электронных облаков атома углерода с атомами водорода; Б – образование
общих электронных облаков связей C—H.
Ковалентные химические связи в молекуле метана: А – перекрывание
электронных облаков атома углерода с атомами водорода; Б – образование
общих электронных облаков связей C—H. |
|
Гибридизация может распространяться на разное число электронных
облаков. В данном случае, когда атом углерода образует ковалентные связи с
четырьмя атомами водорода, в гибридизации участвуют облака всех четырех
наружных электронов возбужденного атома – одного s-электрона и трех
p-электронов. Такой вид ее называется sp3-гибридизацией.
Тетраэдрическая форма молекулы метана обусловливается, следовательно,
тетраэдрическим направлением четырех гибридных электронных облаков атома
углерода в химическом соединении.
Поскольку электроны при образовании ковалентных связей образуют общие
для связываемых атомов облака, охватывающие оба ядра, электронное строение
молекулы метана можно еще изобразить так, как показано на рис. Б.
|