Лебедев Константин Александрович
Автореферат магистерской работы
"Особенности кинетики и развития реакционной
зоны
при высокотемпературном окислении меди"
Содержание
ЭКСПЕРИМЕНТАЛЬНО-МЕТОДИЧЕСКАЯ ЧАСТЬ
-
Термогравиметрическая установка для изучения процесса окисления
-
Методика подготовки образцов к микроскопическим исследованиям
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Систематические исследования по окислению металлов [1-11] были вызваны бурным развитием техники в начале XX столетия. Первые работы в этом направлении были выполнены в связи с нуждами теплотехники, теплоэнергетики и обработки металлов. В дальнейшем промышленность выдвигала все новые и новые требования к материалам для машин. Повышение рабочих параметров машин вызвало необходимость создания жаростойких и жаропрочных сплавов, свойства которых лимитировали и продолжают лимитировать сейчас решение ряда технических задач. Несомненно, один из самых распространенных и часто используемых в мире металлов является медь. Этот металл находит широкое применение не только в электротехнике, машиностроении и народном хозяйстве, около 30% всей меди используется в металлургии для создания других сплавов, таких как бронза, латунь и др. Ежегодно от взаимодействия меди с кислородом из воздуха в мире теряется в виде окалины от 5 до 10% металла [7]. На этом фоне актуальной становится задача изучения физико-химических свойств меди, установление механизмов и скоростей её взаимодействия с отдельными компонентами окружающей среды. Качественным скачком в этом направлении было появление работ Вагнера [6, 11], в которых заложены основы теории окисления различных металлов, базирующейся на рассмотрении механизма переноса вещества через кристаллическую решетку продуктов взаимодействия металла с окислителем.
Целью настоящей работы является изучение термодинамики, кинетики и механизма высокотемпературного окисления меди, выявление факторов, определяющих динамику этого процесса, а также попытка внесения некоторых новых дополнений к существующим общепринятым положениям. В результате экспериментов по высокотемпературному окислению меди было установлено, что развитие реакционной зоны протекает несколько отлично от сложившихся в химии твердого тела канонов, что делает эти исследования очень актуальными.
ЭКСПЕРИМЕНТАЛЬНО-МЕТОДИЧЕСКАЯ ЧАСТЬ
Для исследования
применялась электротехническая медь с массовым ее содержанием около 99,95%.
Проволочки диаметром 0,3 мм и пластинки толщиной 0,5 мм предварительно очищались
от оксидной пленки с помощью наждачной бумаги. Диаметр проволочки и толщину
медной пластины измеряли с помощью микрометра. Масса образца выбиралась в
пределах 1 грамма, что вполне достаточно удовлетворяло точности эксперимента.
Проволочку, свернутую в виде спирали, или пластинку, подвешивали на платиновую
подвеску в холодную печь, после чего производили центровку образца с целью не
допустить его касания стенок печи.
Термогравиметрическая установка для изучения процесса
окисления
Схема лабораторной
установки [10] показана на рис. 1. Установка представляет собой термовесы для
непрерывного контроля изменения массы и температуры. Температурный режим печи
(4), измеряемый платинородий-платиновой (ПП) термопарой (5) и цифровым
вольтметром В7-34А (6), поддерживали с помощью тиристорного регулятора ВРТ-3
(7). Горячий спай термопары располагался на расстоянии 2-3 мм от поверхности
образца (3), температура холодного спая учитывалась поправкой при расчете
температу-ры по эдс. Непрерывное определение изменения массы осуществлялось с
помощью аналитических весов ВЛЭ-200 (1) с последующей регистрацией са-мопишущим
прибором КСП-4 (8). Регулирование парциального давления ки-слорода выполнялось
разбавлением воздуха аргоном из баллона (10) и контролировалось газоанализатором
"Флюорит" (9)
Погрешности приборов, используемых в гравиметрической установке:
– при измерении массы в диапазоне шкалы 0-200 мг (ВЛЭ-200)±0,1 мг;
– основная относительная погрешность газоанализатора "Флюорит" при объемной
концентрации кислорода от 0,001 до 100% составляет ±4%;
– точность регулирования температуры регулятором ВТР-3 составляет ±4%;
– погрешность, вносимая недостаточной определенностью температуры хо-лодных
спаев термопары при измерении ЭДС<0.015%.
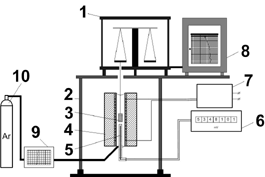
Рисунок 1 - Экспериментальная установка
Методика проведения изотермического эксперимента окисления
Методика проведения изотермического эксперимента заключается в следующем [8]. Образец, перед экспериментом тщательно обмерялся и взвешивался на аналитических весах. После внесения образца в печь она включалась в максимальном режиме нагрева. Тепловое равновесие в печи наступало в течение 25-30 минут. Фиксирование времени также как и изменения массы осуществлялось потенциометром КСП-4. Извлеченные из печи образцы остывали на воздухе.
Методика
подготовки образцов к микроскопическим
исследованиям
Остывшие до комнатной температуры образцы подвергались микроскопическому исследованию. Для этого они помещались в специально подготовленные бумажные формочки и заливались эпоксидной смолой, после от-вердевания которой подвергались шлифовке с помощью наждачной бумаги. Окончательная полировка поверхности осуществлялась с помощью пасты Гойя.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
С целью изучения механизма окисления меди применялись оптические исследования [12]. Идентификация продуктов окисления осуществлялась с помощью рентгенофазового анализа [12].
Микроскопические методы исследования
Микроскопические исследования осуществлялись с помощью оптического "Биолам С-11" и металло-графического МИМ-7 микроскопов. Оптический микроскоп представляет собой классический образец светового микроскопа. Микроскоп МИМ-7 предназначен для наблюдения и фотографирования микроструктуры металлов и окислов как в обыковенном свете (в светлом и темном поле) так и в поляризованном светлом поле.
Рентгенофазовый анализ продуктов окисления осуществлялся с помощью метода
Дебая-Шерера, известного также как метод порошка. Для этого с окисленных
образцов аккуратно снималась окалина, которая подвергалась измельчению в
агатовой ступке под слоем этилового спирта с целью получения мелкодисперсного
порошка. После высыхания порошок подвергался прессованию гидравлическим прессом
в таблетки диаметром 10 мм и толщиной 5 мм под давлением 50±5 кгс/см2.
В качестве дифрактометра использовался прибор ДРОН-3. На установ-ке
использовалось не фильтрованное Fe Kα и Кβ-излучение в
диапазоне сканирования 10o<2θ<120o со скоростью 1 град./мин.
Полученные в результате дифрактограммы расшифровывались с помощью закона
Брэгга с целью определения основных параметров кристаллической решетки.
Результаты термогравиметрического исследования процесса
окисления медной проволочки диаметром 0,30 мм
После обработки
результатов термогравиметрического исследования проволочек диаметром 0,30 мм при
температурах 600, 800 и 900оС был получен график (см. рис. 2)
зависимости кислородного стехиометрического коэффициента x,
образовавшегося соединения CuOx, в зависимости от времени
окисления t. Величина коэффициента x, зависящая от массы
вступившего в реакцию кислорода, согласно теории Вагнера [2,
11] ,должна быть
пропорциональна квадратному корню из времени изотермического окисления. На
графике приведены экспериментальные точки процессов окисления, с проведенными
через них с помощью математической обработки, параболами [13].
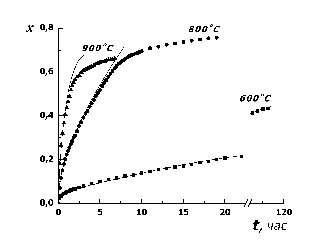
Рисунок 2 - Зависимость кислородного стехиометрического коэффициента
от времени окисления при температурах 600, 800 и 900оС
Если при температуре 600оС
для всего изученного интервала окисления x = 0-0,45 экспериментальные
данные достаточно точно описываются параболическим законом, то при температурах
800 и 900оС окисление протекает по параболическому закону до x
= 0,5-0,55. Затем следует резкое замедление кинетики, о чем говорит излом на
кинетических кривых в сторону уменьшения приращения стехиометрического
коэффициента за равные промежутки времени.
Следует заметить, что некоторыми исследователями было отмечено некоторое
отклонение экспериментальных данных от теоретически ожидаемых. Это объяснялось
наличием напряжений в слое оксида, что вызывало образование трещин, облегчавших
встречную диффузию кислорода к поверхности реакционной зоны, что в свою очередь
должно было увеличивать скорость окисления.
Объяснение причины замедления кинетики при высоких температурах может быть
объяснено путем изучения механизма процесса окисления по результатам
микроскопических исследований продуктов реакции в различные моменты времени,
которые будут представлены (см.здесь).
Для определения момента замедления скорости окисления, а также нахождения
констант параболического роста окалин для различных температур, с целью
сравнения с данными других исследователей, данные термогра-виметрического
исследования были представлены в параболических координатах (рис.3). Здесь по
оси абсцисс отложено время процесса изотермического окисления t, а по оси
ординат – квадрат отношения удельного прироста массы образца m(O) к
первоначальной площади поверхности образца S. Параболический закон в данных
координатах должен соблюдаться в линеаризованной форме.
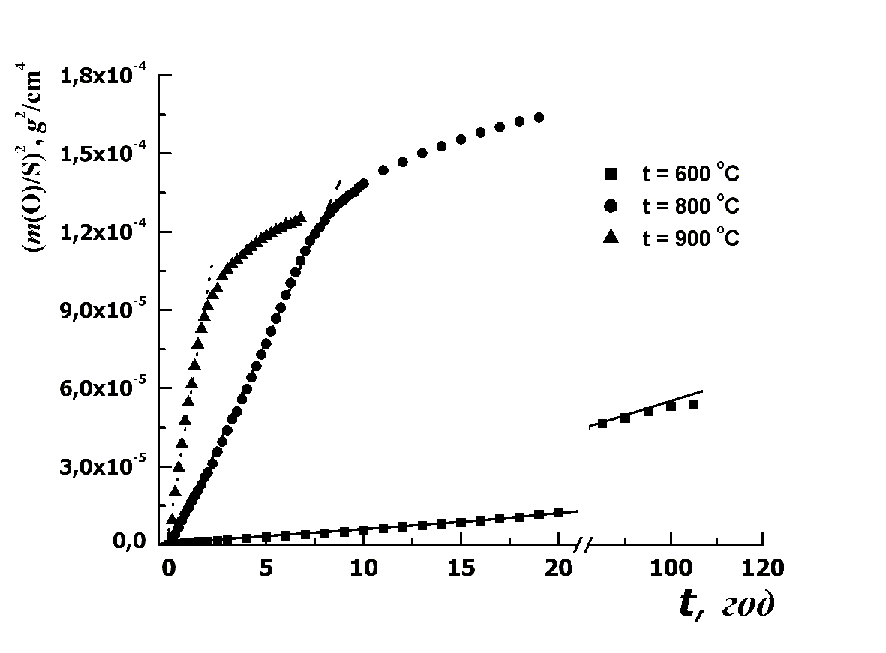
Рисунок 3 – Результаты термогравиметрического исследования медных
проволочек диаметром 0,30 мм
Тангенс угла наклона линеаризованной кривой к оси абсцисс на участке, где соблюдается параболический закон, определенный с помощью статистической обработки, представляет собой константу параболического роста.
Таблица 1 – Значение константы параболического роста окалинообразования в зависимости от температуры
|
Температура эксперимента, оС |
Константа параболического роста, g2/cm4h |
Коэффициент корреляции r |
Ошибка |
|
600 |
5,4575e-7 |
0,9982 |
±4,5542e-9 |
|
800 |
1,6222e-5 |
0,9991 |
±1,1445e-7 |
|
900 |
4,6313e-5 |
0,9894 |
±1,5555e-6 |
Значение энергии активации и предэкспоненциального множителя также были определены путем математической обработки результатов изотермических опытов в координатах ln(k)=f(1/T) (рис. 4).
f1T.gif)
Рисунок 4 – Влияние температуры на величину константы окалинообразования. ln(k)=7.97-1376/T
Величина энергии активации
процесса окисления равна 11440 Дж/г-атом.
На рис. 5 приведено сравнения полученных констант параболического роста окалины на промежутке, подчиняющегося параболическому закону, с данными, полученными другими исследователями [15, 16].
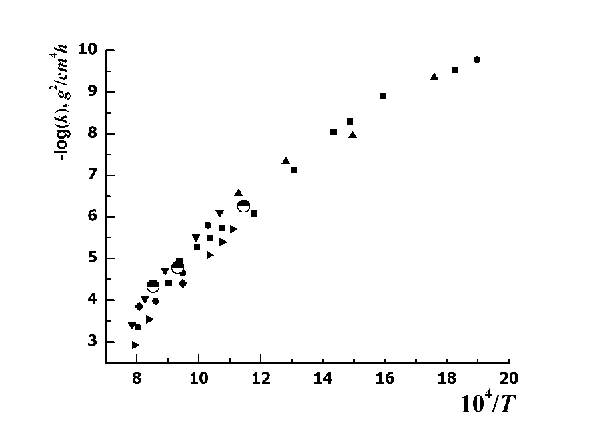
Рисунок 5 – Зависимость константы скорости окисления меди
от температуры
Как видно из рис. 5 совпадение полученных нами константах скоростей окисления с данными других исследователей очевидно. Это говорит о том, что степень окисления, достигнутая ими в своих экспериментах едва достигает значения x = 0,5, что далеко до равновесного состояния в условиях проведения эксперимента (T = 873, 1073, 1173оK, p(O2) = 0.21 атм).
Микроскопические исследования окисления меди
Микроскопические исследования шлифов окисленных образцов показали [14], что
первоначально на поверхности образуется слой оксида меди (II), увеличивающийся
за счет роста нитевидных кристаллов – усов. На рис. 6, a
приведена микрофотография образца, подвергшемуся кратковременному окисления при
температуре 800оС. По мере уплотнения нитевидных
кристаллов в местах их контакта происходит рекристаллизация, см.
рис.6, b, что приводит к формированию на поверхности более плотного
кристаллического слоя CuO, облада-ющего повышенным диффузионным сопротивлением и
светоотражающей способностью. За счет увеличения диффузионного сопротивления,
связанного с образованием плотного слоя рекристаллизованного CuO, происходит
рост красного слоя куприта (Cu2O) со стороны металла-подложки. На
рис. 6. c, d представлен образец, окисление которого
было прекращено на этом этапе. Вследствие неравномерности уплотнения наружного
слоя, а также образования микро- и макротрещин в слое окалины из-за большой
разности в эквивалентных молярных объемах металлической меди (Ve=7.12 см3/моль)
и оксида меди (I) (Ve=23.42 см3/моль), реакционная зона
разбивается на многочисленные "фрагменты" фазы Cu2O (см.
рис. 6, f, h), окружен-ные рекристаллизованным слоем
фазы CuO. Подобной фрагментации сопутствует локальный
процесс восстановления зерен мелкокристаллического CuO до Cu2O по
реакции CuO+Cu=Cu2O, за счет поверхностной диффузии меди к
реакционной зоне, который продол-жается до тех пор пока сохраняется
металлическая медь. Момент исчезновения металлической меди соответствует моменту
излома на кинетической кривой, что может быть объяснено исчезновением трещин и
других путей облегченной диффузии.
Таким образом, образовавшая "фрагментированная" двухфазная смесь оксидов
меди Cu2O и CuO, представленная на рис.
6, h, чрезвычайно пассивна дальнейшему
окислению.
|
|
|
|
|
|
 d d |
|
|
|
 f
f |
|
 g
g |
 h
h |
Рисунок 6 – Микрофотографии исследуемых образцов
1 - Cu; 2 - нитевидные кристаллы CuO;
3 - рекристаллизованные кристаллы CuO; 4 - Cu2O
Согласно результатам РФА (XRD), образовавшаяся двухфазная система Cu2O-CuO после 7-ми часового окисления медной проволочки диаметром 0,30 мм в атмосфере воздуха при 900оС, далека от равновесного состояния CuO. На рис. 7 приведена индицированная рентгенограмма [12] с рассчитанными межплоскостными расстояниями.
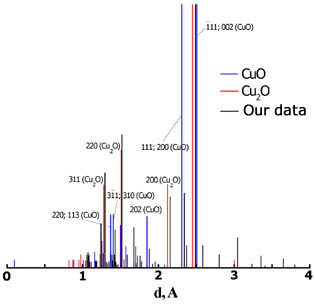
Рисунок 7 – Щтрих-дифрактограмма исследуемого образца
На штрих-дифрактограмме показана зависимость интенсивности, отраженных рентгеновских лучей от соответствующей плоскости, обозначенной с помощью индексов Миллера, от величины межплоскостного расстояния.
Результаты термогравиметрического исследования процесса
окисления медного порошка
В случае, когда
геометрические размеры образца будут такими, что период фрагментации реакционной
зоны будет минимален или отсутствовать вообще, можно предположить, что кинетика
окисления будет подчиняться параболическому закону на протяжении всего
эксперимента. С целью подтверждения этой гипотезы в качестве образца был выбран
порошок металлической меди с размерами порядка 10 мкм.
Результаты термогравиметрического исследования процесса
окисления медного порошка при температурах 600 и 700оС представлены
на рис.8.
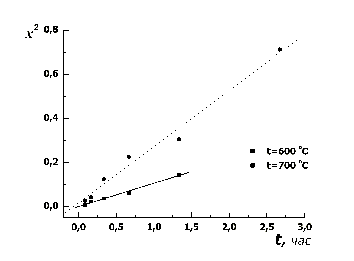
Рисунок 8 – Результаты термогравиметрического исследования
процесса окисления медного
порошка
По причине сложности
определения площади поверхности полидисперсного порошка, график был построен в
параболических координатах, где по оси абсцисс отложено время процесса окисления,
а по оси ординат – квадрат кислородного нестехиометрического коэффициента x
(CuOx), который пропорционален массе вступившего в реакцию
кислорода.
Из рисунка 8 следует, что при температуре 700оС наблюдается не
значительное отклонение от параболического закона для образца, имеющего
небольшие геометрические размеры.
Отсюда можно сделать вывод, что явление "фрагментации" реакционной зоны,
вызванное различием эквивалентных молярных объемов Cu и Cu2O, которое
осуществляет роль "генератора" новых путей облегченной диффузии, оказывает
большое значение на механизм протекания процесса окисления.
![]() На основе анализа
литературных данных по влиянию физических факторов на скорость
высокотемпературного окисления меди осуществлен выбор схемы экспериментальной
установки и методики проведения изотермического эксперимента;
На основе анализа
литературных данных по влиянию физических факторов на скорость
высокотемпературного окисления меди осуществлен выбор схемы экспериментальной
установки и методики проведения изотермического эксперимента;
![]() Термодинамический анализ позволил установить возможность протекания реакций,
сопровождающих процесс окисления меди при условиях проведения эксперимента;
Термодинамический анализ позволил установить возможность протекания реакций,
сопровождающих процесс окисления меди при условиях проведения эксперимента;
![]() Проведено термогравиметрическое исследование образцов медной проволочки
диаметром 0,30 мм с целью определения кинетического закона окисления;
Проведено термогравиметрическое исследование образцов медной проволочки
диаметром 0,30 мм с целью определения кинетического закона окисления;
![]() В изученном интервале степеней окисления цилиндрических образцов при
температуре 600оС подтверждена теория Вагнера для образования толстых
слоев окалины. При температурах 800 и 900оС отмечено резкое
откло-нение данных от параболического закона;
В изученном интервале степеней окисления цилиндрических образцов при
температуре 600оС подтверждена теория Вагнера для образования толстых
слоев окалины. При температурах 800 и 900оС отмечено резкое
откло-нение данных от параболического закона;
![]() С помощью математической обработки данных определены кинетические
характеристики процесса окисления (константы параболического роста
окалинообразования, энергия активации). Проведено сравнение полученных констант
с данными других исследователей;
С помощью математической обработки данных определены кинетические
характеристики процесса окисления (константы параболического роста
окалинообразования, энергия активации). Проведено сравнение полученных констант
с данными других исследователей;
![]() При температурах 800 и 900оС обнаружено резкое уменьшение скорости
реакции окисления задолго до достижения равновесного состояния системы. На
основе микроскопических исследований установлен механизм процесса окисления.
Замедление кинетики объясняется необычным характером развития реакционной зоны
по сравнению со сложившимися представлениями о механизме твердофазных реакций;
При температурах 800 и 900оС обнаружено резкое уменьшение скорости
реакции окисления задолго до достижения равновесного состояния системы. На
основе микроскопических исследований установлен механизм процесса окисления.
Замедление кинетики объясняется необычным характером развития реакционной зоны
по сравнению со сложившимися представлениями о механизме твердофазных реакций;
![]() Рекристаллизация нитевидных кристаллов CuO приводит к увеличению
диффузионного сопротивления, что вызывает рост фазы Cu2O со стороны
металла-подложки;
Рекристаллизация нитевидных кристаллов CuO приводит к увеличению
диффузионного сопротивления, что вызывает рост фазы Cu2O со стороны
металла-подложки;
![]() Явление "фрагментации" реакционной зоны, вызванное значительным различием
эквивалентных молярных объемов Cu и Cu2O, приводит к появлению новых
путей облегченной диффузии;
Явление "фрагментации" реакционной зоны, вызванное значительным различием
эквивалентных молярных объемов Cu и Cu2O, приводит к появлению новых
путей облегченной диффузии;
![]() С помощью рентгенографического метода исследования определен химический
состав окалины, образующийся на поверхности образцов медной проволочки после
длительного нагрева при температуре 900оС. Исчезновение металлической
фазы соответствует моменту замедления скорости окисления;
С помощью рентгенографического метода исследования определен химический
состав окалины, образующийся на поверхности образцов медной проволочки после
длительного нагрева при температуре 900оС. Исчезновение металлической
фазы соответствует моменту замедления скорости окисления;
![]() Образовавшаяся "фрагментированная" двухфазная смесь CuO и Cu2O,
чрезвычайно пассивна дальнейшему окислению;
Образовавшаяся "фрагментированная" двухфазная смесь CuO и Cu2O,
чрезвычайно пассивна дальнейшему окислению;
![]() Термогравиметрические исследования медного порошка в отличии от окисления
проволочки не выявили значительного отклонения от параболического закона;
Термогравиметрические исследования медного порошка в отличии от окисления
проволочки не выявили значительного отклонения от параболического закона;
![]() Геометрические размеры образца оказывают непосредственное влияние на механизм
развития реакционной диффузионной зоны.
Геометрические размеры образца оказывают непосредственное влияние на механизм
развития реакционной диффузионной зоны.
1. Будников П.П. и Гистлинг А.М. Реакции в смесях твердых веществ. –М.: Стройиздат, –1965. –474 с. с ил.
2. Хауффе К. Реакции в твердых телах и на их поверхности. –М.: Изд-во иностр. лит-ры. –1963. –Т.2. –276 с.
3. Барре П. Кинетика гетерогенных процессов. –М.: Мир, –1976. –400 с.
4. Кофстад П. Высокотемпературное окисление металлов. –М.: Мир, –1969. –392с.
5. Окисление металлов./ Под. ред. Бенара Ж. Перев. с франц. – M.: Металлургия, –1969. –T.1., –444 с.
6. Хауффе К. Реакции в твердых телах и на их поверхности. –М.: Изд-во иностр. лит-ры. –1963. –Т.1. –276 с.
7. Эванс Ю.Р. Коррозия, пассивность и защита металлов. –М., –Л.: Металлургиздат, –1941. –885 с.
8. Oxidation of Copper to Cu2O and CuO (600-1000˚C and 0.026-20.4 atm. Oxygen) Bridges D, Baur J., Baur Y., Fassel W. // J. Electrochem. Soc. –1956. –v.103. –№9. –p. 475-478.
9. Окисление металлов./ Под. ред. Бенара Ж. Перев. с франц. – M.: Металлургия. –1969. –T.2., –444 с.
10. Benard J. Nouvelles recherches sur l'oxydation du aux temperatures elevees per la methode micrographique // Revue de Metallurgie. –1946. –v. 43. –p. 113-124.
11. Wagner C. Diffusion and High Temperature Oxidation of Metals//Atom Movement. –Cleveland, –1951. –p. 153.
12. Вест А. Химия твердого тела. –М.: Изд-во иностр. лит-ры. –1982. –630 с. с ил.
13. Лазарев Ю. Ф. Matlab 5.x. –К.: Издательская группа BHV, –2000. –384 с.
14. Лебедев К.А., Приседский В. В., Виноградов В.М. Особенности кинетики и строения реакционной зоны при высокотемпературном окислении меди // Донецк: ДонНТУ, –2004. –с. 36.
15. Третьяков Ю.Д. Твердофазные реакции. –М.: Химия. –1978. – 452 с.
16. Kubaschewski O. and Hopkins B. Oxidation of Metals and Alloys// Butterworth. –1962. –p. 23.
Вверх | Автобиография | Библиотека | Интернет поиск | Ссылки | Поисковик ДонНТУ | Сайт магистров
© ДонНТУ, Лебедев Константин

 a
a b
b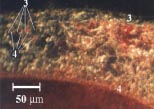 c
c e
e